曹勇, 郭倩, 田成旺, 张铁军, 任涛, 李翔宇, 成娅婷 . 疏风解毒胶囊HPLC指纹图谱研究[J]. 中草药, 2016, 47(12): 2034-2039.

CAO Yong, GUO Qian, TIAN Cheng-wang, ZHANG Tie-jun, REN Tao, LI Xiang-yu, CHENG Ya-ting . HPLC fingerprint of Shufeng Jiedu Capsule[J]. Chinese Traditional and Herbal Drugs, 2016, 47(12): 2034-2039 .

疏风解毒胶囊HPLC指纹图谱研究
曹勇3,
郭倩1
,
田成旺2,
张铁军2

,
任涛2,
李翔宇3,
成娅婷4
1. 天津医科大学, 天津 300070
;
2. 天津药物研究院, 天津 300193
;
3. 安徽济人药业有限公司, 安徽亳州 236800
;
4. 天津大学, 天津 300072
收稿日期: 2016-02-18
作者简介: 郭倩(1991—), 女, 甘肃庆阳人, 硕士研究生, 主要从事中药质量控制研究。Tel:(022)23006845E-mail:
grq1413@163.com
摘要:
目的
建立疏风解毒胶囊(SJC)HPLC指纹图谱分析方法, 为全面有效控制其质量提供依据
方法
采用HPLC法建立SJC指纹图谱, 色谱条件:Unitary C18色谱柱(250 mm×4.6 mm, 5μm), 以乙腈-0.1%甲酸水溶液为流动相, 梯度洗脱, 体积流量1.0 mL/min, 柱温30℃, 检测波长250 nm, 进样量10μL; 对所建指纹图谱进行相似度分析及主成分分析(PCA), 并对共有峰进行药材归属及成分指认。
结果
建立了SJC HPLC指纹图谱共有模式, 确定了22个共有峰; 14批SJC相似度在0.915~0.977, PCA表明前3个主成分代表了原始HPLC指纹图谱的主要信息; 在指纹图谱所标定的22个共有峰中, 8、12、13、14、15、16、21、22号峰来自虎杖, 1、2、3、7、9、10号峰来自连翘, 5、6、11号峰来自马鞭草, 4号峰来自败酱草, 18、19号峰来自甘草, 17、20号峰未能归属到具体药材; 通过质谱数据比对, 共指认出16个共有峰, 分别为1号峰(连翘酯苷E)、5号峰(戟叶马鞭草苷)、6号峰(马鞭草苷)、7号峰(5'-羟基连翘酯苷A)、8号峰(虎杖苷)、9号峰(连翘苷)、10号峰(连翘酯苷A)、11号峰(毛蕊花糖苷)、12号峰(异连翘酯苷A)、13号峰(芦荟大黄素)、14号峰(大黄素-8-O-葡萄糖苷)、15号峰(大黄酸)、18号峰(甘草酸单铵盐)、19号峰(3-羟基光甘草酚)、21号峰(大黄素)、22号峰(大黄酚)。
结论
首次建立了SJC HPLC指纹图谱分析方法, 该法操作简单、准确, 精密度、重复性好, 可较全面地反映SJC中化学成分的信息, 为SJC质量控制提供了可靠的科学依据。
关键词:
疏风解毒胶囊
HPLC
指纹图谱
质量控制
药材归属
成分指认
主成分分析
虎杖
连翘
马鞭草
败酱草
甘草
连翘酯苷E
戟叶马鞭草苷
马鞭草苷
5'-羟基连翘酯苷A
虎杖苷
连翘苷
连翘酯苷A
毛蕊花糖苷
异连翘酯苷A
芦荟大黄素
大黄素-8-O-葡萄糖苷
大黄酸
甘草酸单铵盐
3-羟基光甘草酚
大黄素
大黄酚
HPLC fingerprint of Shufeng Jiedu Capsule
CAO Yong3,
GUO Qian1
,
TIAN Cheng-wang2,
ZHANG Tie-jun2

,
REN Tao2,
LI Xiang-yu3,
CHENG Ya-ting4
1. TianjinMedicalUniversity, Tianjin 300070, China
;
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
;
3. Anhui Jiren Pharmaceutical Co., Ltd., Bozhou 236800, China
;
4. TianjinUniversity, Tianjin 300072, China
Abstract:
Objective
To establish an HPLC method for the fingerprint analysis of ShufengJiedu Capsule (SJC), so as to provide evidence for the quality control of it.
Methods
HPLC method was applied with the chromatographic condition as follows: The chromatographic column was Unitary C18 column (200 mm × 4.6 mm, 5μm), acetonitrile-0.1% formic acid as the mobile phase with gradient elution, the flow rate was 1.0 mL/min, the detection wavelength was 250 nm, the column temperature was 30℃, and the injection volume was 10μL. The HPLC fingerprint of SJC was analyzed with similarity analysis and principal component analysis (PCA) method.
Results
The fingerprint chromatography included 22 mutual peaks, of which eight mutual peaks fromPolygonumcuspidatum, six mutual peaks from Forsythia suspensa, three mutual peaks from Verbena officinalis, two mutual peaks from Glycyrrhizauralensis, and one mutual peak fromThlaspiarvense. The similarity among 14 batches was more than0.9. Based on the HPLC-MS2 data, 16 components were identified, which were forsythosid E, hastatoside, verbenalin, 5'-hydroxy-forsythiasideA, polydatin, phillyrin, forsythosid A, acteoside, iso-forsythosid A, aloe-emodin, emodin-8-O-grapeglycosides, parieticacid, monoammoniumglycyrrhizinate, 3-hydroxyglabrol, emodin, and chrysophanol.
Conclusion
It is the first time to establish the HPLC fingerprint of SJC. The method is simple, accurate, and reproducible, which could reflect the chemical composition information of SJC comprehensively and provide scientific evidence for the quality control.
Key words:
Shufeng Jiedu Capluse
HPLC
fingerprint
quality control
medicinal attribute
component identification
principal component analysis
Polygonum cuspidatumSieb. etZucc.
Forsythia suspensa(Thunb.) Vahl
Verbena officinalis L.
Thlaspiarvense Linn.
Glycyrrhiza uralensis Fisch.
forsythosid E
hastatoside
verbenalin
5'-hydroxy-forsythiasideA
polydatin
phillyrin
forsythosid A
acteoside
iso-forsythosid A
aloe-emodin
emodin-8-O-grapeglycosides
parietic acid
monoammonium glycyrrhizinate
3-hydroxyglabrol
emodin
chrysophanol
疏风解毒胶囊(SJC)是由虎杖、连翘、板蓝根、马鞭草、败酱草、柴胡、芦根、甘草8味药材组成的中药复方制剂,用于急性上呼吸道感染属风热证,症见发热、恶心、咽痛、头痛、鼻塞、流浊涕、咳嗽等。体内外实验研究表明,SJC具有抗流感病毒[1]、肠道病毒[2]及其他呼吸道病毒[3]的作用,还具有保护急性肝损伤[4]及病毒性心肌炎[5]的作用,并具有抗菌、抗炎作用[6],该药经多年临床实践与应用,疗效确切[7-10]。
SJC药味多、化学成分复杂,方中多种成分已有明确的药理活性,而现有的质量标准仅制定了采用薄层扫描法测定虎杖中大黄素的量[11],难以有效地控制药品的内在质量。本课题组前期已建立了HPLC法同时测定SJC中7种活性成分的方法[12],本研究将利用HPLC法进行SJC指纹图谱研究,为SJC质量控制提供参考和依据。
1 仪器与材料 Agilent1100-高效液相色谱仪,美国安捷伦公司,配置自动进样器、柱温箱、UV检测器、Agilent 1100色谱工作站;Sartovius BT25S型电子天平(十万分之一),赛多利斯科学仪器(北京)有限公司;色谱柱为Unitary C18柱(250 mm×4.6 mm,5μm),浙江华谱新创科技有限公司;Mettler Toledo AB204-N型电子天平(万分之一),梅特勒-托利多仪器(上海)有限公司;AS3120超声仪,美国Autoscience公司。
14批SJC,由安徽济人药业有限公司提供,批号分别为140301、140203、140204、140105、140206、140207、140208、140209、140210、140211、140212、140213、140214、140215,分别编号为S1~S14。乙腈(色谱纯)、乙醇(分析纯),天津市康科德科技有限公司;甲酸,分析纯,天津市光复科技发展有限公司;去离子水。
2 方法与结果
2.1 色谱条件 Unitary C18色谱柱(200 mm×4.6 mm,5μm);流动相为乙睛-0.1%甲酸水溶液,梯度洗脱:0~65 min,10%~30%乙腈;65~105 min,30%~80%乙腈;105~107 min,80%~10%乙腈;107~120 min,10%乙腈;体积流量1.0 mL/min;检测波长250 nm;柱温30℃;进样量10μL。
2.2 供试品溶液的制备 取SJC内容物1.0 g,精密称定,置于100 mL圆底烧瓶中,加入50 mL 70%乙醇水溶液,称定质量,回流提取2 h,冷却后称定质量,用70%乙醇溶液补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
2.3 精密度试验 精密吸取同一供试品溶液(S8),连续进样6次,按“2.1”项下方法测定。结果各共有峰的相对保留时间和相对峰面积的RSD分别为0.01%~0.39%、0.85%~2.64%,表明本方法精密度良好。
2.4 重复性试验 取SJC样品(S8)6份,按“2.2”项下方法制备供试品溶液,按“2.1”项下方法进样测定。结果各共有峰的相对保留时间和相对峰面积的RSD分别为0.06%~0.29%和1.33%~2.82%,表明本方法重复性良好。
2.5 稳定性试验 取同一供试品溶液(S8),室温放置,分别于0、4、8、12、24 h,按“2.1”项下方法进样测定。结果各共有峰的相对保留时间和相对峰面积的RSD分别为0.17%~0.97%和0.25%~2.47%,表明供试品溶液在24 h内稳定。
2.6 SJC指纹图谱的建立及相关技术参数分析
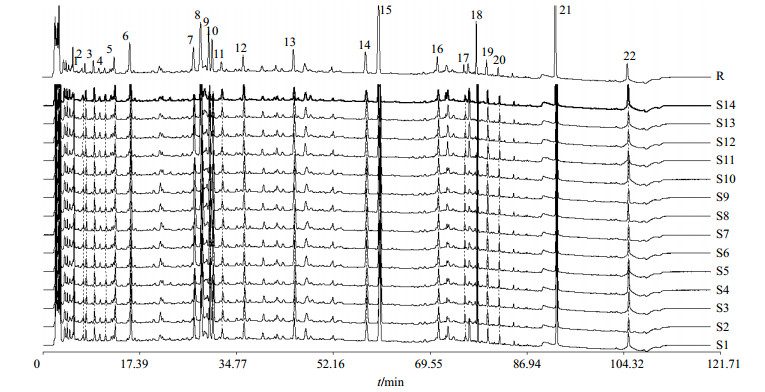
2.6.1 指纹图谱的建立及相似度分析 根据14批SJC检测所得图谱,标定22个共有峰,采用国家药典颁布的“中药色谱指纹图谱相似度评价系统”2012年版进行分析,以中位数法建立对照指纹图谱,见图 1。对14批样品进行相似度计算,结果S1~S14的相似度分别为0.920、0.974、0.951、0.960、0.972、0.974、0.952、0.977、0.974、0.960、0.915、0.919、0.920、0.962。结果表明不同批次的SJC之间相似性良好,质量稳定。
2.6.2 SJC指纹图谱主成分分析(PCA) 采用SPSS 21.0软件对14批SJC指纹图谱的22个共有峰峰面积做标准化处理,再对其进行运算,主成分个数的提取原则为主成分对应的特征值大于1的前m个主成分。表 1结果表明,前4个主成分的累积贡献率可达92.28%,包含了大部分信息。其中,第1主成分特征值为10.92,贡献率为49.64%;第2主成分特征值为6.66,贡献率为30.26%;第3主成分特征值为1.54,贡献率为6.98%;第4主成分特征值为1.19,贡献率为5.40%。由因子负荷矩阵表(表 2)可以看出,第1主成分主要反映了来自色谱峰1、6~20的信息,第2主成分主要反映了来自色谱峰3~5、21、22的信息,第3主成分主要反映了来自色谱峰2的信息。前3个主成分代表了原始HPLC指纹图谱的主要信息。
表 1(Table 1)
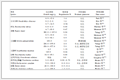
表 1 特征值与贡献率
Table 1 Characteristic value and contribution rate
| 成分 |
特征值 |
贡献率/% |
累积贡献率/% |
| 1 |
10.920 |
49.637 |
49.637 |
| 2 |
6.656 |
30.257 |
79.894 |
| 3 |
1.537 |
6.985 |
86.879 |
| 4 |
1.188 |
5.398 |
92.276 |
| 5 |
0.516 |
2.347 |
94.624 |
| 6 |
0.451 |
2.051 |
96.674 |
| 7 |
0.331 |
1.503 |
98.177 |
| 8 |
0.205 |
0.930 |
99.108 |
| 9 |
0.133 |
0.603 |
99.710 |
| 10 |
0.064 |
0.290 |
100.000 |
| 11 |
4.437×10−16 |
2.017×10−15 |
100.000 |
|
表 1 特征值与贡献率
Table 1 Characteristic value and contribution rate
|
表 2(Table 2)

表 2 因子负荷矩阵
Table 2 Component matrix
| 色谱峰 |
主成分 |
| 1 |
2 |
3 |
4 |
| 1 |
0.704 |
−0.535 |
0.360 |
0.273 |
| 2 |
0.524 |
−0.374 |
0.690 |
0.297 |
| 3 |
0.477 |
0.694 |
−0.305 |
0.092 |
| 4 |
0.286 |
0.861 |
0.088 |
−0.155 |
| 5 |
0.507 |
0.740 |
0.396 |
−0.043 |
| 6 |
0.638 |
0.532 |
0.326 |
−0.366 |
| 7 |
0.692 |
−0.568 |
−0.274 |
−0.312 |
| 8 |
0.916 |
−0.225 |
−0.291 |
0.106 |
| 9 |
0.842 |
−0.482 |
−0.132 |
−0.023 |
| 10 |
0.837 |
−0.481 |
−0.134 |
−0.044 |
| 11 |
0.717 |
0.535 |
−0.217 |
−0.148 |
| 12 |
0.587 |
0.405 |
0.304 |
−0.543 |
| 13 |
0.937 |
−0.283 |
−0.058 |
−0.059 |
| 14 |
0.918 |
−0.217 |
0.061 |
−0.161 |
| 15 |
0.879 |
−0.442 |
−0.066 |
0.063 |
| 16 |
0.886 |
−0.150 |
0.076 |
0.386 |
| 17 |
0.822 |
0.536 |
−0.061 |
0.129 |
| 18 |
0.720 |
0.571 |
0.139 |
0.265 |
| 19 |
0.788 |
0.356 |
−0.150 |
0.097 |
| 20 |
0.625 |
0.484 |
−0.292 |
0.038 |
| 21 |
−0.310 |
0.911 |
0.128 |
0.129 |
| 22 |
−0.118 |
0.860 |
−0.261 |
0.362 |
|
表 2 因子负荷矩阵
Table 2 Component matrix
|
2.6.3 主要色谱峰的药材归属 取虎杖药材、连翘药材、败酱草药材、马鞭草药材、甘草药材粉末(过三号筛)各约1.0 g,精密称定置具塞锥形瓶内,加50%甲醇超声处理30 min,取续滤液,过0.45μm微孔滤膜,即得。
另按照SJC处方及制备工艺依次制备缺虎杖、缺连翘、缺败酱草、缺马鞭草、缺甘草阴性样品,按“2.2”项下方法制得各阴性供试品溶液。
按“2.1”项下色谱条件进样分析,得到如图 2所示各样品色谱峰,通过保留时间和各样品比对分析,指纹图谱中标定的22个共有峰中,8、12、13、14、15、16、21、22号峰来自于虎杖,1、2、3、7、9、10号峰来自于连翘,5、6、11号峰来自于马鞭草,4号峰来自于败酱草,18、19号峰来自于甘草,17、20号峰未能归属到药材。
2.6.4 主要色谱峰的成分指认 利用HPLC-MSn方法对SJC指纹图谱中各色谱峰进行检测,在对相关质谱数据进行数据分析和参照相关文献[13]的基础上,对其中的16个主要色谱峰进行了结构鉴定和成分指认,相关实验数据及结果见表 3。
表 3(Table 3)

表 3 SJC指纹图谱主要色谱峰的指认结果[10]
Table 3 Identification results of main peaks in SJC fingerprint
| 峰号 |
tR/min |
质谱数据 |
分子式 |
相对分子质量 |
鉴定结果 |
| 1 |
7.281 |
463 [M+H]+ |
C20H30O12 |
462.451 0 |
连翘酯苷E |
| 5 |
13.040 |
243 [M+H-Glu]+ |
C17H24O11 |
404.371 0 |
戟叶马鞭草苷 |
| 6 |
15.848 |
227 [M+H-Glu]+, 195 [M+H-Glu-CH4O]+ |
C17H24O10 |
388.371 6 |
马鞭草苷 |
| 7 |
27.324 |
641 [M+H]+ |
C29H36O16 |
640.196 2 |
羟基化连翘酯苷A |
| 8 |
28.659 |
391 [M+H]+ |
C20H22O8 |
390.383 9 |
虎杖苷 |
| 9 |
30.060 |
557 [M+Na]+, 355 [M+H-Glu]+ |
C27H34O11 |
534.560 4 |
连翘苷 |
| 10 |
30.648 |
643 [M+H2O+H] + |
C29H36O15 |
624.595 8 |
连翘酯苷A |
| 11 |
32.343 |
643 [M+H2O+H] + |
C29H36O15 |
624.595 8 |
毛蕊花糖苷 |
| 12 |
36.230 |
643 [M+H2O+H] +, 625 [M+H]+ |
C29H36O15 |
624.595 8 |
异连翘酯苷A |
| 13 |
45.268 |
271 [M+H]+ |
C15H10O5 |
270.236 9 |
芦荟大黄素 |
| 14 |
58.174 |
433 [M+H]+ |
C21H20O20 |
432.110 4 |
大黄素-8-O-葡萄糖苷 |
| 15 |
60.562 |
285 [M+H]+ |
C15H8O6 |
284.220 4 |
大黄酸 |
| 18 |
78.012 |
841 [M+H]+ |
C42H65NO16 |
839.962 6 |
甘草酸单铵盐 |
| 19 |
79.813 |
409 [M+H]+ |
C25H28O5 |
408.494 3 |
3-羟基光甘草酚 |
| 21 |
92.305 |
271 [M+H]+, 243 [M+H-CO]+ |
C15H10O5 |
270.241 4 |
大黄素 |
| 22 |
105.207 |
255 [M+H]+ |
C15H10O4 |
254.230 4 |
大黄酚 |
|
表 3 SJC指纹图谱主要色谱峰的指认结果[10]
Table 3 Identification results of main peaks in SJC fingerprint
|
HPLC-MSn分析条件:Thermo Fishier LCQ Advantage Max离子阱液质联用仪。Nitary C18柱(250 mm×4.6 mm,5μm);流动相为乙睛-0.1%甲酸水溶液;检测波长250 nm;体积流量1 mL/min;柱温30℃;进样体积5μL。流动相梯度为0~65 min,10%~30%乙腈;65~105 min,30%~80%乙腈;105~107 min,80%~10%乙腈;107~120 min,10%~10%乙腈。离子化模式为ESI;离子检测模式为全扫描;分析模式为正离子模式;采集范围为m/z:100~1 000;毛细管温度为250℃;喷雾电压为4.5 kV;毛细管电压为25 V;鞘气体积流量为3.5 L/min;辅助气体积流量为2.0 L/min。
3 讨论 本实验考察对比了不同的流动相系统,包括甲醇-水、乙腈-水、甲醇-0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液,结果表明,以乙腈-0.1%甲酸水溶液体系为流动相,采用梯度洗脱方法,能够达到较好的洗脱效果,各色谱峰的峰形和分离度较好,故选用乙腈-0.1%甲酸水溶液作为流动相系统。
利用DAD检测器对供试品溶液在200~400 nm进行全波长扫描,并分析比较在230、250、330 nm波长下HPLC色谱图,结果显示在250 nm波长下色谱峰信息较多,基线平稳,因此选择250 nm为检测波长。
本实验通过对比分析供试品溶液HPLC色谱图优选了供试品溶液制备方法,分别对提取方式、提取溶剂、提取时间、提取次数进行逐个考察,结果表明,采用70%乙醇回流提取2 h时,供试品色谱图中色谱峰数量较多,提取收率较高,故选择此法作为供试品溶液制备方法。
本实验建立了SJC的HPLC指纹图谱,共标定了22个共有峰,计算了14批SJC的相似度均大于0.9,表明不同批次SJC在化学成分组成上差异较小,质量稳定。同时采用HPLC-MS2方法对其中主要色谱峰进行了药材归属和成分指认。
本实验所建立的方法操作简单、稳定性好、结果可靠,能够全面反映SJC中多种成分的有无及成分间的比例,将建立的SJC特征图谱用于其生产过程,可为该产品提供更全面可靠的控制手段。
参考文献
| [1] |
刘颖, 时瀚, 金亚宏, 等. 疏风解毒胶囊防治流感体内药效学研究[J]. 世界中西医结合杂志, 2010,5 (2)
:107–110.
|
| [2] |
郭姗姗, 金亚宏, 王意忠, 等. 疏风解毒颗粒防治手足口病的体内外药效学研究[J]. 中国实验方剂学杂志, 2012,18 (2)
:206–209.
|
| [3] |
吕伟伟, 朱童娜, 邱欢, 等. 疏风解毒胶囊抗病毒及抗菌的体外药效学实验研究[J]. 中药新药与临床药理, 2013,24 (3)
:234–238.
|
| [4] |
薛明明, 高静琰, 陈东旭, 等. 疏风解毒胶囊对D-氨基半乳糖/脂多糖诱导大鼠急性肝损伤保护作用[J]. 中草药, 2015,46 (9)
:1348–1353.
|
| [5] |
张亚平, 陶振刚, 宋振举, 等. 疏风解毒胶囊对小鼠病毒性心肌炎模型的影响[J]. 中草药, 2016,47 (1)
:110–113.
|
| [6] |
陶振钢, 高静炎, 薛明明, 等. 疏风解毒胶囊对于内毒素诱导大鼠急性肺损伤模型中MARK/NF-κB通路的抑制作用[J]. 中华中医药杂志, 2014,29 (3)
:911–915.
|
| [7] |
奚肇庆, 周建中, 梅建强, 等. 疏风解毒胶囊治疗病毒性上呼吸道感染发热患者130例临床观察[J]. 中医杂志, 2010,51 (5)
:426–427.
|
| [8] |
叶祥庆, 曾德志, 罗世芳, 等. 疏风解毒胶囊治疗感冒风热证临床观察[J]. 安徽医药, 2013,17 (4)
:664–666.
|
| [9] |
胡蓉, 王丽华, 张珺珺, 等. 疏风解毒胶囊治疗急性咽炎风热证的临床观察[J]. 药物评价研究, 2014,37 (5)
:460–462.
|
| [10] |
李文. 疏风解毒胶囊治疗小儿急性上呼吸道感染的疗效观察[J]. 现代药物与临床, 2015,30 (9)
:1140–1143.
|
| [11] |
中国食品药品监督管理局标准[S]. YB200652009. 2006.
|
| [12] |
郭倩, 田成旺, 朱月信, 等. HPLC法同时测定疏风解毒胶囊中7种活性成分[J]. 中草药, 2015,46 (8)
:1174–1177.
|
| [13] |
吴寿金, 赵泰, 秦永祺.
现代中草药处方化学[M]. 北京: 中国中医药出版社, 2002 .
|

 2016, Vol. 47
2016, Vol. 47


