2. 沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016
2. Key Laboratory of Structure-Based Drug Design & Discovery, Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China
玉蕊醇型三萜类成分基本结构为多羟基取代齐墩果烷型三萜,羟基取代多存在于母核结构的C-15、C-16、C-21、C-22和C-28位。本课题组在对含有大量玉蕊醇型三萜的无患子科(Sapindaceae)文冠果属Xanthoceras Bunge植物文冠果Xanthoceras sorbifolia Bunge进行深入系统研究时发现,从文冠果中分得的玉蕊醇型三萜具有显著的抗肿瘤及改善学习记忆等作用[1-5]。由于玉蕊醇型三萜有很好的改善脑功能作用,且其化学结构研究中有关波谱数据和立体化学研究较为充分,因此,综合文献,本文对玉蕊醇型三萜的结构特征、波谱规律及药理活性等方面进行总结,为今后深入进行构效关系、结构修饰等研究及开发提供科学依据。
1 玉蕊醇型三萜的结构特征及其类型从文冠果中分得的玉蕊醇型三萜主要为玉蕊醇R1(barrigenol R1)、玉蕊醇C(barringtogenol C)和16-去氧玉蕊醇C(16-deoxybarringtogenol C)。前人在对玉蕊醇C的研究中,采用了不同的命名,如theasapogenol B、aescinidin、jegosapogenol[1]等,迄今为止,已报道的天然存在的该类型成分约200种,为了便于总结和归纳这一类型成分的结构特征和波谱规律,本文将从植物界中分离得到的5种类型,即玉蕊醇R1(barrigenol R1)、玉蕊醇A1(barrigenol A1)、玉蕊醇A2(barrigenol A2或camelliagenin A)、玉蕊醇C(barringtogenol C)以及16-去氧玉蕊醇C(16-deoxybarringtogenol C)均归于玉蕊醇型三萜。
玉蕊醇型三萜基本母核为多羟基取代的齐墩果烷型三萜。除C-3位羟基取代外,其余羟基取代多数发生在D环和E环上,通常为3~5个羟基取代。取代位置变化在C-15、C-16、C-21、C-22、C-28位上。正是由于这些多羟基取代数量和位置的差异将其结构分为5种类型(图 1),其中以玉蕊醇R1和玉蕊醇C为母核的三萜类化合物最多。
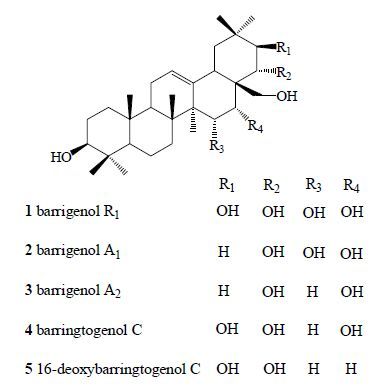
|
图 1 玉蕊醇型三萜结构 Fig.1 Structures of barrigenol type triterpenoids |
2 玉蕊醇型三萜的红外光谱、质谱和核磁共振波谱特征 2.1 红外光谱
玉蕊醇型三萜由于存在多羟基,因此在3 300~3 400 cm-1处出现强的吸收峰。该类化合物中多存在酰基取代,当有乙酰基取代时,其羰基在1 700~1 720 cm-1存在吸收峰,当有共轭双键的酰基取代时,如当归酰基或惕恪酰基,由于羰基与双键形成共轭,使羰基的双键性减弱,伸缩振动频率降低,吸收峰向低频方向移动,在1 680~1 700 cm-1处存在强的吸收峰。
2.2 质谱玉蕊醇型三萜皂苷元可发生RDA开裂,断裂成2个碎片离子峰[6],同时,若母核上有酰基取代时,可见酰基碎片的丢失(图 2)。此外,由于玉蕊醇型三萜有多个羟基取代,在质谱中也可见连续的失水峰。
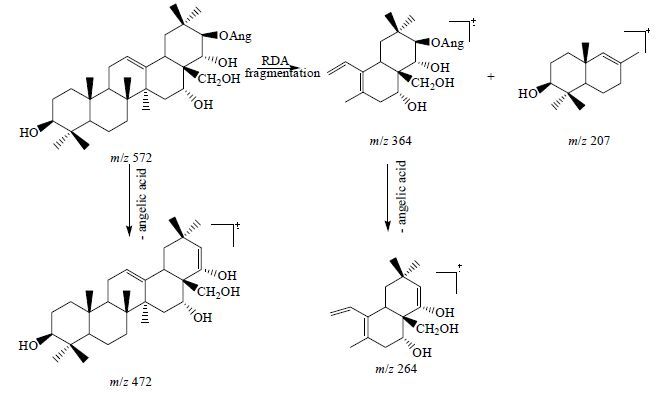
|
图 2 玉蕊醇型三萜苷元质谱裂解图 Fig.2 MS diagram of barrigenol type triterpenoid aglycone |
当在C-21位连有呋糖基,且在呋糖基上连有2个当归酰基时,呋糖首先从母核上断裂,然后可见连续失去2个m/z 100的当归酰基碎片离子峰(图 3)[7]。
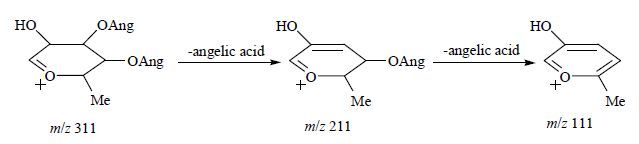
|
图 3 玉蕊醇型三萜所连酰基呋糖质谱裂解图 Fig.3 MS diagram of barrigenol type triterpenoid acyl sugar furosemide |
若母核C-3位发生糖苷化,其糖链很容易断裂,而当母核C-28位有糖基取代时,连接在外侧的糖可以断裂,而连接在母核上的内侧糖则很难断裂。
苷类化合物由于相对分子质量较大,在EI-MS中分子离子峰较弱,常采用FD、FAB来获得 [M+H]+、[M+Na]+、[M+K]+等信号,从而确定化合物的相对分子质量。
2.3 核磁共振波谱 2.3.1 玉蕊醇型三萜母核的NMR特征玉蕊醇型三萜基本母核为多羟基取代的齐墩果烷型三萜,它们的主要区别在于羟基取代的数目和位置。其1H-NMR谱数据见表 1。由于玉蕊醇型三萜基本母核为齐墩果烯型五环三萜,因此在δ 5.40~5.50处有特征的C-12位烯氢质子信号。又由于其在C-28位存在羟基取代,氢谱中可见1组偕次甲基信号,化学位移在δ 3.60~4.20的二重峰,偶合常数在10~11 Hz。同时,由表 1可以看出,玉蕊醇型三萜母核氢谱中存在7个特征的角甲基信号,其化学位移值受羟基取代的影响明显。
|
|
表 1 不同类型玉蕊醇型三萜重要取代位置氢谱数据 (pyridine) Table 1 1H-NMR data for important place of substitution of different types of barrigenol type triterpenoid (pyridine) |
氢谱特征:① C-27位氢信号。玉蕊醇R1和玉蕊醇A1型(C-16位有羟基取代),C-27位氢信号在δ 1.80~1.90,位于较低场;玉蕊醇A2,玉蕊醇C和16-去氧玉蕊醇C型(C-16位无羟基取代),C-27位氢信号显著向高场移动至约δ 1.25处。其原因是由于C-27位甲基信号与C-16位羟基存在1,3双轴作用,使电子云密度降低,化学位移位于较低场,由此可以很容易鉴别16-去氧玉蕊醇C的类型。通过C-29,30位氢信号的变化可以鉴别C-21位羟基的有无。② C-29,30位氢信号。玉蕊醇R1、玉蕊醇C和16-去氧玉蕊醇C型(C-21位有羟基取代),C-29,30位氢信号均在δ 1.20~1.40,位于较低场;玉蕊醇A1和玉蕊醇A2型(C-21位无羟基取代时),C-29,30位氢信号显著向高场移动至δ 1.00~1.20。
玉蕊醇型三萜的碳谱对归属羟基取代位置及酰基种类可提供重要信息,见表 2。由碳谱数据可以看出,玉蕊醇型三萜A、B、C环的碳谱数据基本一致,其差别主要表现在D、E环羟基取代数目和位置不同而致碳谱数据的差异。E环连氧碳的化学位移均较D环低。由此可以判断羟基取代的大概位置:① 玉蕊醇R1、玉蕊醇C和16-去氧玉蕊醇C型(C-21,22同时发生羟基取代),连氧碳的化学位移在δ 77.0~79.0,位于较低场;② 玉蕊醇A1和玉蕊醇A2型(单独C-22位发生羟基取代),连氧碳的化学位移在δ 72.0~74.0;③ 玉蕊醇R1和玉蕊醇A1型(C-15,16位同时发生羟基取代),连氧碳的化学位移在δ 67.0~74.0;④玉蕊醇A2和玉蕊醇C(单独C-16位发生羟基取代),连氧碳的化学位移在δ 67.0~68.0。
|
|
表 2 不同类型玉蕊醇型三萜重要取代位置碳谱数据 (pyridine) Table 2 1C-NMR data for important place of substitution of different types of barrigenol type triterpenoid (pyridine) |
2.3.2 酰基取代基对周围碳化学位移的影响
玉蕊醇型三萜结构中的羟基通常会发生酰化。酰基取代主要分为以下几种:当归酰基(angeloyl,Ang)、惕恪酰基(tigloyl,Tig)、乙酰基(acetyl,Ac)、2-methylbutyroyl(MB)、2-methylpropanyl(MP)、(2Z)-3,7-dimethyl-2,6-octadienoyl(MT1)、(2E)-3,7- dimethyl-2,6-octadienoyl(MT2)、cinnamoyl(CIN)、benzoyl(Bz)、hexenoyl(HEX)、isovaleroyl(i-Val)。酰基取代种类见图 4。
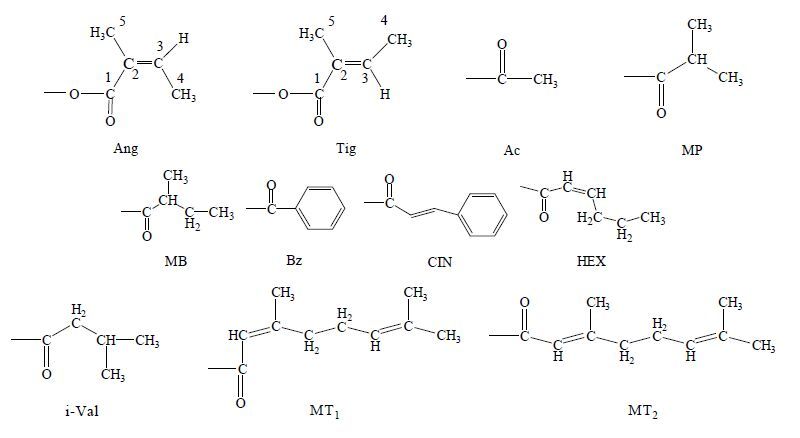
|
图 4 玉蕊醇型三萜酰基取代种类 Fig.4 Acyl substitution type of barrigenol type triterpenoid |
在酰基取代中,以Ang、Tig和Ac取代居多。Ang与Tig为一对顺反异构体,其在氢谱上的区别主要在C-3位氢的化学位移,Ang为δ 5.90,Tig C-3位为δ 7.00,较Ang低场,主要原因为Tig C-3位氢信号恰好处于羰基的去屏蔽区,因此电子云密度小,位于较低场。二者的波谱数据[12]比较见表 3。
|
|
表 3 Ang和Tig波谱数据 Table 3 1H-NMR and 1C-NMR data of Ang and Tig |
酰化位移通常是使直接连接于酰基的碳向低场位移,邻位碳向高场位移。但由于玉蕊醇型三萜为多羟基化合物,存在多个酰基取代,因此其对自身或周围碳的化学位移变化是受综合因素的影响。酰化主要发生在C-21,22位,C-16,28位次之。母核上酰化对周围碳化学位移的影响见表 4,结构见图 5。
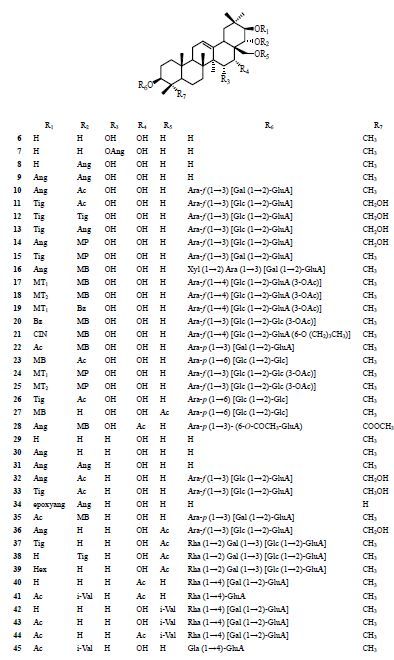
|
图 5 化合物6~45 的结构 Fig.5 Structures of compounds 6—45 |
|
|
表 4 酰基取代对周围碳化学位移的影响 Table 4 Effects of acyl substitution on chemical shift of around carbon |
由表 4可见,化合物6~28为玉蕊醇R1型三萜,发生酰基取代后的化合物与母核玉蕊醇R1进行比较发现,无论在哪个位置上发生酰化,对C-15位均没有影响;此外,除单独C-22位发生酰化对本身没有影响外,其他酰化方式均使C-22,28位化学位移显著向高场移动。
化合物29~45为玉蕊醇C型三萜,发生酰基取代后的化合物与母核玉蕊醇C进行比较。由以上数据可以看出,除C-16位发生酰化使C-15位向高场位移外,其他位置酰化均对C-15位没有影响。此外,C-28位酰化对自身碳化学位移影响很小。
由于在玉蕊醇型三萜中,以玉蕊醇R1和玉蕊醇C型三萜居多,而其他类型较少,因此本文主要对这2种类型三萜的酰化位移进行详细描述。
2.3.3 糖取代对周围碳的影响玉蕊醇型三萜通常在C-3,21,28,24位存在糖取代,其中以C-3,21位存在糖取代的情况最为多见。C-3位所连糖的种类为葡萄糖醛酸、葡萄糖、阿拉伯糖等,而C-21所连糖的种类主要为夫糖,仅李占林从文冠果果壳中分离出1个C-21位连有鼠李糖的玉蕊醇型三萜。
(1) C-21位糖基取代:迄今为止,仅从无患子科文冠果属植物中分离得到在C-21位存在呋糖基取代的玉蕊醇型三萜,为文冠果中特有的化合物。糖苷化通常使所连位置显著向低场位移δ 9.0,而使相邻碳C-22位略向高场位移。但通常从文冠果中分得的连有C-21呋糖的三萜皂苷多同时有酰基取代,因此其化学位移变化是多种因素作用的结果(表 5),结构见图 6。
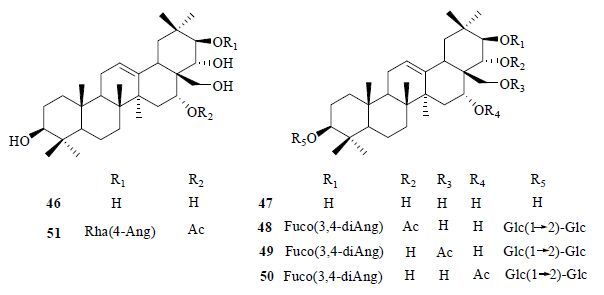
|
图 6 化合物46~51 的结构 Fig.6 Structures of compounds 46—51 |
|
|
表 5 C-21 位糖取代对周围碳化学位移的影响 Table 5 Effects of C-21 polysaccharide substitution on chemical shift of around carbon |
(2) C-3位糖基取代:玉蕊醇型三萜皂苷C-3位所连糖的种类为葡萄糖醛酸、葡萄糖、阿拉伯糖、半乳糖、木糖、鼠李糖。其中阿拉伯糖均为呋喃型,木糖和鼠李糖为吡喃型。C-3位所连内侧糖仅有葡萄糖醛酸和葡萄糖2种,且以葡萄糖醛酸为内侧糖居多。迄今为止,仅从Hydrocotyle ranunculoides L. f.[21]、欧洲七叶树[30]、黑鳗藤[25]、文冠果植物中分得到C-3位内侧葡萄糖取代的化合物。糖链连接方式以C-1、2连接最多。当C-3位发生糖苷化后,使C-3位向低场位移约δ 10.0,对周围碳影响不大。
(3) C-28位糖基取代:迄今为止,C-28位有糖基取代的玉蕊醇型三萜皂苷很少。C-28位所连糖的种类仅有木糖、葡萄糖、鼠李糖、来苏糖4种。综合文献,尚未分得玉蕊醇型C-28位连有糖基取代的化合物。文献仅从鹅不食草[31]、澳大利亚古苏格兰树[23]、金刀木[32]中分得C-28位连有糖基取代玉蕊醇C型化合物。笔者从文冠果果柄中分得4个16-去氧玉蕊醇C型三萜。分析其C-28位糖取代化合物较少的原因可能是D、E环为多羟基取代,存在较大的空间位阻,因此C-28位很难发生取代。
当C-28位发生糖苷化后,使C-28位向低场位移约δ 6.0,C-22位向高场位移约δ 2.0,而C-17位变化不大。由于空间位阻的影响,束缚了电子运动,使C-22位电子云密度升高,向高场位移,而C-17位季碳受苷化影响较小。
3 立体化学研究近年来,随着二维核磁共振波谱及X-单晶衍射的广泛应用,使得立体结构的确证越来越方便、准确。但在某些情况下,化合物的晶形很难达到要求,有时在二维NOESY谱中,NOE相关也不是很清楚,因此通过一些化学方法来确证化合物的绝对构型仍很有必要。对于玉蕊醇型三萜化合物,其立体构型的研究主要集中在C-15,16,21,22位羟基的取代模式上。Itiro等[33]对玉蕊醇C C-21,22位的立体构型进行了化学方法的确证。在1H-NMR谱中,玉蕊醇C C-21,22的偶合常数为10.0 Hz左右,证明C-21,22位羟基构型为反式。通过对玉蕊醇C的衍生物玉蕊醇D进行1H-NMR测试,发现C-21,22位氢之间的偶合常数几乎为0,峰型为单峰。由此可以确证,玉蕊醇C中C-21,22位羟基构型为21β,22α(图 7)。
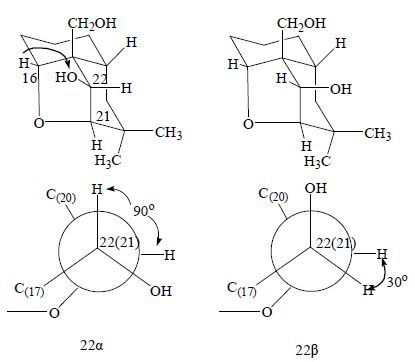
|
图 7 C-21, 22 位羟基构型的判定 Fig.7 Determination of hydroxy configuration of C-21 and C-22 |
有学者对玉蕊醇A1的C-15,16位羟基构型通过化学实验方法进行确证[34],发现C-15,16位丙叉化反应很容易且迅速,而且在乙酰化反应产物C中C-15,16位氢之间的偶合常数为4.0 Hz,由此可以得出C-15,16位羟基构型为顺式。将反应产物B和C的氢谱数据进行比较发现,B中C-27位甲基氢信号明显较C在低场,由此确证16位羟基构型为α型。最终确定C-15,16位羟基的构型为15α (eq),16α (ax)(图 8)。
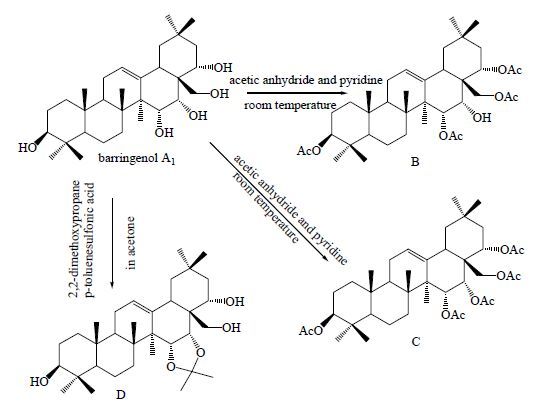
|
图 8 C-15, 16 位羟基构型的判定 Fig.8 Determination of hydroxy configuration of C-15 and C-16 |
此外,对于易结晶且晶形较好的玉蕊醇型三萜可以通过X-单晶衍射来确定化合物的绝对构型。Chen等[35]曾对napoleogenin B进行X-单晶衍射测试,确定了该化合物的绝对构型。
4 药理活性研究 4.1 抗肿瘤作用Xiao等[2]从文冠果叶中分别得到2个以玉蕊醇R1及以16-去氧玉蕊醇C为母核的化合物玉蕊醇型三萜皂苷,其对人宫颈癌细胞(HeLa)、人乳腺癌细胞(MCF-7)及人肝癌细胞(HepG2)表现出明显的抑制活性,IC50在3.98~9.62 μg/mL。与此同时,Yu等[3]通过体外活性筛选体系,选用HeLa、胃癌细胞株(BGC-823)、MCF-7、人乳腺癌细胞株(MDA-231)、人前列腺癌细胞株(PC-3)、HepG2及纤维肉瘤细胞株(HT1080),考察了文冠果种子油提取物的体外抗肿瘤活性,实验发现以玉蕊醇C为母核的三萜类化合物具有较好的抗肿瘤活性,其中bunkankasaponin F和bunkankasaponins B的IC50为1.75~4.97 μmol/L,bunkankasaponins A、C、D显示中等强度的活性;同时还探究了其抗肿瘤活性的可能构效关系,发现结构中C-3和C-21位发生糖苷化,具有较强的体外抗肿瘤活性,当C-22、28位分别被乙酰基、羟基取代则活性明显降低。此外,在早期玉蕊醇型三萜类化合物抗肿瘤实验中,Li等[24]发现当在C-24发生羟基取代时,可显著提高其抗肿瘤活性,但是C-21位Ang被其他环氧基团替代或在C-15位引入羟基时,其抗肿瘤活性会减弱。Ren等[36]也在探究玉蕊醇型三萜类化合物的抗肿瘤活性实验中发现在C-21或C-22有Ang取代时,对人直肠癌细胞(HT-29)的细胞毒性显著提高。
4.2 改善学习记忆及抗阿尔茨海默病作用Liu等[5]通过侧脑室注射链脲霉素(STZ)致具有阿尔茨海默病(AD)行为及病理特征的大鼠记忆缺陷模型的实验发现,以玉蕊醇R1为母核的文冠果壳苷可明显提高记忆缺陷大鼠的新事物辨别能力,降低tau蛋白在Thr-231、Ser-396及Ser-404与AD发病机制相关位点的磷酸化水平。纪雪飞[37]在一次性侧脑室注射β-淀粉样蛋白1-42(Aβ1-42)制备小鼠痴呆模型实验中,考察了文冠果壳苷对模型小鼠学习记忆障碍的影响,结果发现文冠果壳苷对AD模型小鼠的空间记忆、工作记忆及长期记忆障碍均有显著改善作用,并且能够改善线粒体功能,减少活性氧(ROS)的产生及线粒体细胞色素C的释放。同时,Jin等[38]研究发现文冠果壳苷可显著减轻Aβ在APP转基因AD模型小鼠脑内海马区的沉积及tau蛋白的磷酸化作用,从而提高AD小鼠的学习记忆作用。
4.3 抑菌作用Oh等[39]通过平板扩散药敏实验对558种韩国道地药材粗提物进行体外抑制牙周致病菌的筛选,发现海桐花提取物中以玉蕊醇型三萜为母核的化合物玉蕊醇R1是其发挥抑菌作用的主要活性成分,实验还考察了不同浓度的玉蕊醇R1对牙龈卟啉单胞菌、中间善氏菌及具核梭杆菌的抑菌活性,结果发现玉蕊醇R1对3种菌株均表现出较好的抑菌特性,最小抑菌质量浓度为100 μg/mL。Zhang等[40]采用液质联用手段鉴定茶籽油废渣的甲醇提取物中以玉蕊醇型三萜类为主的化合物,并采用钻孔板扩散法考察了玉蕊醇型三萜总皂苷的抑菌活性,结果表明,其总皂苷对金黄色葡萄球菌、大肠埃希杆菌等细菌表现出明显的抑菌活性,而对真菌玉米小斑病菌则表现出显著的抑制活性,最小抑菌质量浓度为100 μg/mL,认为玉蕊醇型三萜皂苷是一种良好的生物杀虫剂及抑菌剂。
此外,Ye等[41-42]研究发现以玉蕊醇型三萜为主的皂苷类成分具有抗氧化及抗HIV活性。一些含有玉蕊醇三萜的植物提取物,如山茶花中正丁醇萃取物具有抑制橄榄油所致大鼠血浆三酰甘油升高的作用[43];从车桑子中得到的总皂苷部分具有增强吞噬作用和灭螺活性[44];欧洲七叶树中含有玉蕊醇型三萜化合物的提取物具有抑制乙醇吸收和降血糖作用[30]。另有报道,卡利亚、滨玉蕊中分离出来的玉蕊醇型三萜化合物具有杀虫作用[45-46]。
5 结语玉蕊醇型三萜虽然在多科植物中广泛存在,但仅在无患子科文冠果属植物文冠果及山茶科植物山茶种子中量较高且结构类型较多,其余科属植物中量较少。根据笔者近几年来对文冠果属植物文冠果化学成分的深入研究发现,玉蕊醇型三萜类成分多存在于文冠果果壳、果柄及种子中,且量较高,而文冠果枝条、叶子及花中量极少[2],其原因可能是植物次生代谢产物区域化所致。
此外,尽管玉蕊醇型三萜类成分具有较多的生物活性,但主要集中在抗肿瘤及抗AD方面研究较多,特别是从文冠果中分得的玉蕊醇型三萜经实验证实具有显著的抗肿瘤、改善学习记忆及促进颌下腺内神经生长因子(NGF)介导的神经细胞生长等作用[30, 47]。由于玉蕊醇型三萜结构中存在较多的羟基基团,在植物次生代谢过程中,这些羟基基团可以被不同的酰基或糖取代,给玉蕊醇型三萜类化合物带来更多的生物活性,其在治疗肿瘤及老年退行性疾病如阿尔茨海默病方面具有极大的开发应用前景。因此,在今后的工作中应将对玉蕊醇型三萜类成分的构效关系进行系统深入的探讨及总结,为这类化学成分的开发及应用提供重要的基础。
| [1] | Li W, Li X. Triterpenoid saponins from carpophore of Xanthoceras sorbifolia Bunge.[J]. Chem Nat Compd, 2014, 5 (1) :100–102 . |
| [2] | Xiao W, Wang Y, Zhang P, et al. Bioactive barrigenol type triterpenoids from the leaves of Xanthoceras sorbifolia Bunge.[J]. Eur J Med Chem, 2013, 60 (5) :263–270 . |
| [3] | Yu L L, Tang X L, Chen L X, et al. Oleanane-type triterpenoid saponins from Xanthoceras sorbifolia Bunge.[J]. Fitoterapia, 2012, 83 (8) :1636–1642 . |
| [4] | Yu L L, Wang X B, Wei X C, et al. Triterpenoid saponins from Xanthoceras sorbifolia Bunge and their inhibitory activity on human cancer cell lines[J]. Bioorg Med Chem Lett, 2012, 22 (16) :5232–5238 . |
| [5] | Liu P, Zou L B, Jiao Q, et al. Xanthorceraside attenuates learning and memory deficits via improving insulin signaling in STZ-induced AD rats[J]. Neurosci Lett, 2013, 543 :115–120 . |
| [6] | Takao K, Lee K H. Antitumor agents, 82. Cytotoxic sapogenols from Aesculus hippocastanum[J]. J Nat Prod, 1986, 49 (4) :650–656 . |
| [7] | Chen Y J, Takeda T, Ogihara Y, et al. Studies on the constituents of Xanthoceras sorbifolia Bunge. Ⅲ. Minor prosapogenins from the fruits of Xanthoceras sorbifolia Bunge.[J]. Chem Pharm Bull, 1985, 33 (1) :127–134 . |
| [8] | Greca M D, Fiorentino A, Monaco P, et al. Polyoxygenated oleanane triterpenes from Hydrocotyle ranunculoides[J]. Phytochemistry, 1994, 35 (1) :201–204 . |
| [9] | 陈昌祥, 叶海亚, 申永乐, 等. 红木荷树皮的化学成分[J]. 云南植物研究, 1997,19 (2) :201–206. |
| [10] | Ajit K C, Binayak D, Satyesh C P. Triterpenoid prosaponins from leaves of Maesa chiisia var. angustiflolia[J]. Phytochemistry, 1987, 26 (8) :2345–2349 . |
| [11] | Kong P W, Lewis K G. New chemical constituents of Planchonia careya[J]. Aust J Chem, 1977, 33 :1311–1322 . |
| [12] | Yuan W, Wang P, Su Z S, et al. Triterpenoid saponins from Aesculus sylvatica W. Bartram.[J]. Phytochem Lett, 2015, 14 :111–114 . |
| [13] | 李巍, 李铣, 李占林, 等. 文冠果果柄的化学成分[J]. 沈阳药科大学学报, 2005,22 (5) :345–347. |
| [14] | Aurada E, Jurenitsch J, Kubelka W. Structure of triterpene-sapogenins of Aesculus glabra[J]. Planta Med, 1984, 50 (5) :391–394 . |
| [15] | Zhang Z Z, Li S Y. Cytotoxic triterpenoid saponins from the fruits of Aesculus pavia L.[J]. Phytochemistry, 2007, 68 (15) :2075–2086 . |
| [16] | Yoshikawa M, Morikawa T, Ymamoto K, et al. Floratheasaponins A-C, acylated oleanane-type triterpene oligoglycosides with anti-hyperlipidemic activites from flowers of the tea plant (Camellia sinensis)[J]. J Nat Prod, 2005, 68 (9) :1360–1365 . |
| [17] | Fu G M, Wang Y H, Gao S, et al. Five new cytotoxic triterpenoid saponins from the roots of Symplocos chinensis[J]. Planta Med, 2005, 71 (7) :666–672 . |
| [18] | Fu G M, Liu Y, Yu S S, et al. Cytotoxic oxygenated triterpenoid saponins from Symplocos chinensis[J]. J Nat Prod, 2006, 69 (12) :1680–1686 . |
| [19] | Tang M J, Shen D D, Hu Y C, et al. Cytotoxic triterpenoid saponins from Symplocos chinensis[J]. J Nat Prod, 2004, 67 (12) :1969–1974 . |
| [20] | Jan B, Gottfried R, Sabine B, et al. Saponins from Hacquetia epipactis[J]. Phytochemistry, 1995, 39 (1) :195–198 . |
| [21] | Marina D G, Antonio F, Pietro M, et al. Oleanane glycosides from Hydrocotyle ranunculoides[J]. Phytochemistry, 1994, 36 (6) :1479–1483 . |
| [22] | Yi L, Tatsuya U, Akihito Y, et al. Triterpenoid saponins from the roots of tea plant (Camellia sinensis var. assamica)[J]. Phytochemistry, 2000, 53 (8) :941–946 . |
| [23] | Voutquenne L, Kokougan C, Lavaud C, et al. Triterpenoids saponins and acylated prosapogenins from Harpullia austro-caledonica[J]. Phytochemistry, 2002, 59 (8) :825–832 . |
| [24] | Li Z L, Li X, Li L H, et al. Two new triterpenes from the husks of Xanthoceras sorbifolia Bunge.[J]. Planta Med, 2005, 71 (11) :1068–1070 . |
| [25] | Kazuko Y, Hiromichi H, Masami T, et al. Antisweet natural products. XV. Structures of jegosaponins A-D from Styrax japonica Sieb. et Zucc.[J]. Chem Pharm Bull, 2000, 48 (7) :1093–1096 . |
| [26] | Marie-Laure C, Isabelle P, Clement D, et al. Acylated triterpenoid saponins from the stem bark of Foetidia africana[J]. J Nat Prod, 2002, 65 (11) :1560–1567 . |
| [27] | Chen Y J, Takeda T, Ogihara Y, et al. Studies on the constituents of Xanthoceras sorbifolia Bunge. Ⅳ. Structures of the minor prosapongenins[J]. Chem Pharm Bull, 1985, 33 (3) :1043–1048 . |
| [28] | Chen Y J, Takeda T, Ogihara Y, et al. Studies on the constituents of Xanthoceras sorbifolia Bunge V. Major saponins from the fruits of Xanthoceras sorbifolia Bunge[J]. Chem Pharm Bull, 1985, 33 (4) :1387–1394 . |
| [29] | 李占林. 文冠果果壳化学成分及生物活性研究[D]. 沈阳: 沈阳药科大学, 2005. |
| [30] | Mandal D, Panda M, Kumar S, et al. A triterpenoid saponin possessing antileishmanial activity from the leaves of Careya arborea[J]. Phytochemistry, 2006, 67 (2) :183–190 . |
| [31] | Gupta D, Singh J. Phytochemical investigation of Centipeda minima[J]. Indian J Chem Sect B: Org Chem Med Chem, 1990, 29B (1) :34–39 . |
| [32] | Peck W K, Keith G L. New chemical constituents of Planchonia careya[J]. Aust J Chem, 1977, 30 :1311–1322 . |
| [33] | Itiro Y, Akiko M, Kanako I, et al. Saponin and sapogenol. Ⅳ. Seeds sapogenols of Aesculus turbinata Blume. On the configuration of hydroxyl functions in ring E of aescigenin, protoaescigenin, and isoaescigenin, and isoaescigenin in relation to barringtogenol C and theasapogenol A[J]. Chem Pharm Bull, 1971, 19 (6) :1200–1213 . |
| [34] | Sho I, Toshio O, Hiroshi S, et al. Structure of A1-barrigenol and R1-barrigenol[J]. Tetrahedron Lett, 1967, 8 (24) :2289–2294 . |
| [35] | Chen Y J, Takeda T, Ogihara Y, et al. Studies on the constituents of Xanthoceras sorbifolia Bunge Ⅱ. Major sapogenol and a prosapogenin from the fruits of Xanthoceras sorbifolia Bunge.[J]. Chem Pharm Bull, 1984, 32 (9) :3378–3383 . |
| [36] | Ren Y L, Schoiack V A, Chai H B, et al. Cytotoxic barrigenol-like triterpenoids from an extract of Cyrilla racemiflora housed in a repository[J]. J Nat Prod, 2015, 78 :2440–2446 . |
| [37] | 纪雪飞. 文冠果壳苷对β淀粉样蛋白致痴呆小鼠学习记忆障碍的改善作用及线粒体相关机制研究[D]. 沈阳: 沈阳药科大学, 2013. |
| [38] | Jin G, Wang L H, Ji X F, et al. Xanthoceraside rescues learning and memory deficits through attenuating beta-amyloid deposition and tau hyperphosphorylation in APP mice[J]. Neurosic Lett, 2014, 573 (24) :58–63 . |
| [39] | Oh J H, Jeong Y J, Koo H J, et al. Antimicrobial activities against periodontopathic bacteria of pittosporum tobira and its active compound[J]. Molecules, 2014, 19 (3) :3607–3616 . |
| [40] | Zhang X F, Yang S L, Han Y Y, et al. Qualitative and Quantitative analysis of triterpene saponins from tea seed pomace (Camellia oleifera Abel) and their activities against bacteria and fungi[J]. Molecules, 2014, 19 :7568–7580 . |
| [41] | 叶勇, 罗月婷. 没食子酸茶皂草精醇酯及其制备方法与应用: 中国: CN102030810A[P]. 2011-10-27. |
| [42] | 叶勇, 王延芳. 具有抗HIV活性的茶皂苷元衍生物及其制备方法与应用: 中国, CN102030807A[P]. 2011-04-27. |
| [43] | Wagner H, Ludwig C, Grotjahn L, et al. Biologically active saponins from Dodonaea viscosa[J]. Phytochemistry, 1981, 26 (3) :697–701 . |
| [44] | Yoshikawa M, Murakami I, Matsuda H, et al. Bioactive saponins and glycosides. Ⅲ. Horse chestnut. (1): The structures, inhibitory effects on ethanol absorption, and hypoglycemic activity of escins Ⅰa, Ⅰb, Ⅱa, Ⅱb, and Ⅲa from the seeds of Aesculus hippocastanum L.[J]. Chem Pharm Bull, 1996, 44 (8) :1454–1464 . |
| [45] | Herlt A J, Mander L N, Pongoh E, et al. Two major saponins from seeds of Barrintonia asiatica: Putative antifeedants toward Epilachna sp. larvae[J]. J. Nat Prod, 2002, 65 (2) :115–120 . |
| [46] | Cespedes C L, Salazar J R, Martinez M M, et al. Insect growth regulatory effects of some extracts and sterols from Myrtillocactus geometrizans (Cactaceae) against Spodoptera frugiperda and Tenebrio molitor[J]. Phytochemistry, 2005, 66 (20) :2481–2493 . |
| [47] | 李巍. 文冠果果柄化学成分及其生物活性研究[D]. 沈阳: 沈阳药科大学, 2008. |
 2016, Vol. 47
2016, Vol. 47


