基因表达分析是了解植物功能基因的表达规律,解析植物复杂代谢网络并对其进行表达调控的重要手段之一[1]。通过实时荧光定量PCR获得目的基因的相对表达量是目前最为常用的基因表达检测方法。因此,从植物中筛选出在不同器官、不同发育时期表达基本恒定的管家基因作为研究的内参基因是获得准确基因表达分析结果的关键[2]。肌动蛋白(Actin)基因是广泛存在于植物中的管家基因,其编码的肌动蛋白是细胞骨架中微丝的主要组分,参与细胞内许多重要的生理活动,如细胞形状的维持、胞质环流、细胞运动、细胞分裂、细胞分化、细胞内的物质运输、急性建成以及信号转导等,具有高度保守、表达量高且稳定的特点,常被用作基因表达分析的内参基因[3-4]。
太子参为石竹科孩儿参Pseudostellaria heterophylla (Miq.) Pax的干燥块根,具有益气健脾、生津润肺的功效[5]。现代研究表明,太子参多糖具有抗应激、抗疲劳、增强免疫力的功效[6],与药材益气健脾、补气生津的传统功效相似;太子参环肽类成分具有酪氨酸酶抑制活性,有抗黑色素生成作用[7],与现代将太子参作为保健品、化妆品进行研制开发的定位理念相得宜彰。但大量研究显示,各产区栽培太子参的药材质量参差不齐,特别是药材指标性成分太子参环肽类的量差异显著[8-9],其量的比例变化与地区年日照数及降雨量密切相关[10-11]。近年来,从连作障碍、土壤微生物方面改善栽培太子参药材品质[12-13],结合太子参农艺性状、遗传多样性水平筛选优良种源已有研究报道[14],但针对太子参药材品质形成及其产生地理变异的遗传与生态学机制研究却严重滞后,太子参功能基因的研究尚处于起步阶段。鉴于此,本研究通过RT-PCR与抑制PCR技术克隆太子参的Actin基因核心片段,并进行序列分析,检验Actin基因在太子参不同种源、不同器官、不同生长过程中的表达稳定性,为后续研究太子参其他功能基因的表达分析和调控机制提供内参基因。
1 材料与方法 1.1 材料2014年9月26日从贵州施秉牛大场太子参种质资源圃采集不同种源太子参共7份,分别为江苏句容(JJ-1)、江苏句容(JJ-2)、福建柘荣(FZ-1)、福建柘荣(FZ-2)、贵州施秉(GS-1)、贵州施秉(GS-2)、贵州施秉(GS-3);2015年3月7日采集GS-2的花、茎、叶、块根;2015年4月21日采集GS-2单株的第1~4茎节及对应的叶片。太子参所有样品经贵阳中医学院周涛教授鉴定为孩儿参Pseudostellaria heterophylla (Miq.) Pax的干燥块根均经液氮处理后,-80 ℃冰箱中保存,备用。
质粒载体pMD19-T、反转录酶M-MLV、限制性内切酶Dra Ⅰ和Hae Ⅲ、RNAiso Plus试剂盒、DNase Ⅰ、DL 500 DNA Marker及DL 2000 DNA Marker购自宝生物工程(大连)有限公司,琼脂糖凝胶回收试剂盒购自Omega公司,2×Taq PCR MasterMix和大肠杆菌Escherichia coli菌株DH5α购自天根生化科技(北京)有限公司。其余试剂均为分析纯。
1.2 方法 1.2.1 RNA的提取、纯化和cDNA的合成取-80 ℃保存的太子参材料于预冷的研钵中加液氮迅速研磨成粉末状。根据TaKaRa公司RNA抽提试剂盒说明提取总RNA;按照DNase Ⅰ试剂盒说明纯化太子参总RNA,以除去总RNA中残留的微量DNA。用30 μL DEPC水溶解总RNA,取3 μL用1%的琼脂糖凝胶电泳检测,并用核酸定量仪检测总RNA浓度。以总RNA为模板,Oligo d (T)11为引物,利用M-MLV反转录酶合成cDNA第一链,-80 ℃保存,备用。
1.2.2 RT-PCR扩增从NCBI数据库下载植物Actin的核苷酸序列进行同源性比较,找出高度保守区域,根据同源性高和简并性低的原则,设计简并引物Actin-F/Actin-R(表 1),以cDNA为模板进行PCR扩增,25 μL反应体系包含1 μL cDNA、1 μL Actin-F(10 μmol/L)、1 μL Actin-R(10 μmol/L)、12 μL 2×Taq PCR MasterMix [0.1 U/μL Taq Polymerase、500 μmol/L dNTP each、20 mmol/L Tris-HCl(pH值为8.3)、100 mmol/L KCl、3 mmol/L MgCl2]、12 μL ddH2O。PCR扩增程序为94 ℃预变性5 min;94 ℃变性30 s;57 ℃退火30 s;72 ℃延伸1.5 min;40个循环;72 ℃后延伸7 min;PCR产物经1.5%琼脂糖凝胶电泳检测后,切下目的条带,Omega胶回收试剂盒,回收片段重组入pMD19-T载体,转化DH5α感受态细胞,并接种到含60 mg/mL Ampicillin(AMP)的Luria-Bertanil(LB)平板上,37 ℃培养过夜,挑取菌斑以500 μL含60 mg/mL AMP的液态LB培养基培养8 h。取菌液为模板PCR扩增进行克隆检测,选取多个阳性克隆进行测序分析。
|
|
表 1 引物信息 Table 1 Primers used in this study |
1.2.3 基因组DNA的提取及Actin基因侧翼序列扩增
改进CTAB法提取太子参基因组DNA。取1 g幼嫩叶片于干净的研钵中,加入0.04 g PVP和3 mL CTAB提取液(1.4 mol/L NaCl;0.1 mol/L Tris-HCl,pH值为8.0;20 mmol/L EDTA,pH值为8.0)研匀,装入10 mL EP管中;加入60 μL β-巯基乙醇,充分混匀;65 ℃保温45 min;加入1 mL 5 mol/L醋酸钾,冰上放置20 min;加入4 mL氯仿-异戊醇(24∶1)混合液用力混匀,放置10 min;10 000 r/min离心10 min,取上清;加入2/3体积预冷的异丙醇,用力混匀,常温静置10 min;12 000 r/min离心2 min,弃上清;75%乙醇洗涤2次,自然干燥;加入150 μL ddH2O溶解;加入4 μL 10 mg/mL RNase A,37 ℃保温1 h;加入等体积酚-氯仿-异戊醇(25∶24∶1)充分混匀,放置5 min;12 000 r/min离心5 min,取上清;加入1/3体积3 mol/L醋酸钠(pH 5.2)和2.5倍体积的无水乙醇,充分混匀,静置10 min;12 000 r/min离心15 min,弃上清;75%乙醇洗涤2次,自然干燥;用适量ddH2O溶解。取3 μL用于1%的琼脂糖凝胶电泳检测,并用核酸定量仪检测DNA溶度。
分别取10 μg基因组DNA,各加入Dra Ⅰ和Hae Ⅲ 3 μL,37 ℃消化3 h,取适量用1.5%琼脂糖凝胶电泳检测酶切效果,酶切产物用乙醇沉淀法回收,并用适量ddH2O溶解。根据已经报道的接头序列[15]合成Adaptor1和Adaptor2,稀释成50 μmol/L,等体积混匀,沸水浴保温5 min,然后在沸水浴中自然冷却至室温。连接体系包含8 μL基因组酶切产物、4 μL混合接头、10 μL 10×Ligase Buffer、3 μL T4 DNA Ligase,于PCR仪上16 ℃反应3 h,乙醇沉淀法回收连接产物作为扩增模板。根据Adaptor1设计特异引物GSP1、GSP2,获得的3条Actin基因核心片段设计特异引物ap1~ap12(表 1),以GSP1与外侧特异引物形成引物对进行第1轮扩增,将扩增产物稀释2倍,取1 μL作为模板,GSP2与内侧特异引物形成引物对进行第2轮巢式扩增。用琼脂糖凝胶电泳分离扩增产物,切下目的条带,Omega胶回收试剂盒回收,回收片段重组入pMD19-T载体,转化DH5α感受态细胞,筛选出多个阳性克隆进行测序分析。
1.2.4 序列分析运用生物信息学软件分析Actin氨基酸序列中的保守结构域与活性位点,从NCBI数据库下载其他植物Actin基因的氨基酸序列,采用Muscle 3.6软件进行多重比对,并将比对结果通过MEGA 4.0软件采用邻接法(neighbor-joining method,NJ)构建系统发育树。
1.2.5 基因表达分析根据获得的3条Actin基因片段序列比对结果,设计特异引物Actin-1F/Actin-1R、Actin-2F/Actin-2R、Actin-3F/Actin-3R(表 1),以等量总RNA反转录的cDNA为模板进行半定量RT-PCR扩增,通过琼脂糖凝胶电泳检测扩增产物,分析太子参Actin基因在不同种源、不同器官、不同生长发育时期的表达情况。
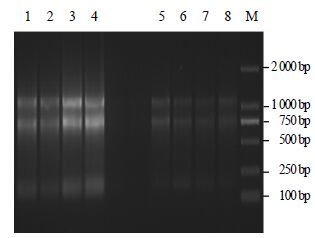
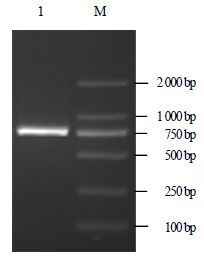
2 结果与分析 2.1 总RNA的提取及Actin基因核心片段的获得按照TaKaRa RNA抽提试剂盒说明书提取的总RNA,28 S、18 S条带清晰,无DNA污染均可用于后续实验(图 1)。以总RNA反转录得到的cDNA为模板,用Actin基因的简并引物Actin-F/Actin-R进行RT-PCR扩增,扩增产物经琼脂糖凝胶电泳检测发现在760 bp处有一条亮带(图 2),且上下无杂带,与推测的目的片段大小一致。将该条带进行切胶、回收、克隆。随机挑取14个阳性克隆测序,经序列比对后发现其中包含了3条不同的Actin基因片段,长度均为760 bp,分别命名为PhACT1、PhACT2、PhACT3。
|
图 1 太子参总RNA 电泳检测 Fig.1 Electrophoresis of total RNA from P. heterophylla |
|
图 2 Actin 基因核心片段电泳图 Fig.2 Electrophoresis of DNA fragments of Actin by PCR |
2.2 基因组DNA及Actin基因侧翼片段的扩增
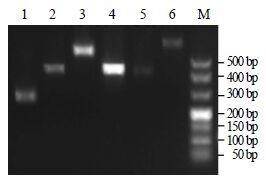
琼脂糖凝胶电泳检测结果显示,改良CTAB法能获得较高质量的基因组DNA,可用于后续实验(图 3)。经Dra Ⅰ和Hae Ⅲ 2种限制性内切酶消化后与接头相连的产物形成2个“DNA库”,利用GSP1、GSP2与ap1~ap12组成的引物对对3条Actin基因的侧翼序列进行巢式扩增,选取阳性扩增进行克隆,每条序列选取2~3个阳性克隆进行平行测序(图 4)。通过Sequencher 4.2软件将测序结果分别与PhACT1、PhACT2、PhACT3进行序列拼接,通过Blast和Genetyx version 7对拼接序列进行比对、分析,除去非编码区,最终确定3条Actin基因的编码区由760 bp分别延长至1 008、1 008及975 bp,GenBank登入号依次为KT363847、KT363848、KT363849。

|
图 3 太子参基因组DNA 电泳检测 Fig.3 Electrophoresis of genomic DNA from P. heterophylla |
|
图 4 抑制PCR 扩增Actin 基因侧翼序列 (5’→3’) Fig.4 Suppression PCR amplification flanking sequence of Actin gene (5’→3’) |
2.3 太子参Actin基因序列分析
根据序列拼接结果,推测PhACT1、PhACT2与PhACT3分别编码含336、336和325个氨基酸残基的多肽,其中包含2种Actin信号序列:YVGDEAQSKRG(35~45、35~45、24~34)为Actinssignature 1序列,LLTEAPLNPKANR(86~98、86~98、85~87)为Actins and actin-related proteins signature序列(图 5)。通过BlastP对3个Actin基因编码的蛋白进行保守区预测,结果显示PhACT1、PhACT2和PhACT3均属于NBD_sugarkinase_HSP70_actin superfamily家族(图 6)。统计发现,3条多肽均含有20种常见氨基酸,量相对较多的是丙氨酸(Ala,A)、甘氨酸(Gly,G)、异亮氨酸(Ile,I)、亮氨酸(Leu,L)和谷氨酸(Gly,E),以上5种氨基酸的总量在3条多肽中分别达40%、38%和38.4%,量相对较低的是色氨酸(Trp,W)和半胱氨酸(Cys,C),分别只含3个和2个。

|
图 5 太子参Actin 基因片段的核苷酸序列及推测的氨基酸序列 Fig.5 Nucleic acid sequence and deduced amino acid sequence of Actin gene fragment of P. heterophylla |

|
图 6 太子参Actin 保守区结构域 Fig.6 Conserved domains of Actin protein from P. heterophylla |
2.4 太子参Actin基因进化分析
为了探索太子参Actin基因与其他植物Actin基因的进化关系,选取序列比对中同源性较高的鹅肠菜Myosoton aquaticum (L.) Moench、甜菜Betavulgaris L.、青葙Celosia argentea L. 等15个物种的23条Actin基因,利用它们的氨基酸序列构建NJ进化树(图 7)。结果发现,来源于太子参的3个Actin基因被归入Class Ⅰ和Class Ⅱ 2个亚群,PhACT2(KT363848)和PhACT3(KT363849)出现在Class Ⅰ,PhACT1(KT363847)出现在Class Ⅱ,说明太子参Actin不仅存在多个异型体,而且发生了功能的分化。

|
图 7 Actin 氨基酸序列NJ 进化树分析 Fig.7 Phylogenetic tree of Actin amino acid sequence |
将太子参与其他植物的Actin氨基酸序列片段进行多重比较,发现Actin基因虽然在植物进化过程中基因功能发生了分化,但其氨基酸序列仍表现出高度的保守性。在进行多重比较的336个氨基酸序列中,保守氨基酸多达314个,而非保守氨基酸仅有22个,不足7%。已有研究[16]发现在关键位置氨基酸的替换可能是引起植物Actin基因功能分化的原因,在本研究中同样的位置也出现了类似的替换,PhACT1与同属于Class Ⅱ的拟南芥(U39480)和水稻(NM001057621)在第181位由S取代了M,第217位S取代A,第221位S取代N(U39480为N)(图 8),暗示这3个特殊位置的氨基酸突变可能与植物Actin基因功能分化存在一定的联系。

|
图 8 不同物种Actin 基因比对分析 Fig.8 Comparison on alignment of Actin from different species |
2.5 表达稳定性分析
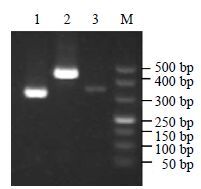
通过半定量RT-PCR技术,分析3个Actin基因在不同种源、不同器官、不同生长发育时期的表达情况。根据3个Actin基因的核心片段设计的特异引物Actin-1F/Actin-1R、Actin-2F/Actin-2R、Actin-3F/Actin-3R分别对PhACT1、PhACT2、PhACT3基因进行特异扩增,扩增产物长度依次为344、328和464 bp(图 9)。
|
图 9 3 个Actin 基因扩增片段 Fig.9 Amplification fragments of three Actin genes |
2.5.1 种源特异性分析
分别提取不同种源太子参块根中的总RNA,利用半定量RT-PCR分析3个Actin基因在太子参不同种源块根中的表达情况。研究发现,3个Actin基因在不同种源块根中均有表达,PhACT2和PhACT3表达量高且稳定,PhACT1在不同种源太子参块根中的表达量具有一定的差异且相对较低(图 10)。

|
图 10 3 个Actin 基因在不同种源块根中的表达 Fig.10 Expression levels of three Actin genes in root tuber of P. heterophylla from different sources |
2.5.2 组织特异性分析
分别提取GZ-2的花、茎、叶、块根的总RNA,半定量RT-PCR分析表明,3个Actin基因在太子参各器官中均有表达,PhACT1在各器官中的表达量相对较低,PhACT3的表达量相对较高,但两者在不同器官的表达量存在一定的差异,而PhACT2在各器官中的表达量高且稳定(图 11)。
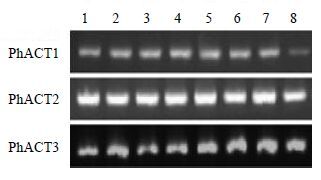
|
图 11 3 个Actin 基因在太子参不同器官中的表达 Fig.11 Expression levels of three Actin genes of P. heterophylla in different organs |
2.5.3 生长过程中表达稳定性分析
为了检测3个Actin基因在太子参生长过程中的表达情况,以GZ-2为样品,提取同一株太子参不同茎节和相应茎节上叶的总RNA,通过半定量RT-PCR分析,结果表明,3个Actin基因在生长过程中表达相对稳定,除PhACT1表达量相对偏低外,PhACT2和PhACT3均相对较高(图 12)。

|
图 12 3 个Actin 在太子参生长过程中的表达 Fig.12 Expression levels of three Actin genes during the growth of P. heterophylla |
3 讨论
植物中的Actin是一条多肽链的球状蛋白,一般由375~377个氨基酸组成,相对分子质量约为4.2×104,属于多基因家族,从而产生多种Actin异型体[17-18]。这些异型体虽然在一级结构上同源性很高,但在时间和空间表达上具有组织和器官特异性,执行着不同的生理功能,以适应不同组织和细胞类型在不同发育时期的需要[19-20]。目前研究证明Actin主要分为营养型和生殖型2类。编码营养型的Actin基因在所有营养器官和细胞类型中组成型表达,而编码生殖型的Actin基因主要在成熟花粉、生长的花粉管或者胚珠中表达[21-23]。因此,在以Actin作为内参基因进行功能基因相对定量分析时,需要筛选出在该植物不同器官、组织以及不同生长期均能稳定表达的组成型Actin基因。本研究利用RT-PCR和抑制PCR技术得到分别编码3种太子参Actin异型体的Actin基因的核心片段PhACT1、PhACT2和PhACT3,其编码的蛋白质保守区预测结果显示,3条序列均属于Actin superfamily家族,且含有2种Actin基因信号序列:YVGDEAQSKRG和LLTEAPLNPKANR,与GenBank中收录的其他植物的Actin基因编码的氨基酸序列相似度均达95%以上,说明太子参的Actin基因也属于多基因家族,编码多种Actin异型体,并且基因序列具有高度的保守性。将太子参的3个Actin基因片段编码的氨基酸序列与其他植物同等大小的氨基酸序列进行进化分析,发现明显被分为2类:Class Ⅰ和Class Ⅱ 2个亚群,该研究与前人研究结果一致[16, 24]。3个太子参Actin基因分别属于2类,PhACT2和PhACT3属于Class Ⅰ,PhACT1单独属于Class Ⅱ,说明在这3个太子参Actin基因中包含了营养型和生殖型2种类型的Actin异型体,基因功能发生了分化,并且PhACT2和PhACT3这2个基因在亲缘关系及功能上可能更为接近。
肌动蛋白虽然被认为是真核生物细胞中普遍存在的最保守的古老蛋白之一,但在自然界适应生存下其编码基因仍然存在着变异,其中在一些关键位置的变异可能导致其产生多种异型体。通过对3个太子参Actin基因编码的氨基酸序列的同源性比较,结果显示,太子参存在3个特殊位置氨基酸的替换,与李军等[16]对桑树的研究结果极为相似,这可能就是导致功能分化的关键位置。为了从3个太子参Actin基因中筛选出稳定表达基因作为内参基因,本研究对3个Actin基因在太子参不同种源、不同器官以及在不同生长过程中的表达情况进行了分析,结果与序列进化分析一致:PhACT1表达量相对较低且在不同的种源、器官和生长阶段中表达存在一定的差异,可能为生殖型肌动蛋白基因;PhACT2和PhACT3表达量相对较高且表达差异相对较小,推断其为营养型肌动蛋白基因,在所有营养器官和细胞类型中组成型表达,其中尤其以PhACT2表达量高且稳定,可以作为太子参功能基因研究的内参基因。该基因的确定为探讨太子参药材代谢物质形成的遗传学机制以及其他功能基因的表达规律奠定了前期基础。
| [1] | 邢朝斌, 龙月红, 修乐山, 等. 刺五加肌动蛋白基因的克隆和表达稳定性分析[J]. 中草药, 2013,44 (13) :1819–1822. |
| [2] | 牙库甫江·阿西木, 关波, 张富春. 植物基因表达转录分析中内参基因的选择与应用[J]. 生物技术通报, 2011 (7) :7–11. |
| [3] | Vidali L, Hepler P K. Actin and pollen tube growth[J]. Protoplasma, 2001, 215 (1) :64–76 . |
| [4] | Collings D A, Harper J D, Marc J. Life in the fast lane: actin-based motility of plant peroxisomes[J]. Can J Bot, 2002, 80 (4) :430–441 . |
| [5] | 中国药典[S]. 一部. 2015. |
| [6] | 刘训红, 陈彬, 王玉玺. 太子参多糖抗应激和免疫增强作用的实验研究[J]. 江苏中医, 2000,21 (10) :51–52. |
| [7] | Hiroshi M, Takashi K, Hideyuki K, et al. Pseudostellarins A-C, new tyrosinase inhibitory cyclic peptides from Pseudostellaria heterophylla[J]. Tetrahedron, 1994, 50 (23) :6797–6804 . |
| [8] | 陈传艺, 肖承鸿, 江维克, 等. 不同引种地与原产地太子参药材的品质比较[J]. 农技服务, 2013,30 (9) :1008–1012. |
| [9] | 邹立思, 傅兴圣, 刘训红, 等. 太子参药材中环肽A、B 含量分析及其动态研究[J]. 南京中医药大学学报, 2013,29 (2) :175–178. |
| [10] | 肖承鸿, 周涛, 江维克, 等. 贵州太子参生物量与次生代谢物积累的动态变化分析[J]. 中国药学杂志, 2013,48 (16) :1349–1351. |
| [11] | 康传志. 太子参商品规格与生态适宜区划研究[D]. 贵阳: 贵阳中医学院, 2015. |
| [12] | 林茂兹, 王海斌, 林辉锋. 太子参连作对根际土壤微生物的影响[J]. 生态学杂志, 2012,31 (1) :106–111. |
| [13] | 肖承鸿, 周涛, 江维克, 等. 贵州栽培太子参主要农艺性状比较及相互关系研究[J]. 中国中药杂志, 2013,38 (6) :812–816. |
| [14] | 肖承鸿, 周涛, 江维克, 等. 栽培太子参的遗传多样性与质量分析[J]. 中草药, 2014,45 (9) :1319–1325. |
| [15] | Jiang Z B, Wang H P, Ma Y S, et al. Characterization of two novel lipase genes isolated directly from environmental sample[J]. Appl Microbiol Biot, 2006, 70 (3) :327–332 . |
| [16] | 李军, 赵爱春, 王茜龄, 等. 三个桑树肌动蛋白基因的克隆与组织表达分析[J]. 作物学报, 2011,37 (4) :641–649. |
| [17] | 陈颖, 王刚, 赵俊霞. 高等植物体内的肌动蛋白[J]. 生物学报, 2003,38 (1) :13–15. |
| [18] | Meagher R B, McKinney E C, Kandasamy M K. Isovariant dynamics expands and buffers the responses of complex systems: the diverse plant actin gene family[J]. Plant Cell, 1999, 11 (6) :995–1005 . |
| [19] | Jiang Y Q, Zhao W L. Expression and phylogenetic analysis of pea actin isoforms[J]. J Integr Plant Biol, 2002, 44 (12) :1456–1461 . |
| [20] | Kandasamy M K, Gilliland L U, McKinney E C, et al. One plant Actin isovariant, ACT7, is induced by auxin and required for normal callus formation[J]. Plant Cell, 2001, 13 (7) :1541–1554 . |
| [21] | Kandasamy M K, McKinney E C, Meagher R B. Functional nonequivalency of Actin isovariants in Arabidopsis[J]. Mol Biol Cell, 2002, 13 :251–261 . |
| [22] | Kandasamy M K, Burgos-Rivera B, McKinney E C, et al. class-specific interaction of profilin and ADF isovariants with Actin in the regulation of plant development[J]. Plant Cell, 2007, 19 (10) :3111–3126 . |
| [23] | McDowell J M, Huang S, McKinney E C, et al. Structure and evolution of the Actin gene family in Arabidopsis thaliana[J]. Genetics, 1996, 142 (2) :587–602 . |
| [24] | Jiang Z B, Wang H P, Ma Y S, et al. Characterization of two novel lipase genes isolated directly from environmental sample[J]. Appl Microbiol Biot, 2006, 70 (3) :327–332 . |
 2016, Vol. 47
2016, Vol. 47


