2. 江苏省中医药研究院 国家中医药管理局中药释药系统重点研究室, 江苏 南京 210028 ;
3. 江苏济川制药有限公司, 江苏 泰兴 225400
2. Key Laboratory of New Drug Delivery Systems of Chinese Materia Medica, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China ;
3. Jiangsu Jumpcan Pharmaceutical Co., Ltd., Taixing 225400, China
骨质疏松症(osteoporosis,OP)是一种以全身性骨量减少、骨组织微观结构退化为特征,能够极大地增加脆性骨折发生率的疾病[1]。原发性OP是绝经后老年妇女的一种常见病、多发病,严重威胁着老年人的健康。随着世界人口老龄化的发展,OP发病率也呈上升趋势,为此,WHO已将其列为三大老年性疾病之一。目前临床上用于治疗OP的药物主要有钙剂、雌激素、维生素D、降钙素类、双磷酸盐类等,虽然临床上具有一定的疗效,但不良反应较多[2]。中医药治疗OP强调辨证施治,综合调理,注意改善身体整体素质,毒副作用小,可以长期服用,有化学药无法取代的优势,因此,从中医药中寻找治疗OP的有效药物具有非常重要的意义。
淫羊藿Epimedii Herba为小檗科植物淫羊藿Epimedium brevicornu Maxim.、箭叶淫羊藿Epimedium sagittatum (Sieb. et Zucc.) Maxim.、柔毛淫羊藿Epimedium pubescens Maxim. 或朝鲜淫羊藿Epimedium koreanu Nakai的干燥叶,始载于《神农本草经》,具有补肾阳、强筋骨、祛风湿的功效[3]。近年有关淫羊藿抗OP作用的相关报道较多,但其研究对象主要是淫羊藿中单体,如淫羊藿苷[4-6]、淫羊藿素[7],淫羊藿总黄酮[2, 8]以及含有淫羊藿的复方[9-10],有关淫羊藿水提物[11]和醇提物对OP的治疗作用也有报道,但迄今为止,有关淫羊藿醇提物对OP作用的机制研究尚未见报道。本研究以去卵巢致骨质疏松大鼠为模型,通过测定大鼠胫骨生物力学性能、股骨骨密度和骨小梁微体结构,观察淫羊藿醇提物对去卵巢骨质疏松大鼠的防治作用。此外,本实验还评价了淫羊藿醇提物对大鼠血清指标、骨保护素(OPG)和破骨细胞分化因子(RANKL)蛋白表达的影响,初步探讨淫羊藿醇提物对去卵巢骨质疏松大鼠的作用机制。
1 材料Agilent 1100系列高效液相色谱仪(美国Agilent公司);小动物Micro-CT(Bruker SkyScan 1176);5943单立柱台式材料试验机(Instron,Norwood,MA);IX51型显微镜(日本,Olympus);切片机(美国,Reichert HistoSTAT);THZ-312型孵箱(上海精宏实验设备有限公司);101AS-3型烤箱(上海圣欣科学仪器有限公司)。
碱性磷酸酶(ALP)、抗酒石酸酸性磷酸酶(StrACP)试剂盒(南京建成生物工程研究所);兔抗鼠OPG(BA1475-1)、RANKL(BA1323)抗体(武汉博士德生物工程有限公司);二抗(羊抗兔IgG,Jackson ImmunoResearch公司);苏木素染色液(南京建成生物工程研究所);中性树胶(国药集团化学试剂有限公司);甲醇、乙腈(色谱纯,美国,TEDIA),水为高纯水,其他试剂均为国产分析纯。
淫羊藿饮片(安徽省亳州市滕王药业有限责任公司,批号20140206),经中国医学科学院药用植物研究所郭宝林教授鉴定为朝鲜淫羊藿Epimedium koreaum Nakai的干燥叶。依普黄酮片(湖北四环制药有限公司,批号140201);朝藿定A、朝藿定B、朝藿定C、宝霍苷I(自制,质量分数>98%);淫羊藿苷(西安小草植物科技有限公司,批号xc20130628,质量分数>98%)。
3 月龄SD大鼠,雌性,体质量(202.36±16.90)g,购自南通大学,饲养于江苏省中医药研究院实验动物中心,许可证号SCXK(苏)2014-0001。
2 方法与结果 2.1 淫羊藿醇提物的制备精密称取淫羊藿药材5.0 kg,用50%乙醇加热回流2次,第1次用18倍量的乙醇,第2次用15倍量的50%乙醇,每次1 h,合并滤液,滤过后减压浓缩并蒸干,得淫羊藿醇提物固体粉末1.08 kg。
2.2 淫羊藿醇提物中主要成分分析 2.2.1 色谱条件色谱柱为Hedera ODS-2 C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)和水(B),洗脱程序:0~29 min,25% A;29~30 min,25%~41% A;30~55 min,41% A;55~56 min,41~25% A;56~60 min,25% A;体积流量1 mL/min,检测波长270 nm,柱温为30 ℃,进样量为10 μL。
2.2.2 对照品溶液的制备分别称取朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝霍苷I 2.13、2.00、2.05、3.34、4.00 mg 置于10 mL量瓶中,加甲醇至刻度,用0.45 μm微孔滤膜滤过,分别制成质量浓度分别为213、200、205、334、400 μg/mL的对照品储备液。
2.2.3 供试品溶液的制备精密称取淫羊藿醇提物粉末20 mg置于10 mL量瓶中,加甲醇至刻度,续滤液作为供试品溶液。
2.2.4 线性关系考察精密吸取对照品储备液10.0、5.0、2.0、1.0、0.2 mL置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,分别进样10 μL,记录色谱图和峰面积。以各成分峰面积(Y)为纵坐标、质量浓度(X)为横坐标,绘制标准曲线,得线性回归方程,见表 1。
|
|
表 1 各成分的线性关系和范围 Table 1 Linear relationship and ranges of each constituent |
2.2.5 精密度试验
精密吸取供试品溶液10 μL,在“2.2.1”项下色谱条件下重复进样6次,记录峰面积,计算朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝霍苷I峰面积的RSD分别为0.76%、0.82%、0.98%、0.87%、0.86%。
2.2.6 重复性试验取同一批次淫羊藿药材6份,按“2.1”和“2.2.3”项下方法制备供试品溶液。按“2.2.1”项条件,进样10 μL,测得朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝霍苷I质量分数的RSD分别为0.86%、0.92%、0.67%、1.51%、1.38%。表明本法重复性较好。
2.2.7 稳定性试验取供试品溶液,分别于制备后0、2、4、6、8、12、24 h进样10 μL,测定其峰面积,计算朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝霍苷I峰面积的RSD分别为1.32%、1.08%、0.71%、0.82%、1.36%。
2.2.8 加样回收率试验精密称取已测定的样品6份,每份20 mg,精密加入混合对照品溶液,按“2.2.1”项下方法进样分析,计算加样回收率。经计算朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝霍苷I的平均加样回收率分别为99.07%、101.09%、97.14%、102.98%、97.04%,RSD分别为1.02%、1.34%、2.56%、1.93%、1.28%。
2.2.9 样品测定分别取供试品溶液和混合对照品溶液10 μL注入高效液相色谱仪中,按“2.2.1”项下色谱条件进样分析,得供试品溶液和混合对照品溶液的HPLC图谱,见图 1。根据标准曲线计算样品中各化合物的质量分数,结果淫羊藿醇提物中朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝霍苷I的质量分数分别为32.96、43.15、23.33、40.79、10.23 mg/g。
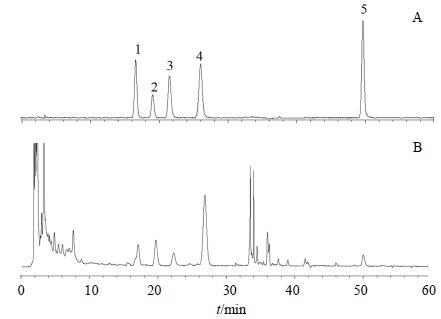
|
图 1 混合对照品 (A) 和淫羊藿醇提物 (B) 的HPLC图 Fig.1 HPLC of mixed reference substances (A) and AEEH (B) |
2.3 分组、造模与给药
雌性SD大鼠用10%水合氯醛(0.3 mL/100 g)麻醉后,分别在下腹部两侧各剪一个约1 cm的开口,用镊子和手术剪从开口处将双侧卵巢切除,下侧输卵管用手术线结扎,在伤口处涂撒适量青霉素后缝合。造模期间的前3 d,im青霉素2×105 U/只,预防感染。假手术组打开腹腔后只切除少量脂肪组织后缝合,其他操作同手术组。
手术4周后,取健康存活的大鼠,随机分组,每组8只,假手术组(10 mL/kg 0.5%羧甲基纤维素钠溶液),模型组(10 mL/kg 0.5%羧甲基纤维素钠溶液),阳性药组(伊普黄酮,200 mg/kg);淫羊藿醇提物(170、85 mg/kg),各组均ig给药,每天1次,连续给药8周。
2.4 对去卵巢大鼠血清指标的影响给药8周后,眼眶取血,在37 ℃水浴中孵育30 min,3 000 r/min离心10 min后取上清,得血清,−20 ℃保存备用。严格按试剂盒说明书操作,分别测定血清中ALP和StrACP活性。实验结果显示,与假手术组比较,模型组大鼠血清中ALP和StrACP活性显著升高(P<0.05);给药8周后,与模型组比较,伊普黄酮和淫羊藿醇提物高剂量组均能显著降低ALP和StrACP水平(P<0.05、0.01),结果见图 2。
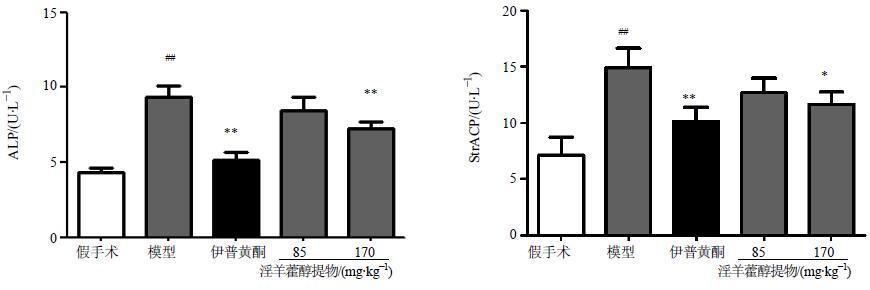
|
图 2 淫羊藿醇提物对去卵巢大鼠血清ALP和StrACP活性的影响 (x±s,n = 8) Fig.2 Effect of AEEH on ALP level and StrACP in serum of OVX rats (x±s,n = 8) |
2.5 对去卵巢大鼠OPG和RANKL蛋白表达的影响
取大鼠左侧股骨,剔净附着的软组织和软骨,用4%多聚甲醛溶液固定,石蜡包埋后,切成厚度为5 μm的小块。将切片用二甲苯浸泡后脱蜡,经各级浓度乙醇水化。用PBS冲洗3遍后进行抗原修复,每张切片加2滴3% H2O2,室温下共孵育10 min,淬灭内源性氧化酶。用PBS冲洗3遍后加入一抗OPG(1∶200)和RANKL(1∶200),在4 ℃下孵育过夜。用PBS冲洗3遍,加入二抗在室温下孵育20 min,PBS冲洗。每张片子滴加2滴新鲜配制的DAB显色,反应20 min后,用蒸馏水轻轻冲洗后放入苏木素染液中复染。在70%、85%、95%乙醇和无水乙醇中浸泡5 min脱水,二甲苯浸泡后用中性树脂封片。在光学显微镜下观察各蛋白的表达情况,每个切片随机选择4个视野并拍照保存。图片采用Image pro-plus 6.0专业图像处理软件进行定量分析。
OPG和RANKL细胞质被染为棕色。与假手术组相比,模型组大鼠骨组织中OPG表达显著降低(P<0.01),治疗8周后,伊普黄酮和淫羊藿醇提物高剂量组OPG表达显著增加(P<0.01);与假手术组相比,模型组RANKL表达显著增加(P<0.01),治疗8周后,伊普黄酮和淫羊藿醇提物高剂量组RANKL表达显著降低(P<0.01),结果见图 3和4。
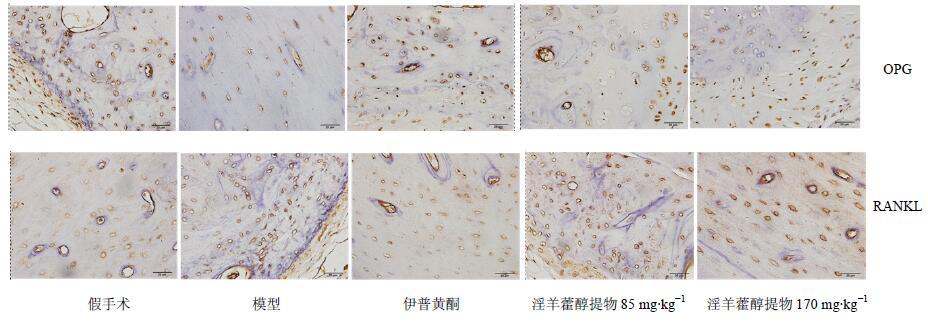
|
图 3 淫羊藿醇提物对去卵巢大鼠股骨内OPG和RANKL蛋白表达的影响 Fig.3 Effects of AEEH on OPG and RANKL protein expression in femur of OVX rats |
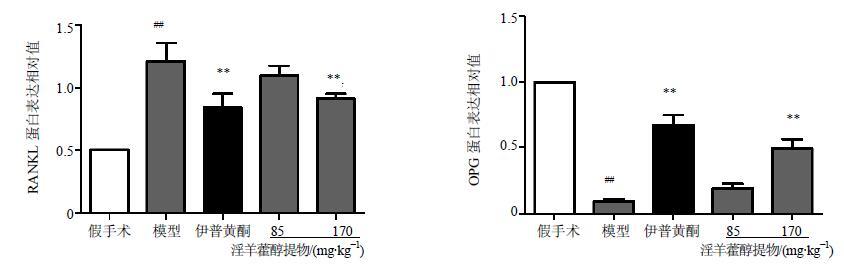
|
图 4 淫羊藿醇提物对去卵巢大鼠股骨内OPG、RANKL蛋白表达相对值的影响 (x±s,n = 8) Fig.4 Effects of AEEH on relative expression levels of OPG and RANKL protein in femur of OVX rats (x±s,n = 8) |
2.6 对去卵巢大鼠胫骨生物力学性能的影响
取大鼠右侧胫骨,剔净附着的软组织和软骨,保存于−20 ℃的冰箱中,使用时从冰箱取出复温,用5943单立柱台式材料试验机做胫骨的三点弯曲实验。跨距:12.1 mm,压力加载速度:1 mm/min,检测过程由计算机自动描记胫骨的位移-载荷曲线、假手术 模型 伊普黄酮 淫羊藿醇提物85 mg·kg−1 淫羊藿醇提物170 mg·kg−1最大载荷、弹性模量和断裂能。
如表 2所示,与假手术组相比,模型组大鼠胫骨最大载荷、弹性模量、断裂能均显著下降(P<0.01)。治疗8周后,与模型组相比,伊普黄酮组最大载荷、弹性模量、断裂能分别增加33.0%、48.8%、86.2%(P<0.05、0.01),淫羊藿醇提物高剂量组最大载荷、弹性模量、断裂能分别增加25.7%、34.3%、64.9%(P<0.05),说明淫羊藿醇提物和伊普黄酮能够显著改善去卵巢致骨质疏松大鼠胫骨的强度,从而达到治疗骨质疏松的作用。
|
|
表 2 淫羊藿醇提物对去卵巢大鼠胫骨生物力学性质的影响 (x±s,n = 8) Table 2 Effects of AEEH on bone biomechanical parameters in tibia of OVX rats (x±s,n = 8) |
2.7 对去卵巢大鼠骨密度(BMD)和骨小梁结构参数的影响
称质量后的左侧股骨浸泡在4%中性甲醛溶液中,实验前48 h将大鼠股骨转移至PBS中,用Micro-CT测定骨微结构,扫描电压为50 kV,电流为50 μA,分辨率35 μm,360° 旋转。获得重建图像后利用Skyscan分析软件(CT Analyser,Skyscan,Belgium)对ROI区进行定量分析,获取BMD和 骨微结构参数:骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)、骨表面积和骨体积的比值(BS/BV)、骨小梁厚度(Tb.Th)。
由表 3可知,模型组大鼠的BMD较假手术组显著下降(P<0.01)。给药8周后,伊普黄酮组和淫羊藿醇提物高剂量组的BMD显著增加(P<0.05、0.01)。股骨远端骨小梁结构参数分析结果显示,模型组的BV/TV、Tb.N、Tb.Th均显著降低(P<0.01),同时BS/BV显著增加(P<0.01)。给药8周后,与模型组相比,伊普黄酮组和淫羊藿醇提物高剂量组均能一定程度上逆转上述指标(P<0.05、0.01)。淫羊藿醇提物低剂量组能够显著性降低BS/BV值(P<0.01),但对其他指标无显著性影响。
|
|
表 3 淫羊藿醇提物对去卵巢大鼠BMD及相关骨小梁参数的影响 (x±s,n = 8) Table 3 Effects of AEEH on BMD and other parameters of trabecular bone structures of OVX rats (x±s,n = 8) |
通过三维重建,得到股骨远端骨小梁的3D图形(图 5)。由图片可以看出,假手术组骨小梁数目较多,排列紧凑且厚度较大,而模型组骨小梁稀疏,数目明显减少,孔隙率增加;与模型组相比,伊普黄酮组和淫羊藿醇提物高剂量组骨小梁厚度和数目都有较为显著的增加。本实验结果与三点弯曲实验结果表明,淫羊藿增强骨质疏松大鼠生物力学强度可能是通过促进骨小梁再生、增大骨密度而实现的。
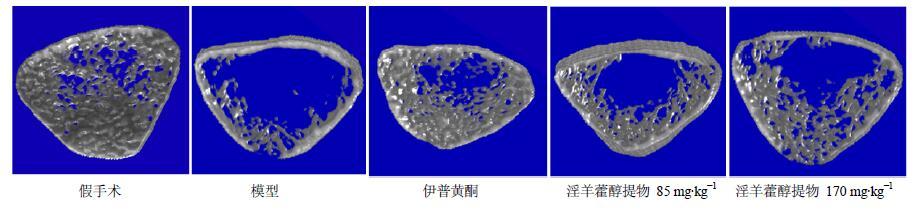
|
图 5 大鼠股骨远端骨小梁微观结构Micro-CT 3D图像 Fig.5 Micro-CT images of trabecular bone in distal femur of rats |
3 讨论
正常成人骨组织处于不断重建过程之中,成骨细胞的骨形成和破骨细胞的骨吸收之间处于平衡状态。ALP是碱性环境中水解磷酸酯的一组酶类,是成骨细胞典型的标志酶,ALP偏高预示着骨骼疾病,可能是骨质疏松[12-13]。StrACP主要存在于破骨细胞中,当骨吸收时,StrACP由破骨细胞释放进入血液中。本实验研究发现,淫羊藿醇提物高剂量组能够显著降低ALP和StrACP水平,说明其可能是通过作用于成骨细胞和破骨细胞来发挥抗OP作用。
OPG/RANK/RANKL是参与调节骨重建的最重要的分子系统之一。OPG是由成骨细胞合成的一类跨膜蛋白,随着成骨细胞的分化而表达增加,它通过与相邻的破骨细胞内的RANKL结合,从而抑制破骨细胞的形成、分化、存活、活化,诱导破骨细胞的凋亡[14]。RANKL能够与破骨细胞表面受体RANK结合,促进破骨细胞的形成、分化、成熟,抑制破骨细胞凋亡,延长其存活。本实验采用免疫组化法测定OPG和RANKL蛋白的表达,进一步研究淫羊藿醇提物抗OP的作用机制。结果表明,淫羊藿醇提物能够增加成骨细胞OPG蛋白表达,降低破骨细胞RANKL蛋白表达。进一步说明淫羊藿的抗OP作用是通过上调OPG/RANKL比例来实现的。
对骨生物力学进行实验研究,能够直接对骨脆性进行评定,从而准确预测发生骨折的危险性。本实验三点弯曲试验表明:模型组的最大载荷、弹性模量和断裂能均显著低于假手术组,这是由于模型组密质骨和松质骨骨量减少使骨强度减弱,从而导致骨骼抵抗外力的作用下降[15]。给药治疗8周后,伊普黄酮组和淫羊藿醇提物高剂量组能够逆转最大载荷、弹性模量和断裂能的降低,说明淫羊藿能够增强去卵巢大鼠的骨强度,降低骨折危险。
BMD是临床上用于诊断骨质疏松的“金标准”,也是判断药物疗效的重要依据[16]。使用micro-CT对骨质疏松大鼠股骨进行检测,不仅能够对BMD进行测定,而且能够全面、直观、立体地观察骨质量的变化。本实验对股骨远端进行三维立体重建并对骨小梁参数进行定量分析,实验结果表明,淫羊藿醇提物高剂量组不仅能够增加骨质疏松大鼠的BMD,而且能够改善骨小梁的微体结构,提高骨质量。
综上所述,淫羊藿醇提物对切除卵巢的大鼠骨质疏松具有一定的治疗作用,不仅能够提高股骨的生物力学性,增加骨密度,减少骨折风险,而且能够提高OPG/RANKL比例。说明淫羊藿醇提物是通过促进成骨细胞的表达,减少破骨细胞的表达、上调OPG/RANKL比例来发挥抗OP作用。
| [1] | 刘忠厚. 骨质疏松症[M]. 北京: 科学技术出版社, 1997 . |
| [2] | 曲萍, 刘新春, 马亚兵. 淫羊藿总黄酮抗骨质疏松作用研究[J]. 中国药业, 2005,14 (11) :25–26. |
| [3] | 中国药典[S]. 一部. 2015. |
| [4] | Nian H, Ma M H, Nian S S, et al. Antiosteoporotic activity of icariin inovariectomized rats[J]. Phytomedicine, 2009, 16 (4) :320–326 . |
| [5] | Li XF, Xu H, Zhao Y J, et al. Icariin Augments Bone Formation and Reverses the Phenotypes of Osteoprotegerin-Deficient Mice through the Activation of Wnt/β-Catenin-BMP Signaling[J]. Evid Based Complement Alternat Med, 2013 . doi:10.1155/2013/652317 |
| [6] | 钱卫庆, 尹宏, 孙海涛. 不同浓度淫羊藿苷对大鼠成骨细胞增殖、分化的影响[J]. 中国医药导报, 2011,8 (36) :23–25. |
| [7] | 朱晓峰, 张荣华, 孙升云, 等. 淫羊藿素通过雌激素受体和骨形态发生蛋白信号诱导MC3T3-E1 subclone 14细胞分化[J]. 中国病理生理杂志, 2011,27 (12) :2351–2356. |
| [8] | 蒋俊, 崔莉, 孙娥, 等. 基于淫羊藿黄酮类化合物的体内代谢阐述其抗骨质疏松药效物质基础[J]. 中草药, 2014,45 (5) :721–729. |
| [9] | Sze S C W, Ip C W, Ng T B, et al. Compatibility of multiple herbal components in Erxian Decoction, a Chinese medicinal formula, for treating osteoporosis[J]. Eur J Integr Med, 2012, 4 (2) :e187–e196 . |
| [10] | Wang X, He Y, Guo B, et al. In vivo screening for anti-osteoporotic fraction from extract of herbal formula Xianlinggubao in ovariectomized mice[J]. PloS One, 2015 . doi:10.1371/journal.pone.0118184 |
| [11] | 年华, 徐玲玲, 马明华, 等. 箭叶淫羊藿对去卵巢大鼠骨量丢失的保护作用[J]. 中西医结合学报, 2006,4 (6) :628–633. |
| [12] | 蒋俊. 基于体内自组装胶束形成机制的羊脂油对淫羊藿黄酮苷元抗骨质疏松增效机理研究[D]. 镇江: 江苏大学, 2015. |
| [13] | 李媛, 许红涛, 李华强, 等. 肾阳虚骨质疏松大鼠动物模型的建立[J]. 药物评价研究, 2015,38 (2) :135–139. |
| [14] | 郭海玲, 赵咏芳, 王翔, 等. 淫羊藿苷对人成骨细胞增殖及OPG蛋白表达的实验研究[J]. 中国骨伤, 2011,24 (7) :585–588. |
| [15] | 马洪顺, 陆有, 王晓晨. 骨质疏松对骨生物力学性质影响实验研究[J]. 中国生物医学工程学报, 2003,22 (4) :364–369. |
| [16] | Väänänen S P, Isaksson H, Julkunen P, et al. Assessment of the 3-D shape and mechanics of the proximal femur using a shape template and a bone mineral density image[J]. Biomech Model Mechanobiol, 2011, 10 (4) :529–538 . |
 2016, Vol. 47
2016, Vol. 47


