2. 上海中医药大学 药物安全评价研究中心, 上海 201203
2. Drug Safety Evaluation and Research Center, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
据统计,2013年我国糖尿病患者约为9 840万,已逐渐成为世界上患者最多的国家[1]。糖尿病的严重并发症包括糖尿病视网膜病变(diabetic retinopathy,DR)、糖尿病肾病(diabetic nephropathy,DN)等,严重影响了糖尿病患者的生活质量。临床上,根据DR的发病过程分为2个阶段:早期非增殖性糖尿病视网膜病变(NPDR)和后期增殖性糖尿病视网膜病变(PDR)[2]。NPDR阶段的一个显著标志是血-视网膜屏障(blood-retinal barrier,BRB)的破坏[3]。内皮细胞间存在的紧密连接、缝隙连接、黏附连接,以及连接神经元与血管的胶质细胞的终足与缝隙连接等一起构成BRB,BRB在调节血管通透性、神经-视网膜组织营养物质输送和供氧等过程中有重要作用[3]。在一些条件如糖尿病代谢紊乱、炎性反应等能导致内皮细胞和周细胞受损、凋亡,进而造成紧密连接破坏,导致BRB的破坏,加剧血管渗漏、闭塞和无灌注区形成,造成缺血、缺氧状态,引发促血管新生因素如血管生长因子(VEGF)等上调,导致血管病理性增生和严重视力损害[3-5]。
鼓槌石斛Dendrobium chrysotoxum Lindl. 是石斛的一种,石斛自古以来就被列为我国传统名贵中药,具有滋阴清热、生津益胃、明目之功效,以石斛为君药的石斛明目丸、石斛夜光丸临床上常用于消渴日久、燥热阴虚所致视物不清、夜盲昏花等。现代研究发现,石斛的化学成分主要包括生物碱类、多糖、联苄类、黄酮类、倍半萜类、酚类等,已有研究表明石斛具有抗肿瘤、抗氧化、延缓衰老、增强免疫力、抗血栓形成、改善眼部微循环等药理作用[6-9]。本实验通过链脲佐菌素(STZ)诱导NPDR小鼠模型,观察鼓槌石斛乙醇提取物(ethanol extract from Dendrobium chrysotoxum,EEDC)对NPDR模型小鼠BRB的保护作用,进一步检测视网膜组织、血清中炎性因子、调控血液凝血/纤溶相关因子的基因表达水平来探讨其可能的机制。
1 材料 1.1 药物鼓槌石斛药材由南京金陵制药厂馈赠,由上海中医药大学中药研究所吴立宏教授鉴定为鼓槌石斛Dendrobium chrysotoxum Lindl.,EEDC参考文献方法自制[10],其中联苄类化合物毛兰素、杓唇石斛素、石斛酚的质量分数分别为0.71%、0.03%、0.11%。称取适量EEDC浸膏,加入0.5% CMC-Na研磨溶解,配成给药溶液。
1.2 试剂STZ(Sigma公司);柠檬酸、柠檬酸三钠、多聚甲醛、牛血清白蛋白(BSA,国药集团化学试剂有限公司);伊文思蓝(Sigma公司);Trizol试剂(Life Technology公司);PrimeScript® RT Master Mix、SYBR® Premix Ex TaqTM(Takara公司);用于real-time PCR(RT-PCR)特异性引物序列(购自上海捷瑞公司)见表 1;ELISA kits均购自 RapidBio(West Hills,CA)。其余试剂均购自Sigma公司。各炎症因子试剂盒均购自RapidBio公司。
|
|
表 1 RT-PCR引物序列 Table 1 Sequences of primers for RT-PCR |
1.3 仪器
便携式血糖仪(Johnson公司);解剖显微镜(Olympus公司);酶标仪(Gene公司);Real-Time PCR仪(ABI Step-one Plus公司);微量移液器、低温离心机(Eppendorf公司);−80 ℃低温冰箱(Thermo Fish公司);超纯水过滤仪(Millipore公司);分析天平(Mettler Toledo公司);超声波细胞粉碎仪(宁波新芝生物科技公司)。
1.4 实验动物SPF级健康雄性C57BL/6J小鼠,体质量18~22 g,购自中国科学院上海实验动物中心,动物合格证号SCXK(沪)2012-0002,饲养于上海中医药大学实验动物中心,温度(22±1)℃,湿度(55±5)%,12 h光暗循环,饲料与水消毒后自由摄取,适应性饲养1周后使用。实验严格按照国家和上海中医药大学实验动物中心动物使用管理条例进行。
2 方法 2.1 造模、分组及给药分别配制0.1 mol/L柠檬酸和柠檬酸三钠溶液,柠檬酸溶液与柠檬酸三钠溶液以14∶11比例混匀,调pH值至4.2,配成STZ溶解缓冲液,置于冰上待用。称取STZ粉末避光溶解于缓冲液中,立即ip给予已禁食12 h的小鼠,终剂量55 mg/kg。连续给药5 d造模。造模1周后尾静脉取血测血糖值,随机血糖值高于16.7 mmol/L被认为糖尿病造模成功。糖尿病造模成功小鼠随机分为3组:模型组及EEDC 50、200 mg/kg组。未造模小鼠(ip给予相同体积STZ溶解缓冲液)作为对照组。造模成功1个月后各组开始ig给药,对照组和模型组ig等量0.5% CMC-Na,连续给药30 d。实验过程中监测体质量和血糖值。
2.2 小鼠视网膜伊文思蓝渗漏检测末次给药后,各组随机取6只小鼠,ip 2%伊文思蓝(PBS)10 μL/g,循环2 h后,左心室灌洗生理盐水(37 ℃)以清除小鼠体循环中伊文思蓝。然后摘取眼球,于解剖显微镜下取出视网膜组织,放于真空干燥箱中55 ℃真空干燥5 h,称取视网膜组织干燥后质量。加入120 μL甲酰胺,于70 ℃水浴18 h萃取出伊文思蓝。萃取液10 000×g离心1 h,吸取上清60 μL于酶标仪620 nm测吸光度值,代入标准曲线,计算出伊文思蓝的量,计算伊文思蓝的量与视网膜组织干燥后质量的比值,即得视网膜组织中伊文思蓝渗漏量(ng/g)。
2.3 RT-PCR检测小鼠视网膜组织相关基因表达末次给药后,各组其余小鼠乌拉坦麻醉,腹主动脉取血,立即摘取眼球。摘取的小鼠眼球,放置于DEPC-treated Water中,于解剖显微镜下取出视网膜组织(若不立即进行后续实验,样本组织存放于−80 ℃)。用Trizol 试剂提取视网膜组织总mRNA,总mRNA溶解于RNase-free H2O中,1 μg总mRNA按照试剂盒(TaKaRa)方法逆转录合成cDNA,RT-PCR扩增按照试剂盒(TaKaRa)方法,相对基因表达分析采用2−ΔΔCt法。
2.4 ELISA实验小鼠血液于860×g离心10 min,移取上清即得血清,血清中白细胞介素-6(IL-6)、IL-1β、肿瘤坏死因子α(TNF-α)及早期生长反应因子(Egr-1)、组织因子(TF)、纤溶酶原激活物抑制剂1(Serpine 1)检测按照试剂盒方法操作。
2.5 数据分析实验数据以x±s表示,采用SPSS 16.0软件进行统计,用One-Way ANOVA统计方法进行方差分析。
3 结果 3.1 各组小鼠体质量与血糖变化从图 1-A可见,各造模组小鼠体质量明显低于对照组,增加均不明显;而对照组小鼠体质量增加符合其生长曲线。从图 1-B可见,各造模组小鼠血糖值均≥16.7 mmol/L,且维持稳定。从以上2指标可以看出糖尿病小鼠造模成功。同时,EEDC对糖尿病小鼠的血糖和体质量无明显影响。
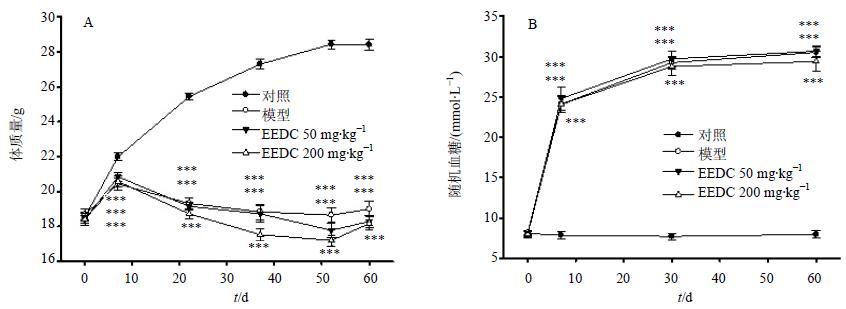
|
图 1 各组小鼠体质量 (A) 和随机血糖 (B) 比较 (x±s,n = 12) Fig.1 Comparison on body weight (A) and serum glucose level (B) of mice in each group (x±s,n = 12) |
3.2 对小鼠视网膜伊文思蓝渗漏的影响
从图 2可见,模型组小鼠视网膜伊文思蓝渗漏量较对照组明显增加(P<0.001),说明NPDR模型诱导成功。EEDC(50、200 mg/kg)能够明显降低模型小鼠视网膜组织中的伊文思蓝渗漏量(P<0.001)。
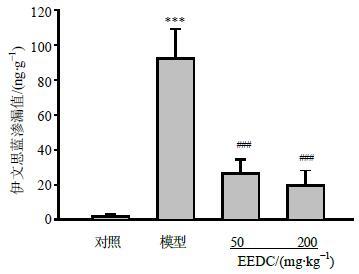
|
图 2 各组小鼠视网膜伊文思蓝渗漏量比较 (x±s,n = 6) Fig.2 Comparison on Evans blue leakage assay in retina of mice in each group (x±s,n = 6) |
3.3 对小鼠视网膜组织相关基因表达的影响
从图 3可见,模型组小鼠视网膜中IL-1β、IL-6、TNF-α的表达显著增加,而给予EEDC干预后可以显著降低各基因表达,且高剂量作用显著。模型组小鼠视网膜中Egr-1及受其调控的下游TF、Serpine 1基因表达均显著增加,而EEDC能够降低各基因表达,且高剂量作用显著。
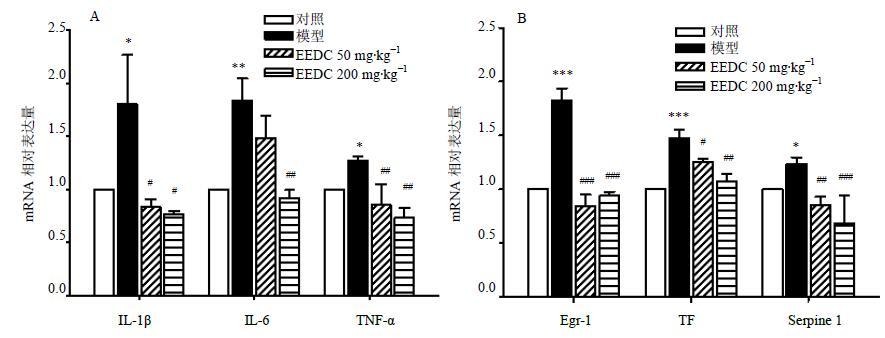
|
图 3 EEDC对小鼠视网膜组织炎症 (A) 和凝血/止血 (B) 相关基因表达的影响 (x±s,n = 6) Fig.3 Effect of EEDC on mRNA expression of related gene of inflammation (A) and coagulation/hemostasis (B) in retinal tissue of mice (x±s,n = 6) |
3.4 对小鼠血清中相关细胞因子水平的影响
从图 4可见,模型组小鼠血清中IL-1β、IL-6、TNF-α的量显著增加(P<0.001),EEDC可以降低血清中IL-1β、IL-6、TNF-α的量(P<0.001),且高剂量作用显著。模型组血清中TF、Serpine 1的量显著增加(P<0.001),EEDC亦能够降低血清中TF、Serpine 1的量(P<0.001),且高剂量作用显著。
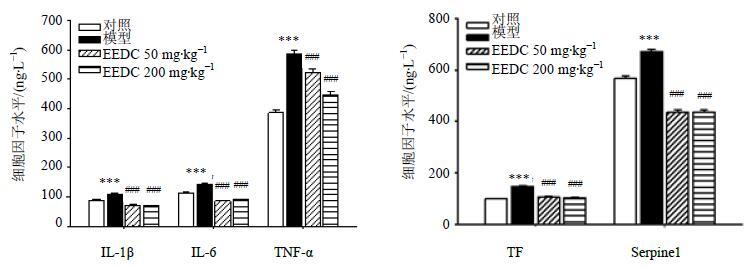
|
图 4 EEDC对小鼠血清中IL-1β、IL-6、TNF-α、TF和Serpine 1水平的影响 (x±s,n = 6) Fig.4 Effect of EEDC on levels of IL-1β,IL-6,TNF-α,TF,and Serpine 1 in serum of mice (x±s,n = 6) |
4 讨论
本实验中,血糖与体质量数据均表明STZ诱导小鼠1型糖尿病模型成功,而EEDC给药后未见对糖尿病小鼠血糖和体质量产生明显影响。糖尿病2月龄时小鼠视网膜中伊文思蓝的渗漏量升高显著,是对照组的90倍左右,说明糖尿病小鼠BRB的完整性被显著破坏,而EEDC可以明显降低NPDR小鼠视网膜中升高的伊文思蓝渗漏量,显示出保护NPDR小鼠BRB的活性。
DR发病过程中炎性因子水平升高与BRB破坏有密切联系[11-12]。通过分别检测视网膜组织和血清中IL-1β、IL-6、TNF-α的表达水平可知,NPDR小鼠视网膜组织和血清中IL-1β、IL-6、TNF-α的表达均明显上调,而EEDC均能显著逆转此过程,并可见剂量依赖性。提示EEDC改善NPDR小鼠BRB的破坏与其降低IL-1β、IL-6、TNF-α等促炎因子的表达有关。
Egr-1是近来受到较多关注的一种核转录因子,参与调控细胞的生长、分化和凋亡[13-14]。有报道称,Egr-1可参与调控DR病理过程中炎性反应、血管新生和纤维化等过程[15]。受Egr-1启动转录的细胞因子包括TF和Serpine 1,两者都参与生理凝血/止血过程。正常情况下,TF位于血管壁外膜细胞,包绕血管的成纤维细胞,当血管壁的完整性遭到破坏时TF暴露于循环血液,通过激活凝固级联反应发挥止血作用;Serpine 1又称PAI-1(plasminogen activator inhibitor 1),是tPA(tissue plasminogen activator)的抑制因子,在血液纤溶平衡中起重要作用;两者都参与调控细胞外基质的降解和血管新生的过程[16-17]。据报道,DR发病过程中TF、Serpine 1的表达明显升高[18-20]。本实验结果显示,NPDR小鼠视网膜组织Egr-1、TF、Serpine 1 mRNA表达及血清中TF、Serpine 1量均明显升高,给予EEDC干预后均能降低其表达。提示EEDC改善NPDR的作用可能与其抑制Egr-1、TF、Serpine 1表达水平有关。
综上,本研究发现EEDC对STZ诱导的NPDR小鼠视网膜BRB损坏有明显的改善作用;进一步研究其机制发现,EEDC通过降低NPDR过程中炎性因子IL-1β、IL-6、TNF-α水平,而且还可以降低Egr-1以及其下游调控的凝血/止血相关基因TF、Serpine 1基因的表达,从而缓解视网膜BRB的破坏,发挥其改善NPDR的活性。
| [1] | Chan J C, Cho N H, Tajima N, et al. Diabetes in the Western Pacific Region——past, present and future[J]. Diabetes Res Clin Pract, 2014, 103 (2) :244–255 . |
| [2] | Frank R N. Diabetic retinopathy[J]. N Engl J Med, 2004, 350 (1) :48–58 . |
| [3] | Zhang C, Wang H, Nie J, et al. Protective factors in diabetic retinopathy: focus on blood-retinal barrier[J]. Discov Med, 2014, 18 (98) :105–112 . |
| [4] | Reis A, Mateus C, Melo P, et al. Neuroretinal dysfunction with intact blood-retinal barrier and absent vasculopathy in type 1 diabetes[J]. Diabetes, 2014, 63 (11) :3926–3937 . |
| [5] | Frey T, Antonetti D A. Alterations to the blood-retinal barrier in diabetes: cytokines and reactive oxygen species[J]. Antioxid Redox Signal, 2011, 15 (5) :1271–1284 . |
| [6] | 张光浓, 毕志明, 王峥涛, 等. 石斛属植物化学成分研究进展[J]. 中草药, 2003,34 (6) :附5–附8. |
| [7] | 陈晓梅, 郭顺星. 石斛属植物化学成分和药理作用的研究进展[J]. 天然产物研究与开发, 2001,13 (1) :70–75. |
| [8] | 张利华. 石斛的现代药理学进展[J]. 内蒙古中医药, 2014,33 (5) :50–51. |
| [9] | 宋广青, 刘新民, 王琼, 等. 石斛药理作用研究进展[J]. 中草药, 2014,45 (17) :2576–2581. |
| [10] | Gong C Y, Yu Z Y, Lu B, et al. Ethanol extract of Dendrobium chrysotoxum Lindl ameliorates diabetic retinopathy and its mechanism[J]. Vascul Pharmacol, 2014, 62 (3) :134–142 . |
| [11] | Adamis, A P, Berman A J. Immunological mechanisms in the pathogenesis of diabetic retinopathy[J]. Semin Immunopathol, 2008, 30 (2) :65–84 . |
| [12] | Bertoni A G, Burke G L, Owusu J A, et al. Inflammation and the incidence of type 2 diabetes: the Multi-Ethnic Study of Atherosclerosis (MESA)[J]. Diabetes Care, 2010, 33 (4) :804–810 . |
| [13] | Gashler A, Sukhatme V P. Early growth response protein 1(Egr-1): prototype of a zinc finger family of transcription factors[J]. Prog Nucl Acid Res Mol Biol, 1995, 50 :191–224 . |
| [14] | Liu C, Calogero A, Ragona G, et al. EGR-1, the reluctant suppression factor: EGR-1 is known to function in the regulation of growth, differentiation, and also has significant tumor suppressor activity and a mechanism involving the induction of TGF-beta1 is postulated to account for this suppressor activity[J]. Crit Rev Oncog, 1996, 7 (1/2) :101–125 . |
| [15] | Aljada A, Ghanim H, Mohanty P, et al. Insulin inhibits the pro-inflammatory transcription factor early growth response gene-1(Egr)-1 expression in mononuclear cells (MNC) and reduces plasma tissue factor (TF) and plasminogen activator inhibitor-1(PAI-1) concentrations 17[J]. J Clin Endocrinol Metab, 2002, 87 (3) :1419–1422 . |
| [16] | Fernandez P M, Rickles F R. Tissue factor and angiogenesis in cancer[J]. Curr Opin Hematol, 2002, 9 (5) :401–406 . |
| [17] | Carmeliet P, Stassen J M, Schoonjans L, et al. Plasminogen activator inhibitor-1 gene-deficient mice. II. Effects on hemostasis, thrombosis, and thrombolysis[J]. J Clin Invest, 1993, 92 (6) :2756–2760 . |
| [18] | Sakamoto T, Ito S, Yoshikawa H, et al. Tissue factor increases in the aqueous humor of proliferative diabetic retinopathy[J]. Graefes Arch Clin Exp Ophthalmol, 2001, 239 (11) :865–871 . |
| [19] | Zhong Z L, Chen S. Plasma plasminogen activator inhibitor-1 is associated with end-stage proliferative diabetic retinopathy in the northern Chinese Han population[J]. Exp Diabetes Res, 2012 . doi:10.1155/2012/350852 |
| [20] | Grant M B, Ellis E A, Caballero S, et al. Plasminogen activator inhibitor-1 overexpression in nonproliferative diabetic retinopathy[J]. Exp Eye Res, 1996, 63 (3) :233–244 . |
 2016, Vol. 47
2016, Vol. 47


