2. 江苏省中药药效与安全性评价重点实验室, 江苏 南京 210023
2. Jiangsu Key Laboratory for Pharmacology and Safety Evaluation of Chinese Materia Medica, Nanjing 210023, China
马兜铃酸Ⅰ(aristolochic acid Ⅰ,AAI)是马兜铃酸(aristolochic acid,AA)的主要毒性成分,长期服用含此类物质的中药可导致马兜铃酸肾病(aristolochic acid nephropathy,AAN)的发生[1-2],很多国家现已采取相应政策来管理含此类成分的中药,但仍有部分群体不恰当的服用含AA的中药,AAN病例还时有发生,阐明AAI致肾毒性的发病机制仍具有重要意义。
Micro RNAs(miRNAs)是一类在生物体内广泛存在的长度约22 nt的小分子非编码RNA,它可以通过与靶基因mRNA的靶位点结合,抑制蛋白的合成或诱导该基因mRNA的降解,从而参与基因的表达调控[3]。目前miRNAs功能涉及到生物体的干细胞分化、分子免疫机制、细胞内信号转导、肿瘤发生及各种疾病和病毒感染等[4-6]。已有研究显示,miRNAs与AA的基因毒性[7]、肾近曲小管上皮细胞的周期阻滞[8]等过程密切相关。本课题组前期研究发现大鼠给予AAI 2.25 mg/kg剂量条件下,肾脏就已出现明显的病变[9]。本研究将采用miRNAs芯片法筛选出AAI致大鼠肾损伤后血清中表达明显发生变化的miRNAs,并预测相关靶基因,对部分miRNAs进行信号通路分析,从分子水平探讨AAN的发病机制。
1 材料 1.1 动物8 周龄SD大鼠18只,清洁级,体质量220~250 g。合格证号SCXK(浙)2008-0033,购自浙江省实验动物中心。分笼饲养,周围环境通风,温度22~25 ℃、湿度50%~60%,动物实验操作严格按照《江苏省实验动物管理办法》规定执行。
1.2 药品与试剂AAI(质量分数≥98%,批号20130201),河南省科技医药研究所;Trizol试剂(美国Life Technologies公司);氯仿(成都科龙化工试剂厂);异丙醇(南京化学试剂有限公司);DEPC水(上海碧云天生物技术研究所);逆转录试剂盒(上海生工生物工程有限公司);PolyAcryl Carrier(美国MRC公司);Quanti Fast SYBR Green PCR kit(德国Qiagen公司);所有引物由上海生工生物工程有限公司提供。
1.3 主要仪器荧光定量PCR仪(美国Bio-rad公司);梯度PCR仪(美国Applied Biosysterms公司);多功能酶标仪(美国BioTek公司);低温离心机(德国Eppendorf);石蜡包埋机(日本樱花Tissue-TEK);切片机(美国Thermo公司)。
2 方法 2.1 肾损伤模型的制备18 只大鼠随机分为对照组(10%二甲基亚砜+20%聚乙二醇600+70%生理盐水)和AAI组(2.25 mg/kg)[10]。大鼠于笼中适应性喂养3 d,自由进水,连续ip给药14 d,末次给药后禁食不禁水12 h,颈总动脉取全血6 mL,3 000 r/min离心后取血清,冻存备用;处死大鼠,迅速摘除肾脏,用PBS漂洗后,一侧肾脏放入10%甲醛中固定,用于病理检查分析,另一侧肾脏于液氮中保存,用于其他检测。
2.2 病理组织固定、切片及HE染色取肾组织,切成小块浸泡在4%中性甲醛溶液中3 d;用蒸馏水洗涤组织块后放入70%乙醇中过夜;经脱水、透明、石蜡包埋、切片后,用多聚赖氨酸封片于玻璃载玻片上,进行苏木素伊红(HE)染色,光镜下观察AAI对大鼠肾组织损伤的情况。
2.3 总RNA的提取和芯片检测对照组及AAI组各随机取3例样本的大鼠血清,采用Trizol法提取总RNA,其样本采用琼脂糖凝胶电泳进行质控分析,分光光度法进行定量分析。分离出的miRNAs,基于μParaflorTM微流体miRNAs检测探针进行实验。取RNA样品5~8 μg,进行靶标制备,在总RNA3’端用Poly A聚合酶加上poly A尾,并用于荧光标记。杂交反应在μParaflo微流体芯片上过夜进行。RNA与相应探针杂交后,与标记特异性结合的Hy3染料在微流体芯片上循环流动进行染色。利用激光扫描仪(Axon GenePix 4000B,Molecular Device)采集杂交图像,并使用GenePix Pro 6.0图像分析软件进行图像数字化转换,并使用LOWESS过滤进行信号归一化。计算两种检测信号的比值和t检验的P值,以P<0.05为差异有统计学意义,比值>1.5为显著表达差异。整个杂交和分析实验由上海康成生物公司完成,合同编号H1311169。
2.4 靶基因预测根据microRNA生物信息学数据库miRBase(http://www.mirbase.org/)、miRDB(http://mirdb.org/ miRDB/)、miRanda(http://www.microrna.org- microrna/home.do)对miRNAs芯片中5个表达有明显差异的miRNAs进行检索,将结果导出并比对,将3个数据库中共有的基因作为核心靶基因。
2.5 miRNAs的qRT-PCR验证miRNAs的反转录体系为20 μL,其中2×miRNA RT Solution mix 10 μL,miRNA RT Enzyme mix 2 μL,Total RNA/micro RNA 2 μg/100 ng,RNase-free water。反转录程序:37 ℃、60 min,85 ℃、5 min,4 ℃速冷。qRT-PCR反应体系20 μL,其中1 μL模板(逆转录产物),2 μL引物混合物(10 μmol/L),10 μL 2×SYBR green,7 μL水。反应条件:95 ℃、5 min,95 ℃、30 s,60 ℃、30 s,40个循环。以U6为内参基因,以2−ΔΔCt(Ct值代表循环阈值)表示基因的表达量,部分引物序列见表 1。
|
|
表 1 用于miRNAs real-time PCR的部分引物 Table 1 Primers used to perform real-time PCR of miRNAs |
2.6 部分miRNAs的信号通路分析
根据KEGG(Kyoto Encyclopedia of Gene and Genomes)数据库(http://www.genome.jp/kegg/),对芯片检测出的miRNAs靶基因进行信号通路显著性分析。分析结果采用Fisher精确检验和卡方检验进行统计,P<0.05,FDR<0.05则认为差异具有统计学意义。
2.7 统计分析采用GraphPad Prism 6软件进行相关统计分析,组间数据采用单因素方差分析,数据以x±s表示。
3 结果 3.1 AAI致大鼠肾损伤的病理变化连续给药14 d后,取大鼠肾脏进行HE染色,光学显微镜下观察其病理改变。对照组大鼠肾脏肾小管未见水肿,间质血管未见充血和炎细胞浸润,肾皮质内肾小球未见充血,肾小球无硬化现象;AAI组肾脏肾小管上皮细胞轻度水样变性,间质血管轻度充血,偶见炎细胞浸润现象,已出现明显病变。结果见图 1。本课题组前期研究[9]显示,2.25 mg/kg AAI连续ip给药14 d后,大鼠血清中肌酐(Cr)、尿素氮(BUN)水平明显升高(P<0.05);结合本实验结果说明2.25 mg/kg AAI可造成大鼠肾损伤。
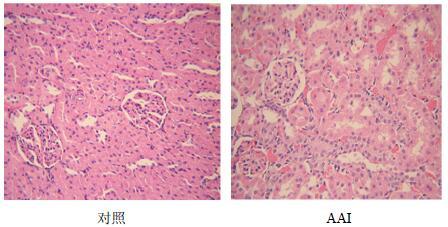
|
图 1 AAI给药14 d后大鼠肾脏组织病理变化 Fig.1 Pathological changes in kidney tissue of rats after 14 d of AAI administration |
3.2 miRNAs芯片检测结果
AAI致大鼠肾损伤后,利用miRNAs芯片对对照组和AAI组大鼠血清进行检测,与对照组血清相比,miRNAs芯片筛选出5个差异表达明显上调的miRNAs,分别是miR-10a-3p、miR-207、miR-3594-3p、miR-874-3p、miR-9a-3p,表达变化见图 2;此次芯片检测中无显著下调的miRNAs。
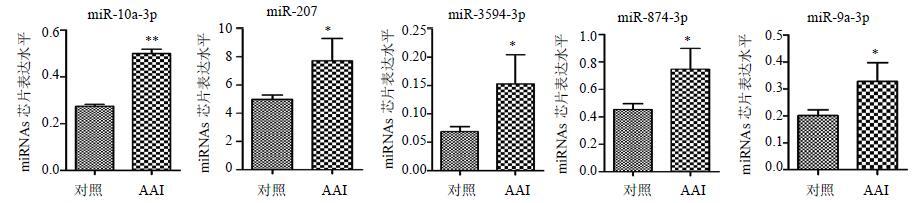
|
图 2 大鼠血清中差异表达显著上调的miRNAs Fig.2 miRNAs with significant up-regulation of differential expression in serum of rats |
3.3 qRT-PCR验证
以U6为内参对芯片筛选出的差异表达的miRNAs进行qRT-PCR验证,记录Ct值,使用2−ΔΔCt法计算结果并统计,结果显示与对照组相比,miR-10a-3p、miR-207、miR-3594-3p表达均明显上调,miR-874-3p、miR-9a-3p表达呈升高趋势,如图 3所示,说明qRT-PCR结果与miRNAs芯片结果基本一致,本研究的芯片结果基本真实可靠。
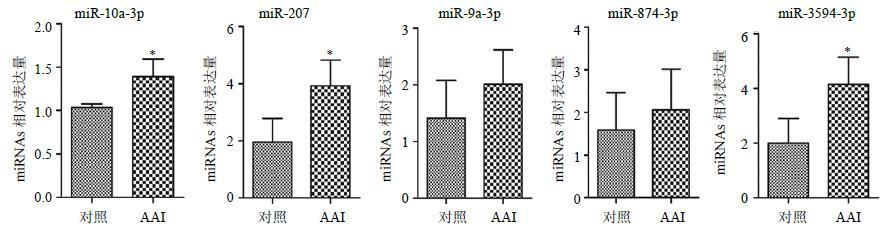
|
图 3 各miRNA的qRT-PCR检测结果 Fig.3 Determination of qRT-PCR in each miRNA |
3.4 靶基因预测结果
对芯片筛选出的差异表达的5个miRNAs,通过miRBase、miRDB、miRanda 3种靶基因预测数据库预测该5种miRNAs的靶基因,选出在3种数据库中出现的基因作为潜在靶基因,结果见表 2。
|
|
表 2 miRNAs的靶基因预测 Table 2 Target gene prediction of miRNAs |
3.5 miRNAs的信号通路分析
根据预测出的靶基因,对其进行信号通路分析,AAI组大鼠与对照组相比较,差异miRNAs参与了多个信号通路的调节,富集度较高的为过氧化物酶体(rno04146)、MAPK信号通路(rno04010)、多巴胺能突触(rno04728)、黏蛋白型-O-多糖生物合成(rno00512)、酮体的合成与降解(rno00072)等途径,见图 4。
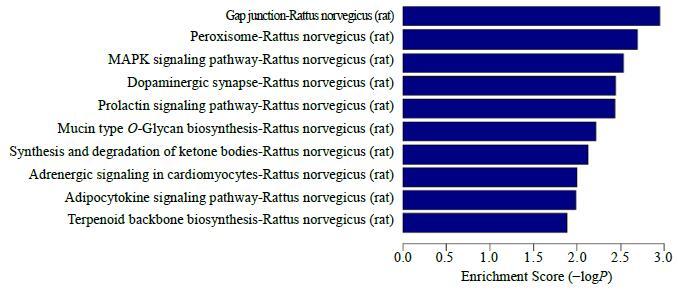
|
图 4 miRNA的Pathway分析 (部分) Fig.4 Pathway analysis of miRNA (part) |
4 讨论
AA具有广泛的药理作用,具有抗感染、镇痛、利尿、抗生育活性、抗肿瘤及调节血压等功效[11-12],尽管AA可诱发AAN,引起了世人的警觉,但由于不合理的用药使得AAN事件时有发生,增强人们对AAN的认识和提高AAN的可治愈性仍是解决此类事件的关键。
近年来,miRNAs的功能研究越来越受到人们的重视,动物源miRNAs主要是通过与靶基因mRNA的3’端非编码区域(3’UTR)不完全或完全互配对结合,在翻译水平上特异性抑制基因的表达。miRNAs功能研究的关键在于其调控靶基因的确定,但由于miRNAs和靶基因的作用位点并不完全匹配,一个mRNA能被很多miRNAs调控,形成一个十分复杂的转录后调控网络,导致应用传统方法鉴定靶基因十分困难。miRNAs芯片技术能在特定的时间点筛选出不同样本间的差异miRNAs表达情况,是一种新型的高通量筛选技术,已在很多复杂性疾病的研究中进行探索并得到广泛的应用,如microRNA-206与乳腺癌的发病、转移密切相关[13-14],在AAN研究方面,已有研究显示,miRNAs与AA的基因毒性[7]、肾近曲小管上皮细胞的周期阻滞[8]等过程密切相关,但miRNAs在AA或AAI诱导的肾毒性疾病中其他发病过程的相关研究还未见报道。
本研究利用基因微阵列分析技术探索AAI对大鼠肾脏造成损伤后血清中miRNAs表达谱的影响,发现miR-10a-3p、miR-207、miR-3594-3p、miR-874-3p、miR-9a-3p等5个miRNAs表达明显上调,无明显下调的miRNAs;利用qRT-PCR技术对芯片结果进行检验,该结果与miRNAs芯片结果基本一致,增加了本研究的可靠性,发生明显改变的miRNAs在AAI致大鼠肾损伤过程中的具体功能还有待研究。本课题组对差异表达miRNAs的靶基因进行预测及信号通路分析,寻找到Rhebl1、Usp10等多个潜在靶基因,并发现AAI致肾损伤与过氧化物酶体途径、MAPK信号通路途径等有很大关系,信号通路分析结果为AAN机制的深入研究提供了新方向的借鉴和理论基础,针对该结果,本课题组将对此次miRNAs芯片结果的生物信息学进行深入研究和验证,并做出充分的阐述。
通过以上研究,本课题组已初步找到一些可能与AAI致肾损伤相关的miRNAs和潜在靶基因,及相应的生物途径,这将为进一步阐明AAN的发病机制提供新的线索,为其预防、诊断和治疗提供新的依据。
| [1] | Cosyns J P. When is "aristolochic acid nephropathy" more accurate than "Chinese herbs nephropathy"?[J]. Kidney Int, 2002, 61 :1178. |
| [2] | Shibutani S, Dong H, Suzuki N, et al. Selective toxicity of aristolochic acids I and II[J]. Drug Metab Dispos, 2007, 35 :1217–1222 . |
| [3] | Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116 (2) :281–297 . |
| [4] | 陈青云, 王青青. microRNA对免疫系统发育和应答的调节作用[J]. 浙江大学学报: 医学版, 2010,39 (3) :326–332. |
| [5] | Ambros V. microRNAs与疾病和发育[J]. 生命科学, 2010, 22 (3) :229–233 . |
| [6] | 吴家昌, 马琼, 邹贤飞, 等. miRNA与细胞分化的研究进展[J]. 现代生物医学进展, 2010,10 (3) :567–572. |
| [7] | Meng F, Li Z, Yan J, et al. Tissue-specific microRNA responses in rats treated with mutagenic and carcinogenic doses of aristolochic acid[J]. Mutagenesis, 2014, 29 (5) :357–365 . |
| [8] | Jenkins R H, Davies L C, Taylor P R, et al. miR-192 induces G2/M growth arrest in aristolochic acid nephropathy[J]. Am J Pathol, 2014, 184 (4) :996–1009 . |
| [9] | 杨召聪, 陆茵, 顾亚琴, 等. 马兜铃酸Ⅰ对大鼠体内PI3K/AKT/NF-κB通路的影响[J]. 南京中医药大学学报, 2015,31 (3) :250–253. |
| [10] | 张良, 李霁, 江振洲, 等. 马兜铃酸Ⅰ和马兜铃内酰胺I对大鼠肾小管损伤机制及其对肾脏水通道蛋白1表达的影响[J]. 中药新药与临床药理, 2011,22 (4) :359–364. |
| [11] | 陈孟兰, 朱正兰. 马兜铃属植物的药理作用研究进展[J]. 武汉生物工程学院学报, 2007,3 (1) :59–62. |
| [12] | 王潇晗, 张连学, 郜玉钢, 等. 含马兜铃酸中药减毒的研究进展[J]. 中草药, 2013,44 (22) :3241–3244. |
| [13] | Negrini M, Calin G A. Breast cancer metastasis: a microRNA story[J]. Breast Cancer Res, 2008, 10 (2) :203. |
| [14] | Rao P K, Kumar R M, Farkhondeh M, et al. Myogenic factors that regulate expression of muscle-specific microRNAs[J]. Proc Natl Acad Sci USA, 2006, 103 (23) :8721–8726 . |
 2016, Vol. 47
2016, Vol. 47

