2. 广东海洋大学 现代生物化学中心, 广东 湛江 524088
2. Center of Modern Biochemistry of Guangdong Ocean University, Zhanjiang 524088, China
心脑血管疾病已成为我国发病率、致死率最高的疾病,其中大部分疾病与血栓相关[1]。血管内血栓形成的主要因素是凝血酶诱发的血液凝固[2]。凝血酶分子表面有一个富含碱性氨基酸的活性部位(fibrinogen recognition site,FRS),能特异性与纤维蛋白原结合并将其裂解成为纤维蛋白导致血液凝固[3]。天然水蛭素是从吸血水蛭唾液腺中分离出来的多肽[4],C端为活性部位,含较多酸性氨基酸,具有强烈的抗凝血酶活力,对防治多种血栓性疾病以及溶解术后形成的血栓都有较好效果[5-6],国内外试图将其开发成新一代高效特异性抗凝、溶栓药物[1]。水蛭素C端与凝血酶分子FRS在一定pH条件下按1∶1结合,形成凝血酶-水蛭素复合物,抑制了凝血酶对纤维蛋白原的激活作用,避免了血液的凝固。根据该原理,利用凝血酶滴定改进法[7]可以水蛭素标准液测定凝血酶的浓度,从消耗的水蛭素量得知凝血酶的量;或者以凝血酶标准液测定水蛭素的浓度,根据消耗的凝血酶量得知水蛭素的量。
固定化酶在保持高效专一及温和的催化特性的同时,又呈现稳定性高、分离回收容易、可多次重复使用等一系列优点[8]。本实验采用脱胶家蚕丝素为载体、戊二醛为交联剂制备固定化凝血酶(immobilization of thrombin,IT)。
天然水蛭素的来源有限制约了其广泛使用。研究发现,酪蛋白分子中含有若干具有抗凝血酶活性的肽段[抗凝血肽(anticoagulant peptide,AP)、抗血栓肽][9-10],在合适的工艺条件下水解酪蛋白,可获得功能与水蛭素类似的AP。研究发现,六肽及以下的小肽能被肠道直接吸收[11]。为了获得可以被肠道直接吸收的AP,本实验以酪蛋白为原料进行AP的制备、分离实验。过程先以木瓜蛋白酶、菠萝蛋白酶、中性蛋白酶和碱性蛋白酶进行4酶混合水解,使酪蛋白中富含酸性氨基酸、能与FRS特异性结合的AP释放出来,然后用IT进行分离、纯化。在一定pH条件下用IT萃取水解物,AP与FRS通过离子键特异性结合,形成IT-AP复合物,弃去液相收集复合物。在反萃取时,调节溶液pH改变FRS或AP的带电状态,使IT与AP之间的离子键断裂,复合物解体,AP重新释放回滤液相,分离回收IT得AP。通过凝血酶滴定改进法以凝血酶标准液测定AP的浓度,通过体外抗凝血、溶血栓实验,初步评价其活性的强弱,利用高效体积排阻色谱(HPSEC)法测定AP的相对分子质量(Mr)分布范围。利用固定化凝血酶来分离纯化抗凝血肽目前国内外很少报道。本实验旨在为开发以酪蛋白作为原料的防治血栓性疾病的口服小肽类药物或功能性食品提供理论及实验依据。
1 仪器与材料凝血酶对照品,长春国奥药业有限公司,批号110526-3,500 NIH/瓶;质量分数25%戊二醛(分析纯)、酪蛋白(化学纯),国药集团试剂有限公司;木瓜蛋白酶(Pa)4×105 U/g、菠萝蛋白酶(Br)5×105 U/g、中性蛋白酶(NP)2×105 U/g、碱性蛋白酶(AP)4×105 U/g,广西庞博公司,食品级;牛血纤维蛋白原,美国Biosharp公司,进口分装;水蛭素对照品,广西科康公司,批号110617,电泳纯;磷酸异构酶(triosephosphate-isomerase,Mr:26 625)、肌球蛋白(myoglobin,Mr:16 950)、抑肽酶(aprotinin,Mr:6 512)、胰岛素B(insulin-B,Mr:3 496)、杆菌肽(bacitracin,Mr:1 423)、马尿酰-组氨酰-亮氨酸(N-Hippuryl-His-Leu hydrate,Mr:433),上海阳光试剂有限公司,色谱纯;其他试剂均购自国药集团试剂公司;茧壳,广东省高州市丝绸公司提供。
实验采血用的新西兰兔体质量2 450 g,雌性,购自湛江双林药业有限公司实验动物中心。
VirTis Benchtop V2K冷冻干燥机,美国VirTis公司;LC-20A高效液相色谱仪,日本岛津公司;CR22G高速冷冻离心机,HITACHI公司;TU-1901双光束紫外可见光分光光度计,北京普析通用仪器公司;PHS-2F pH计,上海雷磁新泾仪器有限公司;EL200电子天平,日本岛津公司;JB-2恒温磁力搅拌器,金坛市富华仪器有限公司;三用电热恒温水箱,北京长安科学仪器厂;F100数码照相机,日本富士公司。
2 方法与结果 2.1 检测与分析方法 2.1.1 水蛭素浓度测定及标准溶液的制备水蛭素浓度用单位体积溶液中抗凝血酶活力单位(ATU)数量多少(ATU/mL)表示,测定方法为凝血酶滴定改进法[7]。取一定量水蛭素对照品用适量pH 5.0生理盐水溶解,配成浓度为20 ATU/mL的滴定液,即为水蛭素标准溶液。
2.1.2 凝血酶标准溶液的制备凝血酶浓度用单位体积溶液中凝血酶活力单位(NIH)数量多少(NIH/mL)表示。取一定量凝血酶对照品用适量pH 5.0生理盐水溶解,配成浓度20 NIH/mL的滴定液,即为凝血酶标准溶液。
2.1.3 凝血酶溶液的活力测定及溶液系列的制备本实验的凝血酶浓度测定以水蛭素标准溶液参照凝血酶滴定改进法进行[7]。取一定量凝血酶对照品用合适pH值生理盐水溶解,配制成不同pH值、不同浓度的凝血酶溶液系列,备用。
2.1.4 脱胶丝素的制备与交联(活化)茧壳剪碎称取一定质量,参考文献方法[12]制成活化丝素(载体)。
2.1.5 IT的制备[13] 取载体适量按1∶400的量加入一定浓度的凝血酶溶液,于不同pH值、不同温度下固定不同时间,以确定制备IT的工艺条件。过滤收集IT,用0.2 mol/L pH 7.6磷酸缓冲液(含0.5 mol/L NaCl)洗至洗脱液于280 nm波长处无吸收,吸干,于50 ℃烘干,备用。
实验确定的IT制备工艺条件为凝血酶起始浓度6 NIH/mL、pH 7.6、30 ℃固定6 h。凝血酶起始浓度高于6 NIH/mL,酶分子数量远超载体中的活化基团数量,被固定的酶比例低而造成浪费;pH值偏离7.6,凝血酶分子及载体中活化基团的解离状况不利于酶分子的固定;固定温度30 ℃时间6 h,被固定的酶比例达到最大,无须再提高温度和延长时间。
2.1.6 4种蛋白酶的最适水解条件确定Pa、Br、NP、AP 4种蛋白酶分别在一定条件进行酪蛋白溶液水解的单因素实验,以确定各自的最适温度、pH值、水解时间、酶用量、底物浓度(质量分数),为4酶混合水解提供依据。
单因素实验结果表明,各酶的最适水解条件为Pa:温度50 ℃、pH 6.8、底物浓度6%、每克酪蛋白的酶用量5 000 U、时间4 h;Br:温度55 ℃、pH 7.0、底物浓度4%、每克酪蛋白的酶用量12 000 U、时间3.5 h;NP:温度50 ℃、pH 7.0、底物浓度5%、每克酪蛋白的酶用量4 000 U、时间3 h;AP:温度50 ℃、pH 8.0、底物浓度5%、每克酪蛋白的酶用量5 000 U、时间4 h。
2.1.7 酪蛋白溶液的4酶混合水解混合酶水解是指若干种酶按一定比例混合均匀后,在一定的温度、pH等条件下水解底物一定时间,以获得所需物质的过程。
为了获得能被直接吸收的小分子AP,本实验利用4种蛋白酶进行酪蛋白水解。如果采用复合酶水解法则工艺过于复杂,水解时间过长。为了简化实验,本实验选择了混合酶水解法处理底物。
4 种酶的最适底物浓度之和为20%,该浓度的酪蛋白溶液黏度大难以搅拌,影响水解效果。预试验结果表明,底物浓度之和15%时效果较好,因此将底物浓度之和降至15%。AP的最适pH值为8.0,其余3种酶为中性或接近中性,水解pH值选择7.0时虽然AP活力受到一定影响,但较适合其余3种酶,总体效果较佳;Br的最适水解温度为55 ℃,另外3种酶均为50 ℃,温度选择50 ℃对水解的总体效果较有利;Pa、AP的水解时间均为4 h,而Br、NP的分别为3.5 h和3.0 h,为了确保各种酶的水解效果而又不浪费时间,水解时间选择4 h。综合考虑,混合酶水解条件组合为底物浓度之和15%,pH 7.0、温度50 ℃、水解时间4 h,每克酪蛋白的加酶量Pa 1 500 U、Br 2 400 U、NP 1 000 U、AP1 250 U。
酪蛋白溶液按上述条件水解后,迅速升温至100 ℃保持10 min,放冷至室温后,于4 ℃,15 000 r/min离心20 min,取上清液,即得含AP的酪蛋白混合酶水解液。测得活力为260 ATU/mL。
2.1.8 混合酶水解物的抗凝血酶活力测定混合酶水解物的活力用ATU表示,测定方法为凝血酶滴定改进法[7]。
2.2 AP的IT萃取的指标考察萃取是通过调节酪蛋白混合酶水解液至一定pH值,使FRS带正电荷的同时AP带负电荷,电性相反基团之间在静电引力作用下形成离子键,将AP结合在IT上面,形成IT-AP复合物,使之与其他成分分离的过程。
将酪蛋白溶液的混合酶水解物用蒸馏水稀释成一定浓度,在一定条件下进行AP的IT萃取实验,测定萃取后液体部分的ATU,计算ATU萃取率。
ATU萃取率=(萃取前溶液中抗凝血肽总ATU-萃取后溶液中抗凝血肽总ATU)/萃取前溶液中抗凝血肽总ATU每个实验取IT 0.10 g,AP溶液40 mL分别观察温度、pH、时间、AP浓度的影响。萃取完毕,滤过,收集IT-AP复合物。
2.2.1 温度对萃取的影响实验在AP浓度8 ATU/mL、pH 5.3,温度20、25、30、35、40 ℃下分别萃取40 min。反应结束后测定液相的ATU并计算活力回收率,确定最适温度。
不同温度对萃取的影响结果分别为回收率43.33%、57.92%、66.25%、65.83%、66.25%。温度低于30 ℃时,萃取率随温度升高而增加,30 ℃达到最大,再升高温度萃取率也不会再增加。估计是温度低于30 ℃,随温度升高AP分子获得的能量相应增加,成为活化分子的数量相应增加,生成的IT-AP复合物数量也越多,萃取率随之增加。温度达到30 ℃时,成为活化分子的AP数量达到最大、足以与全部IT的FRS结合,萃取率达到最高。此后尽管升高温度,因体系中已无游离的FRS,复合物数量不会再增加。温度选择30 ℃合适。
2.2.2 pH值对萃取的影响AP浓度8 ATU/mL、pH值分别为4.4、4.7、5.0、5.3、5.6,以“2.2.1”项确定的最适温度分别进行实验,萃取结束后测定液相的ATU并计算回收率,确定最适pH值。
不同pH值对萃取的影响结果分别为回收率17.5%、44.17%、65.42%、50.83%、32.5%。pH值低于5.0,萃取率随pH值升高而增加,pH 5.0时达到最大,pH值高于5.0,随pH值升高而降低。原因是pH值影响FRS碱性基团和AP的酸性基团解离,只有处于某一pH值条件下,FRS带正电荷的基团数量与AP带负电荷的基团数量均达到最大,二者结合形成IT-AP复合物数量达到最多,萃取率达到最高。偏离该pH值,FRS与AP双方或某一方的解离受到影响,带电荷的基团数量减少,形成的复合物数量减少,萃取率下降。本实验萃取pH值选择5.0。
2.2.3 时间对萃取的影响AP浓度8 ATU/mL,采用上述实验确定的最适温度和pH值,分别萃取20、25、30、35、40 min。反应结束后测定液相的ATU并计算回收率,确定最适萃取时间。
时间对萃取的影响结果分别为回收率46.67%、59.17%、65.00%、64.58%、64.58%。萃取时间过短,与IT结合的AP不多,萃取率自然不高。只有达到足够的时间,IT与AP充分结合,萃取率才会达到最高。因为IT与AP的结合属于可逆反应,存在一个平衡点。到达平衡点前,反应随时间增加向IT-AP复合物生成方向移动,萃取率相应增加。到达平衡点时复合物浓度达到最大,萃取率达到最高。之后再延长萃取时间,复合物生成量也不会增加。萃取时间应为30 min。
2.2.4 AP浓度对萃取的影响采用上述实验确定的最适温度、pH值、时间,分别对4、5、6、7、8 ATU/mL溶液萃取。反应结束后测定液相的ATU并计算回收率,确定最适AP浓度。
AP浓度对萃取的影响结果分别为回收率54.58%、58.75%、64.17%、65.00%、64.17%。在萃取体系中,IT-AP复合物的生成与分解处于动态平衡,该平衡的移动方向与AP及复合物浓度有密切关系。反应开始复合物浓度为0 ATU/mL,平衡朝正反应方向移动;AP浓度低形成的复合物浓度低,萃取率也低;AP浓度增加复合物的浓度相应提高,虽然此时后者分解生成IT与AP的速率相应增加,但属非主流方向;AP浓度达到一定以后,IT-AP复合物的生成与分解速率相等,萃取率达到最大;此后再提高AP浓度萃取率变化也不明显。可知AP起始浓度选择6 ATU/mL合适。
2.3 AP的IT萃取的正交试验以萃取时间(A)、AP浓度(B)、萃取温度(C)及pH值(D)进行5因素4水平正交试验,优化萃取的工艺条件。
2.3.1 正交试验操作萃取正交试验安排、各因素的影响效果见表 1,方差分析见表 2。
|
|
表 1 L16(45) 正交试验设计与结果 Table 1 Design and results of L16(45) orthogonal test |
|
|
表 2 方差分析 Table 2 Analysis of variance |
从表 1的极差分析可知,影响效果的大小顺序为A>B>D>C;表 2的方差分析结果表明,A、B、D均达到了极显著(P<0.01)水平,C达到了显著(P<0.05)水平;优选工艺条件为A3B3D3C3,即萃取时间30 min、AP浓度6 ATU/mL、pH 5.0、萃取温度30 ℃。
2.3.2 优选工艺条件的验证试验按照“2.1.5”项下制备方法,制备IT,按照正交试验优选的最佳工艺条件进行了3组抗凝血肽的萃取试验,验证优选的萃取工艺条件,进行了3组平行实验验证优选工艺条件,测定活力回收率分别为69.17%、68.75%、69.17%,平均回收率为69.03%,结果表明该优选工艺稳定。
2.4 反萃取的指标考察反萃取是通过改变溶液的pH值,破坏IT与AP之间的离子键,使AP重新溶解在溶液中的过程。反萃取以ATU回收率(反萃取率)为指标进行评价。
ATU回收率=反萃取后溶液中抗凝血肽总ATU/反萃取前溶液中抗凝血肽总ATU每个试验各取20 mL不同pH值的0.20 mol/L磷酸缓冲液,上述吸附了AP的IT于不同温度、pH值、时间进行反萃取。
2.4.1 温度对反萃取的影响在pH 7.4,温度20、25、30、35、40 ℃分别反萃取50 min。之后,分离并回收IT,测定液体ATU,计算反萃取率,确定最适温度。
温度为20、25、30、35、40 ℃对反萃取的影响结果分别为回收率45.83%、57.50%、62.50%、61.67%、62.50%。温度变化对反萃取的影响主要表现在:温度较低时IT-AP复合物获得的能力较少,分解生成IT和AP的速率低,释放出来的AP数量不多,ATU回收率低;随着温度的升高,复合物分解速度加快,释放出来的AP数量增加,ATU回收率升高;30 ℃时到达平衡点,ATU回收率达到最大;温度超过此值以后,复合物分解与结合反应继续处于平衡点,ATU回收率不再随温度的升高而增加。反萃取温度选择30 ℃合适。
2.4.2 pH值对反萃取的影响以“2.4.1”项确定的最适温度为反萃取温度,在pH 7.2、7.4、7.6、7.8、8.0分别作用50 min。反萃取后,分离并回收IT,测定液体ATU,计算反萃取率,确定最适pH值。
pH值为7.2、7.4、7.6、7.8、8.0对反萃取的影响结果分别为回收率50.83%、57.5%、60%、59.17%、59.17%。pH值影响IT-AP复合物中酸性基团及碱性基团的带电情况,从而影响离子键的形成与破坏。AP中的酸性氨基酸残基于酸性环境中不带电、碱性环境中带负电荷;IT中的碱性氨基酸残基于酸性环境中带正电荷、碱性环境中不带电。当反萃取pH值处于中性偏碱时,FRS与AP间的离子键断裂,AP重新释放回液相被反萃取;pH值继续升高,ATU回收率不断提高;pH 7.6处达到最大,因此时复合物的分解与重新生成已达到平衡点,ATU回收率达到最大;之后再提高pH值,ATU回收率也不会增加。反萃取pH值应选择7.6。
2.4.3 时间对反萃取的影响采取上述实验确定的最适温度、pH值分别反萃取30、35、40、45、50 min。完毕,分离并回收IT,测定液体ATU,计算反萃取率,确定最适时间。
时间为30、35、40、45、50 min对反萃取的影响结果分别为回收率49.17%、57.50%、62.50%、62.50%、62.50%。反萃取属动态平衡反应,需要一定时间才能达到平衡点。反应短于某一时间,IT-AP分解进入反萃取液的AP数量随时间增加而提高;到达某一时间,进入反萃取液和离开反萃取液并与IT重新结合生成IT-AP的AP数量相等、反应达到平衡点时,ATU回收率达到最大;之后,ATU回收率不因时间的增加而提高。因此反萃取时间应选择40 min。
2.5 AP的IT反萃取的正交试验以反萃取时间(A)、反萃取温度(B)及pH值(C)进行4因素3水平正交试验,优化反萃取的工艺条件。
2.5.1 正交试验设计反萃取正交试验安排、各因素的影响效果见表 3,方差分析见表 4。
|
|
表 3 L9(34) 正交试验设计与结果 Table 3 Design and results of L9(34) orthogonal test |
|
|
表 4 方差分析 Table 4 Analysis of variance |
从表 3的极差分析可知,影响反萃取效果的因素大小顺序为C>B>A;表 4的方差分析结果表明,A、B因素的影响均达到了显著(P<0.05)水平,C因素的影响达到了极显著(P<0.01)水平。优选工艺条件为A3B3C3,即pH 7.6、30 ℃、40 min。
2.5.2 优选工艺条件的验证试验按照“2.1.5”项下制备方法,制备IT,按照正交试验优选的最佳工艺条件进行了3组抗凝血肽的反萃取试验,验证优选的反萃取工艺条件,ATU回收率分别为65.00%、65.42%、65.42%,平均回收率为65.28%,表明该优选工艺稳定。
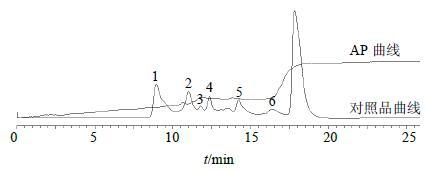
2.6 APMr分布范围的HPSEC分析用HPLC以HPSEC法测定AP Mr分布范围,AP Mr分布范围的HPSEC分析结果如图 1。AP溶液冻干后,用超纯水配制成10 ATU/mL备用。分析柱为蛋白凝胶柱Protein-Pak 60(WAT085250)。流动相为0.05 mol/L Tris-HCl(pH 7.2),体积流量0.7 mL/min,检测波长214 nm,温度25 ℃。对照品为磷酸异构酶、肌球蛋白、抑肽酶、胰岛素B、杆菌肽、马尿酰-组氨酰-亮氨酸。
从图 1可知,在约18 min时出现AP分子的特征吸收波长,与马尿酰-组氨酰-亮氨酸接近,提示其分子大小相当于3肽。
|
图 1 AP Mr分布范围的HPSEC图 Fig.1 HPSEC of AP Mr distribution range |
2.7 AP的体外抗凝血实验
体外抗凝血实验参照文献方法[14]有改动。先将0.2 mL 300 ATU/mL AP溶液放入小试管中,新西兰兔心脏取血,趁未凝固立即加入1.8 mL血液,轻轻混合均匀,同时以1.8 mL兔原血为阴性对照、4%柠檬酸三钠(CATS)取代AP为阳性对照,于15 ℃静置。昼夜观察、记录各管的血液凝固时间并拍照。
体外抗凝血实验结果见图 2(均在凝固后拍摄)。新西兰兔原血在试管内30 s左右凝固,兔原血与4% CATS以9∶1比例的混合液经过23.5~48.0 h凝固,而兔原血与AP溶液的9∶1比例混合液经过72~120 h凝固,可见AP的抗凝血效果远比4% CATS显著。

|
图 2 体外抗凝血实验 Fig.2 In vitro anticoagulation experiment |
2.8 AP体外溶栓实验
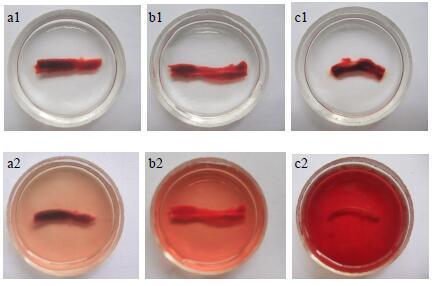
体外溶栓实验参照文献方法[15]有改动,新西兰兔心脏取血,滴在培养皿的棉线上,静置15 min使血液充分凝固,把棉线连上面的血栓一起轻轻拉出,将棉线剪成约2 cm段置小培养皿内,浸泡于150 ATU/mL AP溶液中,同时以生理盐水为阴性对照、4%(质量分数,后同)CATS为阳性对照。于26 ℃静置24 h,昼夜观察、记录各小培养皿内溶血时间并拍照。
体外溶栓实验进行24 h后,结果如图 3所示。可见浸泡于150 ATU/mL AP的血栓已完全溶解,浸泡于4% CATS中的尚有部分未溶解,而溶解于生理盐水中的只有极少量。说明150 ATU/mL AP溶栓效果好于4% CATS。而后者又明显好于生理盐水。
|
图 3 体外溶栓实验结果 Fig.3 In vitro thrombolytic experiment |
3 讨论
利用酶解制备抗凝血肽,有2个问题需要注意:(1)一般酶解制备各种功能活性肽都是以水解度为目标,水解度越大越能得到满意的结果,但本实验所要制备的抗凝血肽活性与其相对分子质量有显著关系,因此不能光以水解度为参考,而要严格控制反应时间;(2)体外抗凝血活性的测定易受环境温度影响,为了保证测定的准确性,应在低温下进行,以保持凝血酶的活力。本实验利用Pa、Br、NP、AP进行酪蛋白4酶混合水解可以产生具有抗凝血酶活力的肽,工艺简单,耗时少,产物具有较强的抗凝血活力。
目前有关抗凝血肽的研究较多的是利用不同原材料(菲牛蛭等)进行抗凝血肽的制备,然后初步测试其活性,而关于抗凝血肽分离的研究很少报道。本实验利用固定化凝血酶来分离纯化抗凝血肽,在一定pH值条件下,IT可以有效用于酪蛋白水解物中的AP萃取。萃取完毕,分离IT-AP,用不同pH的溶液进行反萃取,AP与IT分离,滤去酶即可获得目的物。本实验确定的工艺简单,条件温和,ATU回收率较高,工艺易放大。
| [1] | Whitaker I S, Rao J, Izadi D, et al. Hirudo medicinalis: ancient origins of and trends in the use of medici-nal leeches throughout history[J]. Brit J Oral Max Surg, 2004, 42 (2) :133–137 . |
| [2] | 李天全, 万昌秀, 李倚剑, 等. 新一代高效特异抗凝药物-水蛭素[J]. 医学工程学杂志, 1998,15 (3) :306–310. |
| [3] | 刘纯古, 童张法. 水蛭素活性分析方法的研究[J]. 当代化工, 2004,33 (4) :243–245. |
| [4] | Scharf M, Engels J, Tripier D. Primary structures of new ‘iso-hirudins’[J]. FEBS Lett, 1989, 255 (1) :105–110 . |
| [5] | Rydel T J, Ravichandran K G, Tulinsky A. The structure of a complex of recombinant hirudin and alpha-thrombin[J]. Science, 1990, 249 (4966) :277–280 . |
| [6] | Hein O V, von Heymann C, Lipps M, et al. Hirudin versus heparin for anticoagulation in continuous renal replacement therapy[J]. Intens Care Med, 2001, 27 (4) :673–679 . |
| [7] | 陈华友, 邢自力, 李媛媛, 等. 凝血酶滴定法测定水蛭素活性的改进[J]. 生物技术, 2002,12 (6) :24–25. |
| [8] | 刘海洲, 张媛媛, 张广柱, 等. 固定化酶制备技术的研究进展[J]. 化学工业与工程技术, 2009,30 (1) :21–23. |
| [9] | Fiat A M, Migliore-Samour D, Jollès P, et al. Biologically active peptides from milk proteins with emphasis on two examples concerning antithrombotic and immunomodulating activities[J]. Dairy Sci, 1993, 76 (1) :301–310 . |
| [10] | 刘恭, 高维东, 纪银莉, 等. 牦牛乳酪蛋白抗凝血肽制备工艺研究[J]. 食品研究与开发, 2014,35 (17) :65–68. |
| [11] | 曹文红, 章超桦. 生物活性肽的吸收机制[J]. 药物生物技术, 2006,13 (5) :384–388. |
| [12] | 陈芳艳, 纪平雄. 家蚕丝素固定化木瓜蛋白酶[J]. 华南农业大学学报, 2004,25 (3) :83–86. |
| [13] | 苗艳丽, 余广仁, 徐银龙, 等. 丝素固定化凝血酶的工艺研究[J]. 中国药师, 2016,19 (4) :11–14. |
| [14] | 李京城, 王振英. 常用静脉注射剂的体外抗凝血试验[J]. 中国兽医学报, 1981 (2) :77–79. |
| [15] | 陈少鹏, 韩雅莉, 郭桅, 等. 少棘蜈蚣纤溶活性蛋白的抗血栓作用[J]. 中国药理学通报, 2007,23 (8) :1088–1092. |
 2016, Vol. 47
2016, Vol. 47


