2. 天津国际生物医药联合研究院, 天津 300457 ;
3. 天津中医药大学中药学院, 天津 300193
2. Tianjin International Joint Academy of Biotechnology and Medicine, Tianjin 300457, China ;
3. College of Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
灯盏花素(scutellarin)是从灯盏花即菊科植物短葶飞蓬Erigeron breviscapus (Vant.) Hand. -Mazz. 的干燥全草[1]中提取精制的黄酮类有效成分,其中灯盏乙素(野黄芩苷)占95%以上[2]。灯盏花素具有降低脑血管阻力、增加脑血流量、扩张心脑血管、改善微循环及抗血小板聚集作用,临床上可用于治疗脑供血不足、脑出血所致后遗症、脑血栓、高脂血症、冠心病、心绞痛等疾病[3-5]。灯盏花素作为临床治疗心脑血管类疾病的常用药,常用制剂主要有片剂、颗粒剂、注射剂、注射粉针剂等[6]。《中国药典》2015年版规定以野黄芩苷为灯盏花药材及其制剂的定量控制指标成分[1]。由于野黄芩苷(5,6,4′-三羟基黄酮-7-O-葡萄糖苷)为黄酮苷类化合物,在水溶液中苷键极易发生水解,酚羟基可能被氧化而降解。本研究参照International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(ICH)稳定性指导原则,采用化学反应动力学和热力学方法对野黄芩苷单体及其制剂在不同温度、pH值、离子强度及初始浓度等条件下的降解规律进行研究,为中药注射剂稳定性研究和相关质量控制提供科学依据。
1 仪器与材料Agilent 1100型高效液相色谱仪,美国Agilent公司;Varian CARY 50Conc UV-Vis分光光度计,美国Varian公司;AX205精密电子分析天平,瑞士Mettler Toledo公司;XW-80A微型旋涡混合仪,上海沪西分析仪器厂;恒温水浴,天津市泰斯特仪器有限公司;KBF恒温恒湿箱,德国Binder公司;Mill-Q超纯水仪,美国Millipore公司。
野黄芩苷(批号110842-200605,质量分数≥95%)对照品购自中国食品药品检定研究院;灯盏花素注射液(批号20091007)购自上海中药制药二厂;常用注射溶媒:0.9%生理盐水溶液、5%葡萄糖注射液、10%葡萄糖注射液、乳酸钠林格注射液、复方电解质葡萄糖注射液,均购自中国大冢制药有限公司;乙腈、甲醇,色谱纯,购自德国Merk公司;氢氧化钠、磷酸氢二钠、磷酸二氢钠,分析纯,购自天津市北方天医化学试剂厂;盐酸、氯化钠,分析纯,购自天津化学试剂一厂;过氧化氢,分析纯,购自天津市昊陆成化工有限公司;纯水由Mill-Q超纯水仪制备。
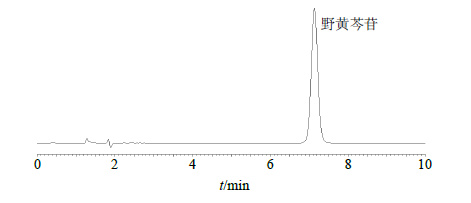
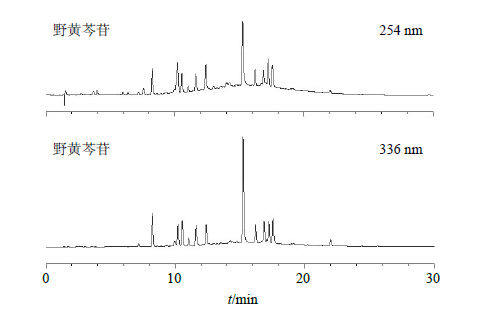
2 方法与结果 2.1 HPLC色谱条件查阅文献报道[7]色谱条件经优化确定本实验色谱条件如下:色谱柱为Agilent C18(150 mm×4.6 mm,5 μm);野黄芩苷单体流动相为乙腈-0.1%甲酸水(18∶82);检测波长为336 nm;灯盏花素注射液及其降解产物流动相为乙腈-0.05%甲酸水溶液,梯度洗脱程序为0~60 min,2.0%~95.0%乙腈,检测波长为254 nm和336 nm,体积流量为1.0 mL/min;温度25 ℃;进样量为10 μL。在该色谱条件下,野黄芩苷可在10 min内完成检测,保留时间7.2 min,在各种条件下的降解产物均不会干扰测定(图 1)。灯盏花素注射液在不同波长下的色谱图(图 2)显示,在254 nm条件下色谱峰数较多,分离度较好,而野黄芩苷的检测波长为336 nm,为实现对多种成分及其降解产物的同时测定,故采用双波长254 nm及336 nm同时检测。
|
图 1 野黄芩苷单体HPLC图 Fig.1 HPLC of scutellarin monomer |
|
图 2 灯盏花素注射液在254 nm和336 nm HPLC图 Fig.2 HPLC of scutellarin in Dengzhanhuasu Injection at 254 and 336 nm |
2.2 对照品溶液的配制
精密称取野黄芩苷对照品5.00 mg,置于10 mL棕色量瓶中,用甲醇定容至刻度,摇匀,得质量浓度为0.50 mg/mL的对照品储备液。
2.3 供试品溶液的配制精密量取灯盏花素注射液1 mL,用不同降解条件溶液或5种常用输液剂(0.9%生理盐水溶液、5%葡萄糖注射液、10%葡萄糖注射液、乳酸钠林格注射液、复方电解质葡萄糖注射液)基质溶解定容至25 mL,滤过,取续滤液,即得灯盏花素注射液供试品溶液。
2.4 分析方法验证 2.4.1 线性关系考察分别精密吸取“2.2”项下野黄芩苷对照品储备液0.01、0.02、0.10、0.20、0.40、1.00 mL至10 mL棕色量瓶中,以pH 7的水溶液定容至刻度,摇匀,得质量浓度为0.5、1、5、10、20、50 μg/mL的系列野黄芩苷对照品溶液,分别精密吸取10 μL在规定条件下进样,以色谱峰面积为纵坐标(Y),对照品质量浓度为横坐标(X),采用加权法绘制标准曲线,得回归方程:Y=3.52×104 X-8.23×103,r=0.999 9,表明野黄芩苷在0.5~50 μg/mL线性关系良好。
2.4.2 精密度试验配制质量浓度为5 μg/mL的野黄芩苷对照品溶液,精密吸取10 μL,重复进样6次,测得野黄芩苷峰面积的RSD为1.6%,表明此方法精密度良好。
2.4.3 重复性试验按“2.3”项方法制备灯盏花素注射液供试品溶液(复方电解质葡萄糖注射液为溶剂)6份,按“2.1”项色谱条件进样分析,结果野黄芩苷质量浓度的RSD为1.9%。
2.4.4 加样回收率试验分别配制高(20 μg/mL)、中(5 μg/mL)、低(0.5 μg/mL)3个质量浓度的野黄芩苷对照品溶液各6份,分别与0.5 mL灯盏花素注射液混合,按“2.3”项方法制备供试品溶液(复方电解质葡萄糖注射液为溶剂),按“2.1”项色谱条件进样分析,将所得峰面积代入标准曲线可得高、中、低3个质量浓度供试品溶液的平均回收率分别为101.9%、96.6%、92.6%,RSD分别为2.4%、3.1%、1.8%,表明此方法重复性良好。
2.5 pH值和温度对野黄芩苷单体和灯盏花素注射液稳定性的影响野黄芩苷为灯盏花素注射液中质量浓度最高的主要药效成分之一,《中国药典》2015年版规定以野黄芩苷为灯盏花药材及其制剂的定量控制指标成分。本研究通过化学反应动力学方法比较pH值、温度对野黄芩苷单体和灯盏花素注射液稳定性的影响,并分别考察离子强度、初始质量浓度对单体稳定性的影响及灯盏花素注射液和不同输液剂的配伍稳定性。
2.5.1 pH值对野黄芩苷单体及灯盏花素注射液稳定性的影响精密吸取“2.2”项下野黄芩苷对照品储备液和“2.3”项下灯盏花素注射液供试品溶液适量,均稀释于pH值1~13的酸、碱溶液中。采用HPLC法测定野黄芩苷单体和灯盏花素注射液中的野黄芩苷在pH值1~13时其量的经时变化,通过化学反应动力学方法计算它们的降解速率常数(Kobs),结果见表 1。
|
|
表 1 25 ℃不同pH值下野黄芩苷水溶液及其在灯盏花素注射液中的Kobs Table 1 Kobs of scutellarin and Dengzhanhuasu Injection with different pH values at 25 ℃ |
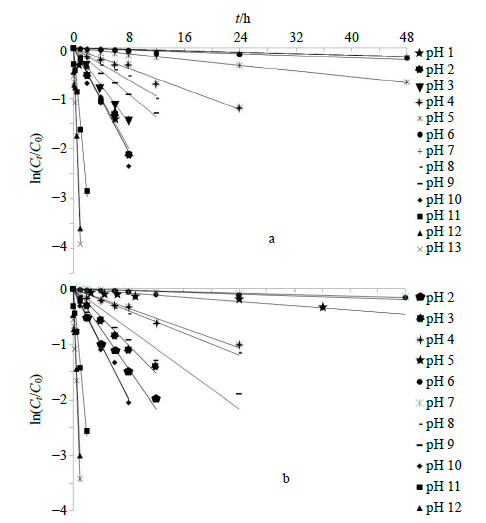
以ln(Ct/C0) 对水解时间(t)作图,ln(Ct/C0)=−Kt(其中Ct为t时刻药物浓度,C0为初始时刻药物浓度,t为反应时间,K即为反应速率常数),野黄芩苷单体在不同pH值溶液中其量随时间的改变如图 3-a所示,灯盏花素注射液中野黄芩苷在不同pH值溶液中其量变化如图 3-b所示,由实验结果得出野黄芩苷及其注射液在所有实验条件下的一级反应动力学曲线的相关系数均大于0.93,证明其在不同pH值下的降解符合一级反应过程。单体及注射液在不同pH条件下的动力学参数如表 2所示。
|
图 3 25 ℃不同pH值条件下野黄芩苷 (a) 及灯盏花素注射液 (b) 降解动力学曲线 Fig.3 Degradation kinetic curves of scutellarin (a) and Dengzhanhuasu Injection (b) with different pH values at 25 ℃ |
|
|
表 2 25 ℃不同pH值下野黄芩苷水溶液及其在灯盏花素注射液中的降解动力学参数 Table 2 Degradation kinetic parameters of scutellarin and Dengzhanhuasu Injection with different pH values at 25 ℃ |
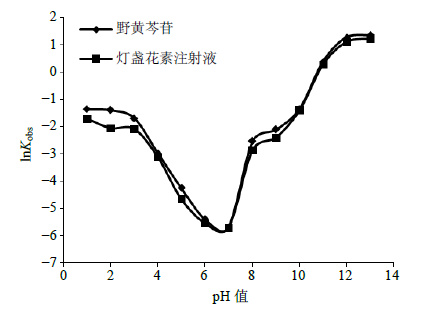
野黄芩苷在灯盏花素注射液中,在酸碱条件下的稳定性均较单体成分有所提高,无论是酸催化反应还是碱催化反应都有所减缓,且在强酸和弱碱性环境中,稳定性明显提高。表明灯盏花素注射液的制剂工艺可提高野黄芩苷在酸性和弱碱性环境中的稳定性。为了更直观地表示pH值对野黄芩苷和灯盏花素注射液在水溶液中降解速率的影响,以lnKobs为纵坐标,pH值为横坐标作图,得到pH值与野黄芩苷和灯盏花素注射液Kobs的关系图(图 4)。野黄芩苷单体和灯盏花素注射液均在pH 7时最为稳定,在酸碱条件下均易降解,降解反应速率随酸碱性的增强而增加,表明其降解反应可能是氢和氢氧根离子催化作用。
|
图 4 不同pH值的25 ℃水溶液中野黄芩苷及灯盏花素注射液Kobs比较图 Fig.4 Kobs of scutellarin and Dengzhanhuasu Injection at 25 ℃ under different pH values |
2.5.2 温度对野黄芩苷单体及灯盏花素注射液稳定性的影响
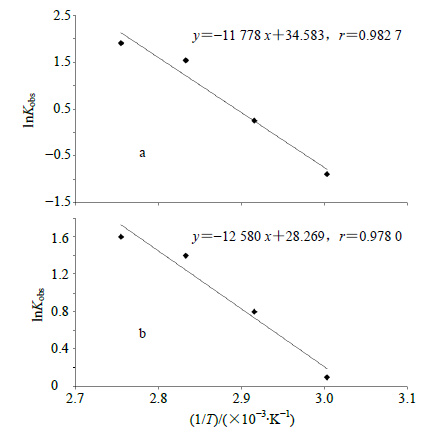
精密吸取“2.2”项下野黄芩苷对照品储备液和“2.3”项下灯盏花素注射液供试品溶液适量均用中性水溶液稀释至合适质量浓度,将配制好的样品溶液分别放置于60、70、80、90 ℃的恒温水浴中,每隔一定时间,精密吸取样品溶液10 μL注入高效液相色谱仪,测定野黄芩苷峰面积,计算样品中野黄芩苷的质量浓度。以lnKobs为纵坐标,1/T(T代表实验温度)为横坐标作图,得到温度对野黄芩苷单体及其在灯盏花素注射液中降解速率的影响如图 5所示。由该线性方程计算出不同温度下的Kobs,并通过阿仑尼乌斯方程(lnKobs=lnA-Ea/RT)计算野黄芩苷单体降解反应的活化能。公式中A为指前因子,Ea为该反应的活化能(J/mol),R为摩尔气体常数[8.314 J/(K·mol)],T为热力学温度(K)。由上式计算得野黄芩苷单体降解反应的活化能为97.9 kJ/mol,灯盏花素注射液降解反应的活化能为104.6 kJ/mol。表明野黄芩苷单体及其制剂均易受温度影响,随着温度的升高,其降解反应明显加快,半衰期缩短。
|
图 5 不同温度下野黄芩苷 (a) 和灯盏花素注射液 (b) 样品水溶液Kobs比较图 Fig.5 Kobs figure of scutellarin (a) and Dengzhanhuasu Injection (b) in neutral aqueous solution under different temperatures |
2.6 起始质量浓度对野黄芩苷单体稳定性的影响
精密吸取“2.2”项下野黄芩苷对照品储备液100、200、400 μL分别置于10 mL棕色量瓶中,用pH 3、7、8、11的水溶液定容至刻度,摇匀,配制各pH值下起始质量浓度为对照品质量浓度的0.01、0.02、0.04倍的样品溶液。每隔一定时间精密吸取10 μL注入高效液相色谱仪,测定野黄芩苷峰面积,计算样品中野黄芩苷的量。结果(表 3)显示虽然不同pH值下降解速率不同,但是在同一pH值条件下,不同起始质量浓度的野黄芩苷降解速率并无差异,表明起始质量浓度对其降解速率没有影响。
|
|
表 3 不同起始质量浓度下野黄芩苷的Kobs Table 3 Kobs of scutellarin in different initial concentration |
2.7 离子强度对野黄芩单体稳定性的影响
精密吸取“2.2”项下野黄芩苷对照品储备液200 μL于10 mL棕色量瓶中,用中性水溶液定容至刻度,摇匀得样品1。另精密吸取储备液200 μL置于10 mL棕色量瓶中,加入含有0.5 mol/L NaCl溶液的中性水溶液中定容至刻度,摇匀得样品2。每隔一段时间,精密吸取样品溶液10 μL注入高效液相色谱仪,测定野黄芩苷峰面积,计算样品中野黄芩苷含量。结果显示,加入0.5 mol/L NaCl后,野黄芩苷的Kobs为0.035 8 h−1,与未加NaCl的样品(Kobs为0.036 3 h−1)相比降低了1.3%,未发生很明显的变化。说明Na+、Cl−对野黄芩苷的水解反应没有明显的影响。
2.8 灯盏花素注射液与临床常用输液剂配伍稳定性研究灯盏花素注射液临床亦常与其他药物配伍用于治疗脑梗死、脑血栓、冠心病心绞痛、心肌梗死和糖尿病等[8]。因此,灯盏花素注射液与其他药物配伍后的稳定性引起了临床上的广泛重视,并进行了较多的研究[9-11]。本实验对5种临床常用的输液剂(0.9%氯化钠溶液,5%、10%葡萄糖溶液,复方电解质葡萄糖注射液,乳酸钠林格注射液)对灯盏花素注射液稳定性的影响进行研究。
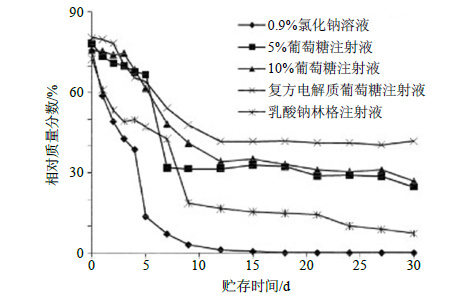
精密吸取“2.3”项下灯盏花素注射液供试品溶液适量分别采用0.9%生理盐水溶液、5%葡萄糖注射液、10%葡萄糖注射液、乳酸钠林格注射液、复方电解质葡萄糖注射液等5种配伍稀释用输液剂配制成质量浓度为0.01 mg/mL的样品溶液。常温条件下放置30 d,按设定时间取上述各样品10 μL注入高效液相色谱仪,测定野黄芩苷峰面积,计算各样品溶液中野黄芩苷的量。本实验周期30 d,远远超出输液剂临床安全使用时间(7 h),为初步稳定性实验结果。如图 6所示,灯盏花素注射液中的野黄芩苷在5种临床常用的输液剂中均不稳定,30 d内均可观察到明显的质量浓度下降,且下降过程较为规律。但是在不同的输液剂中稳定性有所差异。实验条件下,野黄芩苷在灯盏花素注射液中在0.9%生理盐水溶液中最不稳定,在30 d内几乎降解完毕,在其他4种输液剂中30 d内分别下降至9.3%~40.7%。而短期实验显示灯盏花素注射液中的野黄芩苷在5种输液剂中前7 h均基本稳定,其量无明显下降,初步推测可能是由于这些输液剂多由盐类和葡萄糖组成,在与灯盏花素注射液配伍后长期放置过程中受环境影响,会发生盐类水解等引起溶液pH值发生变化,灯盏花素注射液说明书规定其配伍pH值应不低于4.2,若溶液pH值超出该范围会出现沉淀、主要成分析出等现象,导致注射液中野黄芩苷的量下降。因此临床使用灯盏花素注射液时应注意现用现配,避免长期贮存。
|
图 6 灯盏花素注射液中野黄芩苷在不同输液剂中的稳定性 Fig.6 Stability of scutellarin in Dengzhanhua Injection in different infusion solutions |
3 讨论
中药注射剂组成复杂,生产工艺环节较多,致使其在整个生产、运输、保存和使用过程中有许多可变因素,如温度、pH值、光照等都会对其有效成分的稳定性造成影响[12]。中药注射剂中某些成分稳定性相对较差,溶于输液基质时易出现质量浓度下降、浑浊、产生微粒等问题,从而引发不良反应[13-14]。因此,中药注射剂的稳定性是保证其临床安全有效的重要研究内容。本研究对灯盏花素注射液及其活性成分野黄芩苷在不同温度、酸碱及配伍条件下的稳定性进行考察,证明不同pH值和温度条件下,野黄芩苷单体及其在灯盏花素注射液中的降解均遵循一级动力学规律,并且灯盏花素注射液在不同温度、pH值条件下均较单体稳定,表明灯盏花素注射液的制剂工艺可提高野黄芩苷在不同温度和酸碱环境中的稳定性。另外,中药成分的水解还可能会受溶液浓度和介质中离子强度影响,本研究结果显示野黄芩苷的起始质量浓度及Na+、Cl−的引入对其降解反应速率没有明显影响,但本实验中仅考察了溶液中常见的Na+和Cl−,其氧化性和还原性均较弱,若换为其他氧化性和还原性相对较强的离子,则可能对结果有较大影响,需在今后进一步考察。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 2010 . |
| [2] | 方睿, 杜树山. 灯盏花素制剂研究进展[J]. 中国实验方剂学杂志, 2011,17 (4) :233–236. |
| [3] | 叶立, 李建宇, 李月鹏, 等. 灯盏花素对大鼠脑微血管内皮细胞损伤的保护作用[J]. 中草药, 2011,42 (5) :955–957. |
| [4] | 杨丽梅, 顾军, 林明建, 等. 灯盏花素的研究进展[J]. 天津药学, 2010,22 (1) :56–60. |
| [5] | 周莉. 灯盏花素的心脑血管药理及临床研究进展[J]. 中医药信息, 2013,24 (7) :608–610. |
| [6] | 李凤英, 曹锦江, 李海华, 等. 中药灯盏花素新制剂的研究进展[J]. 临床合理用药杂志, 2015,8 (16) :180–181. |
| [7] | 耿家玲, 王祥红, 田润涛. 灯盏花素注射液HPLC特征图谱研究[J]. 药物分析杂志, 2011,31 (8) :1511–1515. |
| [8] | 周素娟. 灯盏细辛制剂药理研究进展及临床评价[J]. 中国医院用药评价与分析, 2006,6 (1) :22. |
| [9] | 张晓峰. 灯盏细辛注射制剂与多种注射液的配伍稳定性分析[J]. 现代医药卫生, 2008,24 (23) :3542–3544. |
| [10] | 王霞, 梅玲. 注射用灯盏花素与常用溶媒配伍稳定性考察[J]. 华西医学, 2014,29 (2) :293–296. |
| [11] | 杨亚青, 张智琪, 林辉, 等. 注射用灯盏花素在7种注射液中的稳定性研究[J]. 中国医院用药评价与分析, 2012,12 (1) :53–55. |
| [12] | Ren X L, Wang G F, Wang M, et al. Kinetics and mechanism of 2,3,5,4'-tetrahydroxystilbe-ne-2-O-β-Dglycoside (THSG) degradationin aqueous solutions[J]. J Pharn Biomed Anal, 2011, 55 (1) :211–215 . |
| [13] | 谭乐俊, 王萌, 朱彦. 中药注射剂的不良反应研究进展[J]. 中国中药杂志, 2014,39 (20) :3889–3895. |
| [14] | Wang M, Ren X L, Gao X M, et al. Stability of active ingredients of traditional Chinese medicine (TCM)[J]. Nat Prod Commun, 2009, 4 (12) :1761–1776 . |
 2016, Vol. 47
2016, Vol. 47



