2. 新疆医科大学药学院, 新疆 乌鲁木齐 830011
2. School of Pharmacy, Xinjiang Medical University, Urumqi 830011, China
菊科(Compositae)金鸡菊属Coreopsis L. 植物两色金鸡菊Coreopsis tinctoria Nutt. 的干燥头状花序名曰雪菊,其全草名为蛇目菊,主要分布于我国新疆和田地区海拔约3 000 m的昆仑山区,是与雪莲齐名的珍贵维药之一[1]。《新华本草纲要》中始载蛇目菊味甘,性平,归肝和大肠经,具有清热解毒、活血化瘀之功效,用于治疗急慢性痢疾、目赤肿痛、湿热痢、痢疾等。其头状花序则在维吾尔族民间用于预防心血管疾病,现代药理学研究发现雪菊具有调血脂、降血压、降血糖的作用。目前发现雪菊中主要含有黄酮类、挥发油类、氨基酸类、脂肪酸类及聚炔苷类等成分[2-10]。
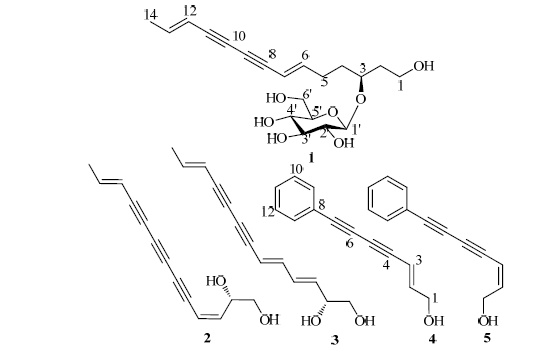
聚炔类成分是由多个烯基、炔基组成的大型链状共轭体系,具有较强的抗菌、抗炎、抗肿瘤等生物活性。其主要分布于菊科、五加科和伞形科等植物中[11-15]。两色金鸡菊的头状花序中仅分离得到8个 聚炔类成分[8, 16]。本实验从两色金鸡菊的头状花序50%乙醇提取物中分离得到5个该类成分,分别鉴定为(3S)-(6E,12E)-二烯-8,10-二炔-1-十四烷醇-3- O-β-D-葡萄糖苷 [(3S)-(6E,12E)-tetradecadiene-8,10- diyne-1-ol-3-O-β-D-glucopyranoside,1]、(2S)-(3Z,11E)-二烯-5,7,9-三炔-1,2-十三碳二醇 [(2S)-(3Z,11E)-decadiene-5,7,9-triyne-1,2-diol,2]、(2R)-(3E,5E,11E)-三烯-7,9-二炔-1,2-十三碳二醇 [(2R)-(3E,5E,11E)- triene-7,9-diyne-1,2-diol,3]、(E)-7-苯基-2-烯-4,6-二炔-1-庚醇 [(E)-7-phenyl-2-heptene-4,6-diyne-1-ol,4]、(Z)-7-苯基-2-烯-4,6-二炔-1-庚醇 [(Z)-7-phenyl- 2-heptene-4,6-diyne-1-ol,5]。结构见图 1。化合物1为1个新的聚炔苷类成分,命名为金鸡菊炔苷E。化合物3、5为首次从该植物中分离得到。采用脂多糖(LPS)诱导的BV-2细胞NO生成模型对化合物1进行抗炎活性筛选,显示微弱的活性。
1 仪器与材料Inova-500核磁共振仪(Varian公司);Waters e2695型高效液相色谱仪(美国Waters公司);Merck RP C18制备型色谱柱(250 mm×10 mm,5 μm);AB-8大孔柱色谱为天津聚浩树脂科技有限公司产品;硅胶柱色谱(200~300目)为青岛海洋化工厂产品;凝胶Sephadex LH-20为Amersham Pharmacia公司产品;ODS硅胶填料为日本富士化学株式会社公司产品。所用试剂均为分析纯或色谱纯。
两色金鸡菊头状花序于2014年7月购于河北安国药材市场,由北京中医药大学张媛副教授鉴定为两色金鸡菊Coreopsis tinctoria Nutt. 的干燥头状花序。标本(201407)保存于北京中医药大学中药学院生药系实验室。
2 提取与分离两色金鸡菊的干燥花序10 kg,粉碎后用15倍体积的50%乙醇溶液渗漉提取,减压回收溶剂得浸膏3 581.2 g,浸膏分散于5%甲醇中,经AB-8大孔树脂柱(10 cm×100 cm)分离,以10%、60%、90%甲醇梯度洗脱,得到90%甲醇洗脱部位18.9 g,90%甲醇洗脱部位经ODS反相硅胶柱色谱分离,以甲醇-水(30%→45%→60%→80%→90%,1 mL/min)梯度洗脱,得到9个流分(Fr. A~I)。Fr. E(2.8 g)经硅胶柱色谱分离,醋酸乙酯-乙醇(30∶1→7∶3)梯度洗脱,得到5个流分(Fr. E-1~E-5)。Fr. E-3(1.96 g)经凝胶柱色谱分离,甲醇-水(30%→80%)洗脱,得到化合物1(9.0 mg)。Fr. H经制备液相色谱(乙腈-水60∶40)分离得到化合物2(2.3 mg)、3(2.0 mg)。Fr. G经制备液相色谱(乙腈-水40∶60)分离,得到化合物4(4.3 mg)、5(2.7 mg)。
3 水解取化合物1 2.0 mg溶解于5 mL甲醇中,再加入2 mol/L CF3COOH,100 ℃搅拌8 h,反应完全冷却至室温,减压浓缩。将浓缩物溶于10 mL水中,用醋酸乙酯溶液(3×10 mL)萃取,分别将醋酸乙酯层、水层减压浓缩,经TLC、1H-NMR检测并测定旋光数据。
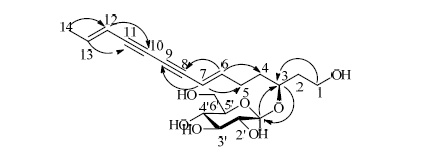
4 结构鉴定化合物1:淡黄色无定形粉末,HR-ESI-MS m/z: 425.182 3 [M+HCOO]−,(计算值425.182 4)分子 式为C20H28O7。UV λmaxMeOH (nm): 262.4,276.8,294.0,312.8; IR νmaxKBr (cm−1): 3 403,2 177,表明其结构中存在羟基和炔基。1H-NMR (500 MHz,CD3OD) 数 据(表 1)可见2 对反式烯氢信号δH 6.36 (1H,d,J = 16.0 Hz,H-6),5.59 (1H,d,J = 15.5 Hz,H-7),5.63 (1H,d,J = 16.0 Hz,H-12),6.31 (1H,dq,J = 15.5,6.5 Hz,H-13);13C-NMR (125 MHz,CD3OD) 数据(表 1)显示出20 个碳信号,结合DEPT 数据显示11 个伯碳和叔碳、5 个仲碳信号,可确定其中有4 个 炔碳δC 79.1 (C-8),71.8 (C-9),71.9 (C-10),79.0 (C-11),4 个烯碳δC 148.0 (C-6),108.4 (C-7),109.5 (C-12),142.9 (C-13),1 个甲基δC 17.4,5 个亚甲基 (其中2 个与氧原子相连)δC 58.1 (C-1),36.8 (C-2),76.3 (C-3),34.0 (C-4),28.6 (C-5) 以及1 组葡萄糖碳信 号δC 102.5 (C-1′),73.9 (C-2′),76.7 (C-3′),70.2 (C-4′),76.5 (C-5′),61.3 (C-6′)。该化合物母核NMR 数据与文 献报道[17]的 (6E,12E)-tetradecadiene-8,10-diyne-1,3-diol 数据基本一致,不同之处在于化合物1 的3 位 碳显示强烈的去屏蔽作用 (δC 76.3,ΔδC 5.9),结合 HMBC 谱(图 2)中,H-1′与C-3 和H-3 与C-1′的 偶合作用,可确定糖配基链接在3 位上。将化合物 1 水解产物的水层萃取物([α]D20 +43.5°,c 0.06,H2O) 与D-葡萄糖对照品的旋光数据([α]D20 +47.4°,c 0.2,H2O)进行比对,结果一致,同时根据端基质子 3JH1-H2 (7.8 Hz) 数据,可确定糖配基结构为β-D-葡 萄糖。化合物1 的C-3 为手性碳原子,其所处的结 构片段与 (S)-红花炔二醇中唯一的手性中心结构片 段相近,通过将水解产物的醋酸乙酯层旋光值([α]D20 +7.4°,c 0.03,MeOH)与 (S)-红花炔二醇([α]D23 +18.4°)进行对比[22],可确定该化合物母核3 位碳 的绝对构型为S 型。因此,鉴定化合物1 的结构为 (3S)-(6E,12E)-二烯-8,10-二炔-1-十四烷醇-3-O-β-D- 葡萄糖苷(图 1),为1 个新化合物,命名为金鸡菊 炔苷E。
|
|
表 1 化合物1 的1H-NMR、13C-NMR 和DEPT 135 数据 (500/125 MHz, CD3OD) Table 1 1H-NMR, 13C-NMR, and DEPT 135 (500/125 MHz, CD3OD) data of compound 1 |
|
图 1 化合物1~5 的结构 Fig.1 Chemical structures of compounds 1—5 |
|
图 2 化合物1 的主要HMBC (H→C) 相关 Fig.2 Key HMBC (H→C) correlations of compound 1 |
化合物2:棕色无定形粉末,HR-ESI-MS m/z: 223.073 5 [M+Na]+,推断相对分子质量为200,分子式为C13H12O2。1H-NMR (500 MHz,CD3OD) δ: 3.50 (2H,m,H-1),4.21 (1H,m,H-2),6.45 (1H,dd,J = 6.9,1.8 Hz,H-3),6.48 (1H,d,J = 6.9 Hz,H-4),5.91 (1H,dd,J = 16.0,1.6 Hz,H-11),5.65 (1H,dq,J = 16.0,1.6 Hz,H-12),1.85 (3H,dd,J = 6.9,1.6 Hz,H-13);13C-NMR (125 MHz,CD3OD) δ: 65.8 (C-1),73.4 (C-2),150.3 (C-3),110.0 (C-4),77.8 (C-5),75.0 (C-6),65.8 (C-7),66.8 (C-8),73.0 (C-9),78.8 (C-10),109.3 (C-11),147.5 (C-12),19.1 (C-13)。以上数据与 文献报道基本一致[18],故鉴定化合物2 为 (2S)- (3Z,11E)-二烯-5,7,9-三炔-1,2-十三碳二醇(图 1)。
化合物3:棕色无定形粉末,HR-ESI-MS m/z: 225.073 5 [M+Na]+,推断相对分子质量为202,分子式为C13H14O2。1H-NMR (500 MHz,CD3OD) δ: 3.50 (2H,dd,J = 11.1,5.9 Hz,H-1),4.19 (1H,dd,J = 11.1,5.5 Hz,H-2),6.42 (1H,dd,J = 14.9,11.3 Hz,H-3),6.74 (1H,dd,J = 15.4,10.9 Hz,H-4),5.93 (1H,dd,J = 15.4,5.8 Hz,H-5),5.64 (1H,d,J = 15.7 Hz,H-6),5.64 (1H,d,J = 15.8 Hz,H-11),6.33 (1H,dq,J = 15.8,6.9 Hz,H-12),1.83 (3H,dd,J = 6.9,1.6 Hz,H-13);13C-NMR (125 MHz,CD3OD) δ: 66.9 (C-1),73.6 (C-2),145.4 (C-3),138.7 (C-4),110.8 (C-5),110.8 (C-6),82.3 (C-7),77.1 (C-8),73.1 (C-9),80.7 (C-10),131.2 (C-11),144.8 (C-12),18.9 (C-13)。以上数据与文献报道基本一致[19],故鉴定化合物3为 (2R)-(3E,5E,11E)-三烯-7,9-二炔-1,2-十三碳二醇。
化合物4:棕色粉末,HR-ESI-MS m/z: 205.062 8 [M+Na]+,推断相对分子质量为182,分子式为C13H10O。1H-NMR (500 MHz,CD3OD) δ: 4.18 (2H,dd,J = 4.5,1.5 Hz,H-1),6.45 (1H,dt,J = 15.9,4.7 Hz,H-2),5.92 (1H,dt,J = 15.9,2.0 Hz,H-3),7.48 (1H,m,H-9),7.37 (1H,t,J = 7.4 Hz,H-10),7.37 (1H,t,J = 7.4 Hz,H-11),7.37 (1H,t,J = 7.4 Hz,H-12),7.48 (1H,m,H-13);13C-NMR (125 MHz,CD3OD) δ:62.7 (C-1),148.1 (C-2),108.7 (C-3),81.0 (C-4),74.5 (C-5),74.5 (C-6),81.4 (C-7),123.0 (C-8),133.4 (C-9),129.7 (C-10),130.4 (C-11),129.7 (C-12),133.4 (C-13)。以上数据与文献报道基本一致[20-21],故鉴定化合物4为 (E)-7-苯基-2-烯-4,6-二炔-1-庚醇。
化合物5:棕色粉末,HR-ESI-MS m/z: 205.062 8 [M+Na]+,推断相对分子质量为182,分子式为C13H10O。1H-NMR (500 MHz,CD3OD) δ: 4.36 (2H,dd,J = 6.4,1.6 Hz,H-1),6.27 (1H,dt,J = 11.0,6.4 Hz,H-2),5.72 (1H,d,J = 11.0 Hz,H-3),7.50 (1H,m,H-9),7.38,(1H,t,J = 7.4 Hz,H-10),7.38 (1H,t,J = 7.4 Hz,H-11),7.38,(1H,t,J = 7.4 Hz,H-12),7.50 (1H,m,H-13);13C-NMR (125 MHz,CD3OD) δ: 61.2 (C-1),147.7 (C-2),109.3 (C-3),79.6 (C-4),78.8 (C-5),72.3 (C-6),83.2 (C-7),122.9 (C-8),133.4 (C-9),129.7 (C-10),130.6 (C-11),129.7 (C-12),133.4 (C-13)。以上数据与文献报道基本一致[22],故鉴定化合物5为 (Z)-7-苯基-2-烯-4,6-二炔-1-庚醇。
5 抗炎活性筛选采用LPS诱导的BV-2细胞中NO分泌抑制模型对分离得到的化合物1进行抗炎活性筛选,小胶质细胞系BV-2细胞(由中国医学科学院细胞中心提供)在温度为37 ℃、CO2浓度为5%的细胞培养箱中用高糖培养基DMEM(该培养基中含有10%的胎牛血清以及100 μg/L的青霉素和100 μg/L的链霉素)培养至对数增殖期,备用。将待测化合物分别配制成浓度为50、25、12.5和6.5 μmol/L溶液,采用Griess法测定样品中NO2−的浓度,便可以间接反映NO浓度。测定待测化合物各浓度下的NO抑制率,结果显示,化合物1在4个浓度剂量下的NO抑制率分别为20.80%、7.34%、3.68%和1.87%,其显示微弱的抗炎活性。
| [1] | 新疆植物志编辑委员会. 新疆植物志 (第5 卷)[M]. 乌鲁木齐: 新疆科技卫生出版社, 1999 . |
| [2] | 赵军, 孙玉华, 徐芳, 等. 昆仑雪菊黄酮类成分研究[J]. 天然产物研究与开发, 2013,25 (1) :50–52. |
| [3] | Zhang Y, Shi S P, Zhao M B, et al. A novel chalcone from Coreopsis tinctoria Nutt[J]. Biochem Syst Ecol, 2006, 34 (10) :766–769 . |
| [4] | 姜保平, 许利嘉, 贾晓光, 等. 两色金鸡菊的化学成分和药理作用研究进展[J]. 现代药物与临床, 2014,29 (5) :567–573. |
| [5] | 张媛, 屠鹏飞. 两色金鸡菊头状花序的化学成分研究[J]. 中国中药杂志, 2012,37 (23) :3581–3584. |
| [6] | 杨英士, 陈伟, 杨海燕, 等. 昆仑雪菊中两个黄酮类化合物的分离鉴定及其抗氧化活性评价[J]. 南京农业大学学报, 2014,37 (4) :149–154. |
| [7] | 张彦丽, 韩艳春, 阿依吐伦•斯马义. GC-MS对昆仑雪菊挥发油成分的研究[J]. 新疆医科大学学报, 2010,33 (11) :1299–1300. |
| [8] | Zhang Y, Shi S P, Zhao M B, et al. Coreosides A-D, C-14-polyacetylene glycosides from the capitula of Coreopsis tinctoria and its anti-inflammatory activity against COX-2[J]. Fitoterapia, 2013, 87 (1) :93–97 . |
| [9] | Ablise M, Zhang Y, Zhang L, et al. Content determination of the amino acids in Coreopsis tinctoria[J]. Planta Med, 2013 (4) :39–40 . |
| [10] | Qian Z Y, Cao X Q, Zhou X L, et al. Analysis of fatty acids in Coreopsis tinctoria by GC-MS[J]. Planta Med, 2013 (3) :43–44 . |
| [11] | Christensen L P, Lam J. Acetylenes and related compounds in Cynareae[J]. Phytochemistry, 1990, 29 (9) :2753–2785 . |
| [12] | Christensen L P, Lam J. Acetylenes and related compounds in Heliantheae[J]. Phytochemistry, 1991, 30 (1) :11–49 . |
| [13] | Cirri M, Maestrelli F, Mennini N, et al. Physical-chemical characterization of binary and ternary systems of ketoprofen with cyclodextrins and phospholipids[J]. J Pharm Biomed Anal, 2009, 50 (5) :683–689 . |
| [14] | Christensen L P. Acetylenes and related compounds in Anthemideae[J]. Phytochemistry, 1992, 31 (1) :7–49 . |
| [15] | Christensen L P, Lam J. Acetylenes and related compounds in Astereae[J]. Phytochemistry, 1991, 30 (8) :2453–2476 . |
| [16] | Liu Y, Du D, Liang Y, et al. Novel polyacetylenes from Coreopsis tinctoria[J]. Nutt J Asian Nat Prod Res, 2015, 17 (2) :744–749 . |
| [17] | Kano Y, Komatsu K, Saito K, et al. A new polyacetylene compound from Atractylodes Rhizome[J]. Pharm Soc Jpn, 1989, 37 (1) :193–194 . |
| [18] | Nakada H, Kobayashi A, Yamashita K. Stereochemistry and biological activity of phytoalex in “Safynol” from safflower[J]. Agric Biol Chem, 1977, 41 (9) :1761–1765 . |
| [19] | Ferdinand B, Wolfgang S, Horst J. Uberweitere polyineaus centaurearuthenica LAM[J]. Polyacetylenverbindungen, 1961, 94 (4) :3179–3188 . |
| [20] | Wang R, Wu Q X, Shi Y P. Diarylheptanoids from the rhizomes of Curcuma kwangsiensis[J]. J Nat Prod, 2010, 73 (10) :1667–1671 . |
| [21] | Lam J, Christensen L P, Thomasen T. Polyacetylenes from Dahlia species[J]. Phytochemistry, 1991, 30 (2) :515–518 . |
| [22] | Stephen R L, Brian J M, John P R, et al. Asymmetric synthesis of β-allenic alcohols with the lithium aluminum hydride-3-O-benzyl-1,2-O-cyclohexylidene-α-D-glucofuranose complex. Determination of the absolute configuration of marasin[J]. J Chem Soc, 1974, 1 (5) :557–561 . |
 2016, Vol. 47
2016, Vol. 47


