目前,欧盟是世界上最大植物药市场,也是我国中药出口的主要目标市场之一。作为成熟的植物药市场,欧盟对药品进口有着严格的准入标准,在欧盟国家中,英国对中成药出口的管理最为严格。英国药物与保健品管理局(MHRA)于2013年11月21日颁布的传统草药制品限售法令,即从2014年5月1日起,英国市场上的所有草药制品(包括中成药)必须通过传统草药注册方案(THR)、拥有THR标志和认证号才可继续销售。然而,尚未有任何一种中成药成功注册THR。这就意味着英国已全面禁止中成药在英国的销售,这是即2004年3月31日欧盟《传统植物药注册程序指令》(2004/24/EC)7年过渡期规定之后英国对中成药出口的全面封杀。早在2013年8月20日,英国药管局就在其官网发布警告,提醒大家谨慎选用一些没有经过英国官方注册通过的中药,指出这些中药含有高含量的有害毒素,包括铅、汞、砷等,2013年11月21日禁令正式颁发,可见英国禁令的主要原因在于中药重金属超标,中药重金属超标已成为影响其质量与信誉、阻碍中医药走向世界的严峻问题。
1 英国禁令对我国中药出口的影响 1.1 从短期来看,对我国中药出口影响不大从中药出口额来看,我国出口额仅占世界中药市场的3%~5%,主要出口国也多局限在新加坡等东南亚国家。2014年我国销往英国中成药总量146.19万美元,占我国中成药海外销售总额的0.58%,占我国中成药出口欧洲总额的13.27%,英国在我国中药所有海外市场中排在第19位。因此,英国禁令无论是对中成药出口欧盟总额、中成药海外销售总额影响并不大。此外,尽管英国限制我国中成药进口,但并未限制中药材、中药饮片、配方颗粒的准入,而且与后三者相比,中成药出口的总量更小。此次英国禁令是基于欧盟《传统植物药注册程序指令》而颁布的,是履行欧盟成员国的法律义务的表现,我国目前无一家中成药企业通过英国注册。
1.2 从长期来看,对我国中药出口产生消极影响《传统植物药注册程序指令》实施以来,2012—2014年我国对欧盟中成药出口额分别为1 034.95万美元、1170.02万美元、1101.58万美元,其中2012年同比下降22.27%,创5年来对欧盟出口中成药的新低,2013、2014年涨幅有限。2014年英国中成药禁售令的实施,对我国本已形势严峻的中成药出口形成进一步的打击。英国禁令以及此前英国药品管理局对中药屡亮“黄牌”,提醒消费者警惕中药毒性风险等中药重金属超标问题[1],严重损害了中药在国际市场上的质量和信誉,很大程度上降低了中药安全性和有效性,已成为阻碍我国中医药走向世界的掣肘问题。世界各国普遍对我国中药重金属超标问题反映强烈,若英国开了先例,欧盟其他国家很有可能以此效仿,并极易引起美日韩等中药主要市场的效仿,中药出口将更加举步维艰。
2 我国中药出口欧盟现状 2.1 我国中药出口欧盟总量分析虽然我国中药出口欧盟历史悠久,但是出口份额较小,包括亚洲地区在内的传统市场是中药出口的主要市场。2004年,欧盟颁布《传统植物药注册程序指令》,该指令规定所有在欧盟市场销售的植物药都必须在2011年4月30前按照新法规完成注册,并得到上市许可,否则将不允许销售。以中成药为例,2008—2011年处于该指令颁布的7年过渡期内,中成药出口欧盟(包括欧盟15国出口额和欧盟东扩12国出口额)未受太大影响,2008—2011年我国中成药对欧盟出口额分别为1 325.11万美元、1 105.4万美元、1 252.38万美元、1 331.41万美元,其中2008年涨幅较大,达到27.09%。自《传统植物药注册程序指令》于2011年4月30日截止期后,中成药出口欧盟就呈现下滑趋势。2012年我国中成药对欧盟出口额仅为1 034.95万美元,同比下降22.27%,创5年来对欧盟出口中成药的新低。2008—2014年我国中成药对欧盟出口情况见图 1。
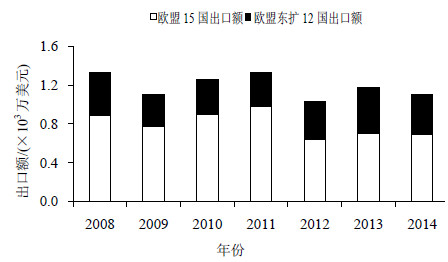
|
图 1 2008—2014年我国中成药对欧盟出口情况 Fig.1 Export of Chinese patent drug to EU in 2008—2014 |
2.2 我国中药对欧盟出口国分析
以中成药为例,2014年我国中成药对欧盟主要出口国荷兰、英国、匈牙利、德国、奥地利、波兰、捷克出口额分别为212.06万美元、146.18万美元、136.14万美元、87.30万美元、107.26万美元、75.27万美元和31.18万美元。在这7个国家中,德国、奥地利、波兰出口额同比增长,其他国家都有所下降。2014年我国中成药出口荷兰、英国、匈牙利市场份额较大。荷兰和英国是我国中成药在欧盟地区销售的主要市场。其中,荷兰对中医药的认可度相对较高,环境也较为宽松,但2014年我国对荷兰中成药出口同比下降14%。英国对中成药进口管理越来越严,受英国禁令的影响,2014年我国对英国出口中成药同比下降5.87 %。对匈牙利出口额同比下降2.07%。德国对于植物药的管理也较为客观和宽松,其生产、销售市场及对于植物药的接受程度均位居欧洲前列,2014年我国对德国中成药出口额同比增长13.66 %,对奥地利同比增长9.61%。波兰和捷克是原东欧地区进口我国中成药的重点市场。2014年我国对波兰中成药出口额同比增长75.27%,对捷克同比下降了56.56%。
2.3 我国中药出口欧盟商品结构分析我国出口欧盟中药类商品包括保健品、提取物、中成药、中药材及饮片4类。从2012年1月~10月中药各类商品出口金额统计,中药提取物占47%,中药材及饮片占33%,保健品占9%,中成药占11%。由于欧盟药品准入标准严格,目前欧盟市场内我国中药商品大多是以食品、保健品、植物药原料的形式流通,其检验检疫是按照98/43/EEC号食品卫生指令和其他有关卫生、食品安全等方面的规定。如果按出口商品分类,中药主要包括中药材、植物提取物和中成药3类,其中中药材出口额最多,中成药出口额最少,出口中药材的比例占总出口额的60%左右。
3 我国中药出口欧盟的重金属含量标准 3.1 欧盟草药药品管理的相关指令目前,欧盟草药药品管理的相关指令主要有2001/83/EC指令、2002/46/EC指令、2004/27/EC指令、2004/24/EC指令以及2011/62/EU指令。
3.1.1 《欧共体人用药品注册指令》(2001/83/EC指令)该指令是关于人用药品的一部单独性法规。在此之前,欧盟公布了许多与药品有关的指令,分别涉及疫苗、毒素或血清、应变原在内的免疫药品等内容,法规的系统性和整合性较差,使用起来也不方便。2001/83/EC指令将此前颁布的所有草药相关规范性文件进行了整合,使欧盟人用药品法规达到前所未有的统一。
3.1.2 《食品补充剂协调指令》(2002/46/EC)2002年6月10日,欧洲议会和欧盟理事会发布了2002/46/EC指令,开始对保健食品进行统一管理。食品补充剂可包括下述一种或几种成分:维生素、矿物质、氨基酸、必需脂肪酸、纤维、各种植物及草药提取物。根据该指令,中药及中药提取物可作为食品补充剂的原料来使用。食品补充剂与普通食品一样,在欧盟整体的食品监管体系下受到监管。
3.1.3 《欧共体人用药品注册指令》(2001/83/EC指令)的最新修改版本(2004/27/EC指令)随着社会的发展和科学技术的不断进步,新的疗法不断出现,介于药品和其他类型产品之间的边缘产品日益增多,使得原来的药品定义及药品申报注册程序已经不能适应当前的技术现状。此外,对人用药品的质量、安全性和有效性提出了更高的标准要求。为了适应这些变化,2004/27/EC指令对2001/83/EC指令就诸如罕见病用药、试验伦理要求、药品不良反应监测等多方面进行了补充和修订。同时,为增加各成员国之间的合作机会,2004/27/EC指令还对成员国的互认可程序进行了修订。
3.1.4 《传统植物药注册程序指令》(2004/24/EC)为了规范草药市场的监控和管理,推动医疗确切、安全性良好的草药申请上市,欧洲议会和理事会于2004年3月颁布了2004/24/EC指令。对于目前已经在欧盟市场上以“膳食补充剂”身份销售的草药产品,允许再销售7年。并在此期间允许采用传统草药简化申请的途径来获取“药品”的合法地位,申报草药产品需提供证明,证明该传统草药已在欧盟成员国境内使用超过30年以上,或已在欧洲使用15年以上,同时在欧盟以外国家或地区使用30年以上,还要提供产品安全性和有效性的充分证明[2]。
2004/24/EC指令正式承认了传统草药作为药品的法律地位,并且制定了相应的简化注册程序,但是并未因此降低对草药药品的质量要求[3]。2006年,草药药品委员会(HMPC)颁布了2个草药药品质量相关的指南——《草药药品/传统草药药品质量指南》和《质量规范指南:草药物质、草药制剂及草药制品/传统草药药品的检验方法和可接受标准》[4]。2004/24/EC指令对草药相关术语进行了定义,《质量规范指南》则规定了杂质(impurities)是草药物质、草药制剂、草药药品质量标准“检查”项中的内容之一。欧盟对草药物质、草药制剂和草药药品中重金属及砷化物、农残、微生物污染和残留溶剂等杂质方面的规定基本相似,如都要求有适宜的检验方法,制定相应的限量,并充分说明制定的理由[5]。《质量规范指南》指出应按照《欧洲药典》的方法来测定草药物质、草药制剂和草药药品的重金属及砷化物的量[6]。
3.1.5 《欧洲防伪药指令》(2011/62/EU)为防止假药流入正规销售渠道,2011年6月欧盟投票通过了2011/62/EU指令,2013年7月2日正式实施。规定所有出口到欧盟的药品均需出具出口国监管部门的书面声明,并保证符合以下要求:活性成分只能在符合欧盟GMP标准或等同于该标准的要求下生产;只有在EU委员会列出的具有GMP同等标准的名单上的国家出口活性药物成分(API)可以豁免提供书面声明。我国对欧出口的中药产品,只能作为附加值很低的原材料使用。但中国既不是人用药物注册技术要求国际协调会议(ICH)成员国,也未与欧盟签订涵盖API的互认协议。目前,我国出口欧盟的中药提取物等产品均未具备欧盟原料药资格。
3.2 欧盟草药重金属定量标准重金属包括铅、汞、镉、砷等,重金属元素不能被生物降解,在人体内能和蛋白质及酶等发生强烈的相互作用,使其失去活性,也可能在人体器官中累积,造成慢性中毒[7]。《欧洲药典》制定了严格的重金属含量标准,欧盟主要国家也制定了本国的重金属含量标准,并有进一步提高的趋势(表 1)。
|
|
表 1 欧盟主要国家、WHO及中国草药重金属定量标准 Table 1 Standard of heavy metals in herbal medicine from main countries in EU,WHO,and China |
《中国药典》2015年版进一步加强了对中药中重金属或有害元素、杂质、残留溶剂等的控制,大幅度增加或完善安全性检查项目,还增加了对铜的限量规定(20 mg·/g)。但是,《中国药典》2015年版对重金属限量标准的要求存在3点不足:一是部分重金属项目比欧盟标准偏低,如铅、汞、镉的量;二是仅对28种中药材进行重金属限量规定,且不对所有中药材及饮片规定统一的重金属限度;三是对部分中药重金属的总量未作要求,如美国规定重金属总量不得超10~20 mg/kg。中药中重金属的来源主要有2种:一是药物本身含有重金属,如朱砂和雄黄;二是与中药生长的环境条件有关,在中药生产过程中,由于对土壤选择不严,以及长期施用农药、化肥和除草剂,加之对农药的盲目选择,施用时间和剂量等达不到技术要求,导致目前药材存在农药残留量和有害重金属的量超标问题[8]。除此之外,中药材在采集、运输、加工成饮片以及制剂过程中的污染也是重金属污染的一个途径。其中,环境污染的因素是重中之重。随着世界各国对中药进口检验标准的提高,中药重金属超标正逐渐成为一个亟待解决的问题,严重影响了中药在国际市场上的信誉和竞争力。
4 我国中药出口欧盟应对重金属超标问题的对策 4.1 推广中医药文化,以文化营销带动产品营销一些国发达国家药品管理部门对中药屡屡封杀,根本原因在于他们还没有接纳中医药文化。中西医理论体系的不兼容导致文化的交流和沟通上存在一定的误区。中国驻外使领馆、相关国际组织及华人社团应通过赠送宣传手册、在报纸上刊载科普文章、提供就医指南等宣传中医药文化;中医药大专院校应争取在国外开办真正的中医药培训中心、基地,培训出真正懂中医中药的医生来;中药企业可通过孔子学院这一平台,推荐相关中医药文化专家到孔子学院巡讲,普及中医药知识。
4.2 建立中药科学化、规范化、集约化产业集群我国中药出口重金属超标的一个重要原因是中药在种植、采集、运输、加工成饮片以及制剂过程中的污染。中药种植应从源头抓起,建立大规模的符合GAP的中药材栽培生产基地,从选点、周围环境控制、选种、种植、栽培及采集等过程严格控制重金属污染,同时在药品生产上严格实施GMP。产业集群是培育与提升现代中药产业竞争优势的重要途径,通过引入现代科学技术和标准规范,以优势企业中药产品(包括中药饮片、中成药等)生产为龙头,带动中小企业中药材种植、加工、药品辅料生产、流通及相关产品发展,实现资源集聚和协同效应。
4.3 政府应对欧盟中药注册给予资金扶持欧盟《传统植物药注册程序指令》规定从2011年4月30日始中药必须通过注册才能以药品身份合法销售,而在欧盟完成一个中成药品种的申请注册,成本非常高昂[9]。一方面药品要根据要求进行相关安全、有效性等技术性研究;另一方面中药企业要进行GMP改造,并通过欧盟的GMP认证。争取中药进入国际市场不仅仅是一个企业行为,也同样是政府行为。政府应对欧盟中药注册给予资金支持,对历史悠久、疗效确切、技术含量高的出口中药设立专项基金,鼓励有条件、有能力的中药企业打入欧洲市场,支持中药企业进军欧盟。
4.4 充分发挥行业协会在推进中药出口方面的积极作用中药相关行业协会应在政府、企业、市场之间起到桥梁作用,做好服务和协调工作。首先,建立与欧盟药品监管机构的联系,推动政府间相关监管部门的对话和沟通,加强中药注册法规方面的对外交流与合作。其次,密切关注欧盟制定植物药法规的最新动态,为企业提供信息服务和咨询,特别是欧盟各国关于进口中药的重金属、农药含量标准等信息。再次,推动和完善我国中药质量标准化建设,使中药质量标准日益提高,加强国内标准与国际标准的接轨。第四,成都地奥心血康获准在荷兰上市,行业协会应通过研讨会、讲座,组织实地参观等方式在行业内推广成都地奥集团的经验,推动更多的中药品种进入欧盟市场。
5 结语虽然英国传统草药制品限售法令从短期来看,对我国中药出口影响不大,但是从长期来看,严重损害了中药在国际市场上的信誉,继欧盟颁布《传统植物药注册程序指令》(2004/24/EC)之后对我国已形势严峻的中成药出口又是一次沉重的打击。其所反映的中药重金属超标问题已成为阻碍我国中医药走向世界的掣肘问题。欧盟通过草药药品管理的相关指令和草药重金属定量标准规范限制了我国中药出口,给我国中药出口欧盟带来不利影响。对于中药重金属超标问题我国政府、行业协会、企业应给予高度重视,提高中药重金属定量标准,加强对中药重金属量的控制,提高中药的质量与信誉,增加中药在欧盟的市场份额,从而加速中医药国际化进程。
| [1] | Joanne B. Pharmacovigilance of herbal medicines:a UK perspective[J]. Drug Safety, 2003, 26 (12) :829–851 . |
| [2] | Vlietinck A, Pieters L, Apers S. Legal requirements for the quality of herbal substances and herbal preparations for the manufacturing of herbal medicinal products in the European Union[J]. Planta Med, 2009, 75 (7) :683–688 . |
| [3] | Chinou I, Knoess W, Calapai G. Regulation of herbal medicinal products in the EU:an up-to-date scientific review[J]. Phytochem Rev, 2014, 13 (2) :539–545 . |
| [4] | Wiesner J. Challenges of safety evaluation[J]. J Ethnopharmacol, 2014, 12 :467–470 . |
| [5] | Xu J C, Liu M, Xia Z J. Will the Europe Union's traditional herbal medicinal products directive (directive 2004/24/EC) be against traditional Chinese medicine in EU market?[J]. J Evid-Base Med, 2013, 6 (2) :104–108 . |
| [6] | Rita B A. Herbal drugs, herbal drug preparations and medicinal products:quality standards according to European Pharmacopoeia[J]. Eur J Integr Med, 2012, 4 :108–109 . |
| [7] | Ernst E. Risks of herbal medicinal products[J]. Pharmacoepidem Drug Safe, 2004, 13 (11) :767–771 . |
| [8] | 李敏, 刘渝. 国内外有关中药中重金属和砷盐的限量标准及分析[J]. 时珍国医国药, 2007,18 (11) :2859–2860. |
| [9] | Ferner R E, Beard K. Regulating herbal medicines in the UK[J]. BMJ:Clin Res, 2005, 331 (7508) :62–63 . |
 2016, Vol. 47
2016, Vol. 47

