2. 中国医学科学院 北京协和医学院药用植物研究所云南分所, 云南 景洪 666100
2. Yunnan Branch Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Jinghong 666100, China
三萜皂苷是植物界中具有多种生物活性的一类重要植物次生代谢产物,它广泛存在于自然界,尤以双子叶植物中分布最多,已从自然界中发现约2万种[1]。其可增强植物抗病、抗虫害的能力,还具有抗炎、抗肿瘤、抗凝血、抗病毒、降低胆固醇、保肝等作用,有着相当可观的药用价值。由于三萜皂苷结构的复杂性,从植物中直接提取或通过化学合成间接获得较为困难,且其在植物中的量较低,限制了其广泛应用。目前,提高药用植物中的三萜皂苷量的方法有组织细胞培养、应用诱导子及发根培养体系等,但效果均不明显。因此,为了使三萜皂苷能得到更广泛的应用,近年来对其研究的重心转移到合成生物学[2-4]。
合成生物学是一门综合了基因组学、分子生物学和工程学等一系列方法和原理而形成的综合性交叉学科。21世纪以来,合成生物学作为一门具有巨大潜力的综合性学科引起了人们的关注。合成生物学研究在经济、健康、能源、环境、材料等诸多领域都极具应用价值,将对人们的生活质量以及世界产生深远的影响[5]。如今,合成生物学已在医药领域发挥非常重要的作用[6]。国内外科学家先后在倍半萜类化合物青蒿素、二萜类化合物紫杉醇、丹参酮等重要活性成分生物合成学研究中取得较大进展[7]。目前青蒿酸和二氢青蒿酸的生物合成途径已完全了解,从二氢青蒿酸到青蒿素的途径与机制也在近年被揭示。利用大肠杆菌及酵母细胞合成青蒿素前体——青蒿酸的能力提高了100万倍,使得每一剂量的青蒿素成本从10美元左右下降到低于1美元。通过对代谢途径的不断改造和优化,发展了化学修饰策略。目前,半合成青蒿素的产量已经达到工业化水平[8-11]。同时,三萜类化合物人参皂苷、齐墩果酸的合成生物学研究技术也逐渐成熟。
研究表明三萜皂苷由异戊二烯途径合成,在2,3-氧化鲨烯环化酶(2,3-oxidosqualene cyclases,OSCs)作用下使2,3-氧化鲨烯环化形成三萜类骨架,然后经细胞色素P450依赖性单加氧酶、糖基转移酶等化学修饰,最终形成不同的三萜皂苷终产物[3]。合成生物学研究的不断开展以及对植物中三萜皂苷的生物合成途径的深入了解,使合成生物学在解决结构复杂、稀缺的三萜类药效成分或其前体的大规模生产应用方面具有重要意义和广阔前景。因此,本文对三萜皂苷的生物合成途径及其有关合成生物学的研究进展进行综述。
1 合成生物学及其在医药领域的应用合成生物学是以生命科学理论为指导,以工程学原理进行遗传设计、基因组改造(重组染色体)和(或)合成(包括赋予各种复杂生物功能为单位的基因群模块合成、模块组装)以及人造细胞合成,它们能在从分子到细胞、从组织到机体的多个水平上参与包括遗传与进化在内的复杂生物学[12]。这是一门涉及微生物学、分子生物学、系统生物学、遗传工程、材料科学以及计算科学等多个领域的综合性交叉学科[13]。其包括两重含义:一是设计和构建新的生物零件、组件和系统;二是对现有的、天然存在的生物系统进行重新设计和改造。合成生物学从解构生命体到重构甚至创建生命体,拓展了人们对生物大分子及其相互关系的理解[14]。
合成生物学是21世纪初新兴的生物学研究领域,是在阐明并模拟生物合成的基本规律之上,达到人工设计并构建新的、具有特定生理功能的生物系统,从而建立药物、功能材料或能源等产品的生物制造途径。与化学合成相比合成生物学技术具有反应体系简单、产量高、周期短、安全无污染、提取工艺简单、杂质少等优点。近年来,人们将合成生物学的理论和技术应用于微生物改造、抗感染药物和疫苗的研发、肿瘤治疗、细胞治疗和再生医学等领域,初步显示具有良好的潜在应用前景[15]。目前,合成生物学已经在药物产业化、疫苗开发、诱导多功能干细胞等方面取得了令人瞩目的成绩[6]。在简单生物如大肠杆菌和酿酒酵母中,可以设计代谢途径和模块组成的生物元件来改变正常的细胞代谢,从而合成人们感兴趣的代谢物,如中药药用活性成分人参皂苷、齐墩果酸等三萜皂苷。此外,一些植物来源的单体药物的生物合成研究受到了广泛的关注[7]。
2 三萜皂苷的生物合成途径三萜皂苷生物合成途径可分为3个阶段:(1)起始阶段,包括上游前体物质3-异戊烯焦磷酸酯(isopentenyl diphos-phate,IPP)和γ,γ-二甲基烯丙基焦磷酸酯(dimethylallyl diphosphate,DMAPP)的合成,甲羟戊酸(MVA)和甲基赤藓糖醇磷酸化(MEP)2条独立途径均可形成IPP和DMAPP,IPP和DMAPP之间可以相互转化。研究发现MVA和MEP代谢途径分别存在于植物体的不同部位:MVA途径主要存在于细胞质和内质网中,参与甾醇、倍半萜和三萜等次生代谢产物的生物合成;MEP代谢途径定位于质体,主要参与二萜、单萜、类胡萝卜素、异戊二烯等的生物合成[16-17]。2条途径所产生的IPP可以穿过质体膜互为对方所用[18]。(2)骨架构建阶段,IPP和DMAPP经牻牛儿基焦磷酸合酶(GPS)形成牻牛儿基焦磷酸(GPP),IPP与GPP在法呢烯焦磷酸合酶(FPS)的催化下形成法呢烯焦磷酸酯,然后在角鲨烯合酶(SQS)的作用下头尾结合成角鲨烯,角鲨烯环氧化酶(SQE)进一步催化形成2,3-氧化鲨烯,该物质是植物甾醇和三萜皂苷合成的共同前体物质,氧化角鲨烯的环化一步决定了下游的走向是植物甾醇还是三萜皂苷[17],目前已从多种植物中发现不同类型的OSCs。(3)修饰阶段,通过细胞色素P450单加氧酶、糖基转移酶和糖苷酶相继对三萜类骨架进行氧化、置换及糖基化等化学修饰,最终获得不同类型的三萜皂苷产物[3]。
由OSCs催化2,3-氧化鲨烯的环化反应,是三萜皂苷与甾醇生物合成的关键步骤。2,3-氧化鲨烯在各种OSCs的催化下,经过质子化、环化、重排和去质子化反应,得到三萜皂苷和植物甾醇的前体。OSCs属于超家族酶,主要包括甾醇类和三萜皂苷骨架的各种环化酶,可产生100多种不同骨架的三萜化合物,不同三萜化合物具有不同立体构型的选择[2]。具有代表性的三萜骨架包括四环的达玛烷型、甘遂烷型、环菠萝烷型、葫芦烷型和五环的齐墩果烷型、乌苏烷型、羽扇豆烷型等[19],如图 1所示。编码这些三萜骨架对应的多种OSCs信息见表 1。环阿屯醇是由环阿屯醇合酶(CAS)催化环化2,3-氧化鲨烯形成,是植物甾醇生物合成前体。高等植物中环阿屯醇合成各种甾醇,然后胆固醇经过一系列的氧化及糖基化形成C27骨架的甾体皂苷。其他的OSCs催化环化2,3-氧化鲨烯形成特定的三萜皂苷前体[20],见图 1。
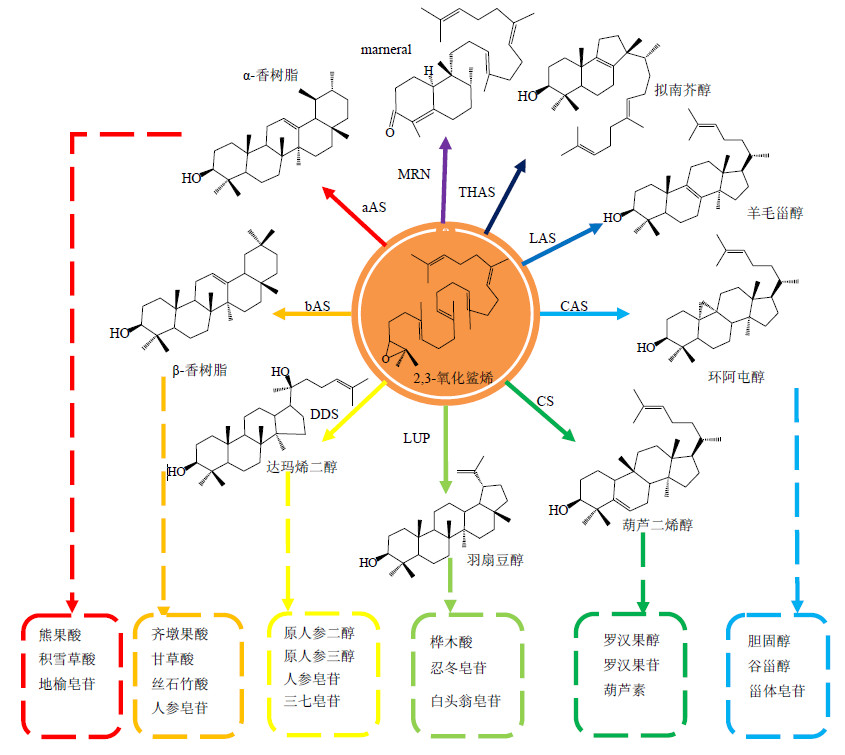
|
图 1 不同OSCs环化底物2,3-氧化鲨烯形成各类三萜骨架简图 Fig.1 OSCs catalyze 2,3-oxidosqualeneintodifferent triterpen sapogenin skeletons |
|
|
表 1 已报道的环氧角鲨烯环化酶基因 Table 1 Overview of OSCs that reported in literature |
3 三萜皂苷的合成生物学研究
许多中药有效成分包括生物碱、黄酮类、萜类等已开展了合成生物学技术研究,一些成分已获突破性进展并迅速转入工业化应用研究,成为中药成分生物合成的最新前沿。目前三萜皂苷合成生物学研究中常用的宿主为大肠杆菌和酿酒酵母[53]。酵母体内含有大量植物次生代谢的酶和底物,且合成效率远高于植物体,因此,许多在酵母中拥有前体的植物源药物如人参皂苷、三七皂苷、齐墩果酸和罗汉果甜苷等都竞相开展了合成生物学研究,见表 2。酿酒酵母已经广泛用于三萜皂苷生物合成基因的表达,它自身的麦角固醇生物合成途径可以产生三萜皂苷前体2,3-氧化鲨烯[54]。优化后的工程菌株可以积累大量2,3-氧化鲨烯,不同类型的OSCs和P450酶被表达以验证其功能,并试图通过合成生物学的方法获得单一、高产的目标产物,以解决植物提取给商业或工业用途带来的困难。
|
|
表 2 三萜化合物的合成生物学研究 Table 2 Study on synthetic biology of triterpenoids |
3.1 齐墩果酸的合成生物学研究
齐墩果酸为齐墩果烷型三萜类化合物。研究表明齐墩果酸有抗病毒、抗炎、抗变态反应、抗氧化应激及促进肝糖原合成和肝细胞再生作用等药理活性,齐墩果酸片等药品已在临床应用于肝脏保护[56]。以天然产物齐墩果酸为先导化合物,已经进行了大量的化学、生物合成研究,得到多个活性更强的衍生物[60-61]。其中,齐墩果酸半合成衍生物巴索多隆作为抗肿瘤药物进入临床评价,后续研究发现甲基巴索多隆更有潜力[62-63]。β-香树脂为这类齐墩果烷型三萜类化合物生物合成的共同前体,这类物质包括齐墩果酸及其他药用植物来源的甘草酸(glycyrrhizin)、山楂酸(maslinic acid)等化合物,来自人参、甘草、青蒿等植物的多个β-香树脂合成酶基因已被克隆验证。
来自青蒿的AaBAS基因通过酿酒酵母表达功能验证是β-香树脂醇合成酶,为提高三萜产物的量,研究者对酵母的甾醇合成途径中的2个关键酶羟甲基戊二酰辅酶A还原酶和羊毛甾醇合酶进行调节,角鲨烯增加了12倍,β-香树脂醇产物达到6 mg/L[64]。Misawa等[53]通过过表达酵母本身的ERG8、ERG9和HFA1基因,再用过表达菌株表达来自豌豆的β-香树脂醇合成酶基因,表达产物β-香树脂醇增加了5倍,为3.93 mg/L。王冬等[56]利用多片段基因同源重组法,增加齐墩果酸酿酒酵母工程菌BY-OA中甘草β-香树脂合酶(GgbAS)、蒺藜苜蓿齐墩果酸合成酶(MtOAS)和拟南芥烟酰胺腺嘌呤二核苷磷酸-细胞色素P450还原酶1(AtCPR 1)等基因的拷贝数;并通过优化YPD发酵液中初糖浓度的方式提高齐墩果酸的产量。结果表明增加工程菌BY-OA中GgbAS、MtOAS和AtCPR 1基因的拷贝数能显著提高工程菌中目标产物的产量。在初始葡萄糖质量浓度为20 g/L的YPD培养基中发酵7 d后β-香树脂和齐墩果酸分别达到136.5 mg/L(提高54%)和92.5 mg/L(提高30%),当初糖质量浓度提高到40 g/L时,齐墩果酸产量能达到165.7 mg/L。
Fukushima等[55]还验证了来自蒺藜苜蓿的细胞色素P450单加氧酶(CYP716A12)的功能,发现其是三萜生物合成的多功能氧化酶,在酵母中通过共表达来自蒺藜苜蓿的CYP716A12、来自百脉根的β-香树脂合酶和P450还原酶,结果得到酵母表达产物齐墩果酸,CYP716A12被鉴定为β-香树脂C28氧化酶,可将β-香树脂醇修饰得到齐墩果酸。酵母表达证实CYP716A12还可以催化α-香树脂C28氧化形成熊果酸,催化羽扇豆醇C28氧化形成桦木酸。尽管齐墩果酸、熊果酸、桦木酸在植物中分布广泛,但要满足商业或工业应用还是困难的,使用合成生物学的方法可能提供理想的产量,是生产有价值的三萜化合物的可行途径。以上工程酵母研究为工业生产有活性的三萜皂苷如齐墩果酸、熊果酸和桦木酸等提供了宝贵的科学依据。
3.2 人参皂苷的合成生物学研究人参皂苷是人参和西洋参等珍稀药用植物中提取的药效成分。由于野生人参资源已基本耗竭,而人工栽培人参、西洋参需要4~15年。人参皂苷类化合物产量已经远不能满足社会的需求,严重影响了人参的临床应用和人参皂苷类制药原料中间体的开发和应用,亟待需要提供新的资源途径。人参皂苷依苷元骨架的不同,可分为人参二醇型、人参三醇型和齐墩果烷型3类,而原人参二醇和原人参三醇由达玛烯二醇经P450单加氧酶催化形成,编码达玛烯二醇生物合成的达玛烯二醇合酶基因相继从人参、西洋参、三七、积雪草等植物中克隆得到。
Dai等[57-58]在酿酒酵母中成功构建原人参二醇的生物合成途径,并且发现SQE在控制三萜化合物的生物合成中起关键作用。在此基础上,通过提高3-羟基-3-甲基戊二酰辅酶A还原酶、FPS、SQS和SQE的活性,将原人参二醇的产量提高了262倍。通过双相发酵工艺优化,最终将原人参二醇的产量提高至1.2 g/L。该研究为人参皂苷生物合成途径解析和异源生物合成提供了坚实的基础。另外该课题组通过在酿酒酵母中整合带有强启动子的基因,最终获得第一代“人参酵母”细胞工厂GY-1。该细胞工厂能同时合成齐墩果酸、原人参二醇和原人参三醇3种人参基本皂苷元,为最终获得生产人参皂苷的酵母细胞工厂奠定了基础。
3.3 罗汉果甜苷的合成生物学研究罗汉果甜苷是罗汉果中主要的活性物质,其甜度约为蔗糖的300倍,且低热、无毒,可作为蔗糖的替代品,是糖尿病和肥胖症患者的理想天然甜味剂。葫芦二烯醇(cucurbitadienol)是葫芦烷型四环三萜皂苷(如罗汉果甜苷)生物合成的关键中间体,本身具有抗炎、抗肿瘤活性,但其在植物中的量很低。此外,罗汉果甜苷是我国特有植物罗汉果有效成分,种植成本高。因此,针对葫芦二烯醇及其产物的合成生物学研究竞相展开,编码葫芦二烯醇生物合成的葫芦二烯醇合酶基因相继从西葫芦、香瓜、罗汉果、黄瓜、药西瓜中克隆,并完成酵母表达。
Tang等[41]从罗汉果中克隆得到葫芦二烯醇生物合成所有反应的合成酶基因,并通过RACE技术获得罗汉果葫芦二烯醇合酶(SgCS)基因全长并在大肠杆菌、烟草中获得表达,通过强启动子过表达和RNAi干扰技术验证了该基因的功能。近期,通过构建SgCS基因酵母表达载体SgCS-pYES2,转化到酵母菌株IVF中,经过缺失培养基筛选得到阳性菌株,检测产物中有葫芦二烯醇产生。至此,已成功打通了一条葫芦二烯醇合成的新途径,为葫芦二烯醇的生物合成及工业化生产奠定了理论和实验基础,该成果已申请国家发明专利[59]。此外,Dai等[40]通过挖掘罗汉果转录组中的相关数据,从罗汉果中发现了参与罗汉果甜苷合成途径的2个重要基因SgCbQ和UGT74AC1。研究发现葫芦二烯醇合成酶SgCbQ在酿酒酵母GIL77中表达可生成单一的葫芦二烯醇产物,该物质为所有葫芦烷型三萜化合物的共同前体物质,而纯化的糖基转移酶UGT74AC1则可以在体外以罗汉果甜苷的共同前体物质罗汉果醇为底物,对其C3-OH进行糖基化生成甜苷IE。
4 结语与展望目前,三萜皂苷主要是从药用植物中直接提取分离得到,如齐墩果酸可以从橄榄油工业副产品提取得到,且产量相对较高,但人参皂苷等三萜皂苷的植物资源稀缺,且量极低,从植物提取难以满足需求。植物中三萜结构变化多样,容易受到季节、气候等环境影响,这些因素将影响提取产物质量稳定性。而且,大部分含三萜植物生长缓慢,这使农业种植生产成本高昂,经济效益低。通过合成生物学的设计,实现三萜皂苷活性成分的异源生物合成,将会是实现大规模生产三萜皂苷类活性成分的有效方法。青蒿素等活性成分研究结果显示了合成生物学的巨大优势和应用潜力,显示了合成生物学可以提供工业化生产的药物产品[65]。
三萜皂苷作为许多药用植物或中药材的重要有效成分之一,深入研究及阐明其生物合成途径及关键酶基因克隆的机制,尤其是多基因家族的OSCs,不论对其基础研究还是提高三萜皂苷有效成分的量,都有十分重要的理论及现实意义。目前,对三萜皂苷生物合成途径已有了大量的研究,关于三萜皂苷生物合成途径起始阶段和骨架构建阶段的研究比较成熟,但对于三萜骨架修饰阶段,因三萜皂苷结构多样、涉及修饰酶基因种类繁多,具体合成步骤还未清楚。因此,想要利用生物代谢工程的方法合成三萜皂苷,还需要对其碳环骨架建立后复杂的官能团反应进行深入研究[2]。三萜皂苷的合成生物学的研究也因此受到制约,但就像青蒿素的生物合成一样,可通过合成生物学的方法合成前体,再通过半合成的方法获得目标产物。如齐墩果酸可以通过合成生物学合成以进行药理活性研究,或作为底物半合成新活性物质。目前,齐墩果酸、熊果酸、桦木酸的半合成研究已经取得了显著进展,半合成衍生物的生物活性一般是自身的千倍以上,并在临床展开大量的体内、外研究[1, 60, 66]。
近年来,合成生物学正在蓬勃发展,成为一门新兴的学科。合成生物学在生产新能源及工业化学品、材料、疫苗等医药方面等具有广阔的前景。大量、高效而实用的合成生物学工具已经被开发和应用于药物和生物燃料的微生物合成。人们渴望能够像有机合成一样,根据需要设计、重组、构建并优化新的生物合成途径,利用微生物为细胞工厂,生产自然界来源受限的中药活性成分(如三萜皂苷)在内的有用物质。可以预见,随着合成生物学研究的不断成熟,医药领域的更多方面将被涉及,更高效地生产宿主将成功构建,生物医药生产过程的经济性也将得到明显提高,从而使生物医药能得到更广泛的应用。
| [1] | Liby K T, Yore M M, Sporn M B. Triterpenoids and rexinoids as multifunctional agents for the prevention and treatment of cancer[J]. Nat Rev Cancer, 2007, 7 (5) :357–369 . |
| [2] | 许晓双, 张福生, 秦雪梅. 三萜皂苷生物合成途径及关键酶的研究进展[J]. 世界科学技术-中医药现代化, 2014 (11) :2440–2448. |
| [3] | 陈颖, 孙海燕, 曹银萍. 三萜皂苷生物合成途径研究进展[J]. 中国野生植物资源, 2012 (6) :15–17. |
| [4] | 陈莉, 吴耀生. 三萜皂苷生物合成途径及相关酶[J]. 国外医药:植物药分册, 2004 (4) :156–161. |
| [5] | 凌焱, 段海清, 陈惠鹏. 合成生物学[J]. 军事医学科学院院刊, 2006 (6) :572–574. |
| [6] | 庄成乐, 黄卫人, 蔡志明. 合成生物学在医学及肿瘤治疗应用的研究前景[J]. 医学综述, 2015 (7) :1203–1205. |
| [7] | 黄璐琦, 高伟, 周雍进. 合成生物学在中药资源可持续利用研究中的应用[J]. 药学学报, 2014,49 (1) :37–43. |
| [8] | Paddon C J, Westfall P J, Pitera D J, et al. High-level semi-synthetic production of the potent antimalarial artemisinin[J]. Nature, 2013, 496 (7446) :528–532 . |
| [9] | 冯娇, 何珣, 陈怡露. 合成生物学在医药领域中的应用[J]. 东南大学学报:医学版, 2012,31 (2) :220–224. |
| [10] | Ro D K, Paradise E M, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast[J]. Nature, 2006, 440 (7086) :940–943 . |
| [11] | Martin V J, Pitera D J, Withers S T, et al. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids[J]. Nat Biotechnol, 2003, 21 (7) :796–802 . |
| [12] | Stahler P, Beier M, Gao X, et al. Another side of genomics:synthetic biology as a means for the exploitation of whole-genome sequence information[J]. J Biotechnol, 2006, 124 (1) :206–212 . |
| [13] | Mc Daniel R, Weiss R. Advances in synthetic biology:on the path from prototypes to applications[J]. Curr Opin Biotechnol, 2005, 16 (4) :476–483 . |
| [14] | 闫建俊, 白云凤, 张忠梁, 等. 合成生物学研究进展及应用前景[J]. 山西农业科学, 2011 (9) :1014–1016. |
| [15] | Ruder W C, Lu T, Collins J J. Synthetic biology moving into the clinic[J]. Science, 2011, 333 (6047) :1248–1252 . |
| [16] | Chen J, Wu X T, Xu Y Q, et al. Global transcriptome analysis profiles metabolic pathways in traditional herb Astragalus membranaceus (Bge.) Hsiao[J]. BMC Genomics, 2015, 16 (Suppl 7) :s15. |
| [17] | 熊绵靖, 唐其, 马小军. 罗汉果三萜皂苷生物合成规律研究探讨[J]. 广东药学院学报, 2011,27 (5) :543–548. |
| [18] | Laule O, Furholz A, Chang H S, et al. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana[J]. Proceed Nat Acad Sci USA, 2003, 100 (11) :6866–6871 . |
| [19] | Phillips D R, Rasbery J M, Bartel B, et al. Biosynthetic diversity in plant triterpene cyclization[J]. Curr Opin Plant Biol, 2006, 9 (3) :305–314 . |
| [20] | Moses T, Pollier J, Thevelein J M, et al. Bioengineering of plant (tri) terpenoids:from metabolic engineering of plants to synthetic biology in vivo and in vitro[J]. New Phytol, 2013, 200 (1) :27–43 . |
| [21] | Haralampidis K, Bryan G, Qi X, et al. A new class of oxidosqualene cyclases directs synthesis of antimicrobial phytoprotectants in monocots[J]. Proceed Nat Acad Sci USA, 2001, 98 (23) :13431–13436 . |
| [22] | Zhang H, Shibuya M, Yokota S, et al. Oxidosqualene cyclases from cell suspension cultures of Betula platyphylla var. japonica:molecular evolution of oxidosqualene cyclases in higher plants[J]. Biol Pharm Bull, 2003, 26 (5) :642–650 . |
| [23] | Kajikawa M, Yamato K T, Fukuzawa H, et al. Cloning and characterization of a cDNA encoding beta-amyrin synthase from petroleum plant Euphorbia tirucalli L.[J]. Phytochemistry, 2005, 66 (15) :1759–1766 . |
| [24] | Hayashi H, Huang P, Kirakosyan A, et al. Cloning and characterization of a cDNA encoding beta-amyrin synthase involved in glycyrrhizin and soyasaponin biosyntheses in licorice[J]. Biol Pharm Bull, 2001, 24 (8) :912–916 . |
| [25] | Iturbe-Ormaetxe I, Haralampidis K, Papadopoulou K, et al. Molecular cloning and characterization of triterpene synthases from Medicago truncatula and Lotus japonicus[J]. Plant Mol Biol, 2003, 51 (5) :731–743 . |
| [26] | Kushiro T, Shibuya M, Ebizuka Y. Beta-amyrin synthase-cloning of oxidosqualene cyclase that catalyzes the formation of the most popular triterpene among higher plants[J]. Eur J Biochem/FEBS, 1998, 256 (1) :238–244 . |
| [27] | Morita M, Shibuya M, Kushiro T, et al. Molecular cloning and functional expression of triterpene synthases from pea (Pisum sativum) new alpha-amyrin-producing enzyme is a multifunctional triterpene synthase[J]. Eur J Biochem/FEBS, 2000, 267 (12) :3453–3460 . |
| [28] | Basyuni M, Oku H, Tsujimoto E, et al. Triterpene synthases from the Okinawan mangrove tribe, Rhizophoraceae[J]. FEBS J, 2007, 274 (19) :5028–5042 . |
| [29] | Sawai S, Shindo T, Sato S, et al. Functional and structural analysis of genes encoding oxidosqualene cyclases of Lotus japonicus[J]. Plant Sci, 2006, 170 (2) :247–257 . |
| [30] | Scholz M, Lipinski M, Leupold M, et al. Methyl jasmonate induced accumulation of kalopanaxsaponin I in Nigella sativa[J]. Phytochemistry, 2009, 70 (4) :517–522 . |
| [31] | Wang Z, Guhling O, Yao R, et al. Two oxidosqualene cyclases responsible for biosynthesis of tomato fruit cuticular triterpenoids[J]. Plant Physiol, 2011, 155 (1) :540–552 . |
| [32] | Meesapyodsuk D, Balsevich J, Reed D W, et al. Saponin biosynthesis in Saponaria vaccaria. cDNAs encoding beta-amyrin synthase and a triterpene carboxylic acid glucosyltransferase[J]. Plant Physiol, 2007, 143 (2) :959–969 . |
| [33] | Hayashi H, Huang P, Takada S, et al. Differential expression of three oxidosqualene cyclase mRNAs in Glycyrrhiza glabra[J]. Biol Pharm Bull, 2004, 27 (7) :1086–1092 . |
| [34] | Shibuya M, Zhang H, Endo A, et al. Two branches of the lupeol synthase gene in the molecular evolution of plant oxidosqualene cyclases[J]. Eur J Biochem/FEBS, 1999, 266 (1) :302–307 . |
| [35] | Guhling O, Hobl B, Yeats T, et al. Cloning and characterization of a lupeol synthase involved in the synthesis of epicuticular wax crystals on stem and hypocotyl surfaces of Ricinus communis[J]. Archiv Biochem Biophysic, 2006, 448 (1/2) :60–72 . |
| [36] | Dhar N, Rana S, Razdan S, et al. Cloning and functional characterization of three branch point oxidosqualene cyclases from Withania somnifera (L.) Dunal[J]. J Biol Chem, 2014, 289 (24) :17249–17267 . |
| [37] | Shibuya M, Adachi S, Ebizuka Y. Cucurbitadienol synthase, the first committed enzyme for cucurbitacin biosynthesis, is a distinct enzyme from cycloartenol synthase for phytosterol biosynthesis[J]. Tetrahedron, 2004, 60 (33) :6995–7003 . |
| [38] | Davidovich-Rikanati R, Shalev L, Baranes N, et al. Recombinant yeast as a functional tool for understanding bitterness and cucurbitacin biosynthesis in watermelon (Citrullus spp.)[J]. Yeast, 2015, 32 (1) :103–114 . |
| [39] | Shang Y, Ma Y, Zhou Y, et al. Plant science. Biosynthesis, regulation, and domestication of bitterness in cucumber[J]. Science, 2014, 346 (6213) :1084–1088 . |
| [40] | Dai L, Liu C, Zhu Y, et al. Functional characterization of cucurbitadienol synthase and triterpene glycosyltransferase involved in biosynthesis of mogrosides from Siraitia grosvenorii[J]. Plant Cell Physiol, 2015, 56 (6) :1172–1182 . |
| [41] | Tang Q, Ma X, Mo C, et al. An efficient approach to finding Siraitia grosvenorii triterpene biosynthetic genes by RNA-seq and digital gene expression analysis[J]. BMC Genomics, 2011, 12 (1) :343. |
| [42] | Kim O T, Lee J W, Bang K H, et al. Characterization of a dammarenediol synthase in Centella asiatica (L.) Urban[J]. Plant Physiol Biochem:PPB/Soc Francaise Physiol Veget, 2009, 47 (11/12) :998–1002 . |
| [43] | Han J Y, Kwon Y S, Yang D C, et al. Expression and RNA interference-induced silencing of the dammarenediol synthase gene in Panax ginseng[J]. Plant Cell Physiol, 2006, 47 (12) :1653–1662 . |
| [44] | Wang L, Zhao S J, Cao H J, et al. The isolation and characterization of dammarenediol synthase gene from Panax quinquefolius and its heterologous co-expression with cytochrome P450 gene PqD12H in yeast[J]. Funct Integr Genomics, 2014, 14 (3) :545–557 . |
| [45] | 支伟特.三七中3个三七皂苷合成关键酶基因的克隆[D]. 昆明:云南农业大学, 2012. |
| [46] | Kolesnikova M D, Xiong Q, Lodeiro S, et al. Lanosterol biosynthesis in plants[J]. Archiv Biochem Biophysic, 2006, 447 (1) :87–95 . |
| [47] | Tabata S, Kaneko T, Nakamura Y, et al. Sequence and analysis of chromosome 5 of the plant Arabidopsis thaliana[J]. Nature, 2000, 408 (6814) :823–826 . |
| [48] | Herrera J B. Cloning and terization of an abies magnifica cycloartenol synthase cDNA[D]. Houston:Rice University, 1999. |
| [49] | Hayashi H, Hiraoka N, Ikeshiro Y, et al. Molecular cloning and characterization of a cDNA for Glycyrrhiza glabra cycloartenol synthase[J]. Biol Pharm Bull, 2000, 23 (2) :231–234 . |
| [50] | Hayashi H N, Ikeshiro Y, Yazaki K, et al. Molecular cloning of a cDNA encoding cycloartenol synthase from Luffa cylindrica (accession no. AB033334)[J]. Plant Physiol, 1999, 121 (4) :1383–1385 . |
| [51] | Morita M, Shibuya M, Lee M S, et al. Molecular cloning of pea cDNA encoding cycloartenol synthase and its functional expression in yeast[J]. Biol Pharm Bull, 1997, 20 (7) :770–775 . |
| [52] | Basyuni M, Oku H, Tsujimoto E, et al. Cloning and functional expression of cycloartenol synthases from mangrove species Rhizophora stylosa Griff. and Kandelia candel (L.) Druce[J]. Biosci Biotechnol Biochem, 2007, 71 (7) :1788–1792 . |
| [53] | Misawa N. Pathway engineering for functional isoprenoids[J]. Curr Opin Biotechnol, 2011, 22 (5) :627–633 . |
| [54] | Augustin J M, Kuzina V, Andersen S B, et al. Molecular activities, biosynthesis and evolution of triterpenoid saponins[J]. Phytochemistry, 2011, 72 (6) :435–457 . |
| [55] | Fukushima E O, Seki H, Ohyama K, et al. CYP716A subfamily members are multifunctional oxidases in triterpenoid biosynthesis[J]. Plant Cell Physiol, 2011, 52 (12) :2050–2061 . |
| [56] | 王冬, 王贝贝, 刘怡, 等. 齐墩果酸酵母细胞工厂的合成途径与发酵工艺优化[J]. 中国中药杂志, 2014,39 (14) :2640–2645. |
| [57] | Dai Z, Liu Y, Zhang X, et al. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides[J]. Metab Eng, 2013, 20 (5) :146–156 . |
| [58] | Dai Z, Wang B, Liu Y, et al. Producing aglycons of ginsenosides in bakers' yeast[J]. Sci Rep, 2014, 4 (4) :3698. |
| [59] | 马小军, 赵欢, 唐其. 一种罗汉果SgCS基因的突变体及其用途:中国, 104017798A[P]. 2014. |
| [60] | Liby K T, Sporn M B. Synthetic oleanane triterpenoids:multifunctional drugs with a broad range of applications for prevention and treatment of chronic disease[J]. Pharmacol Rev, 2012, 64 (4) :972–1003 . |
| [61] | 孟艳秋, 聂慧慧, 王晓晨, 等. 齐墩果酸衍生物的合成及抗肿瘤活性的研究[J]. 药学学报, 2011,22 (10) :1215–1220. |
| [62] | Hong D S, Kurzrock R, Supko J G, et al. A phase I first-in-human trial of bardoxolone methyl in patients with advanced solid tumors and lymphomas[J]. Clin Cancer Res:Official J Am Assoc Cancer Res, 2012, 18 (12) :3396–3406 . |
| [63] | Tsao T, Kornblau S, Safe S, et al. Role of peroxisome proliferator-activated receptor-gamma and its coactivator DRIP205 in cellular responses to CDDO (RTA-401) in acute myelogenous leukemia[J]. Cancer Res, 2010, 70 (12) :4949–4960 . |
| [64] | Kirby J, Romanini D W, Paradise E M, et al. Engineering triterpene production in Saccharomyces cerevisiae-betaamyrin synthase from Artemisia annua[J]. FEBS J, 2008, 275 (8) :1852–1859 . |
| [65] | Keasling J D. Synthetic biology and the development of tools for metabolic engineering[J]. Metab Eng, 2012, 14 (3) :189–195 . |
| [66] | Salvador J A, Moreira V M, Goncalves B M, et al. Ursane-type pentacyclic triterpenoids as useful platforms to discover anticancer drugs[J]. Nat Prod Rep, 2012, 29 (12) :1463–1479 . |
 2016, Vol. 47
2016, Vol. 47


