2. 湖南农业大学兽用中药资源与中兽药创制国家地方联合工程研究中心, 湖南 长沙 410128 ;
3. 植物功能成分利用协同创新中心, 湖南 长沙 410128 ;
4. 香港浸会大学中医药学院, 香港 九龙
2. National and Provincial Union Engineering Research Center for the Veterinary Herbal Medicine Resources and Initiative, Hunan Agricultural University, Changsha 410128, China ;
3. Hunan Co-Innovation Center for University of Botanicals Functional Ingredients, Hunan University of Chinese Medicine, Changsha 410128, China ;
4. School of Chinese Medicine, Hong Kong Baptist University, Kowloon, Hong Kong SAR
博落回Macleaya cordata (Willd.) R. Br. 是罂粟科(Papaveraceae)多年生草本植物,其带根全草属于传统草药[1-2]。现代药理研究表明,博落回具有抗菌、抗炎、改善肝功能、抗肿瘤、杀虫等活性[3]。以其提取物制成的注射液对猪大肠杆菌病和传染性肠胃炎等具有特效[4]。国内研发的美佑壮(Sangravit®)已经被农业部批准为饲料添加剂,因具有抗炎促生长作用,被用于替代饲用抗生素。原阿片碱(protopine,PRO)、别隐品碱(allocryptopine,ALL)、血根碱(sanguinarine,SG)、白屈菜红碱(chelerythrine,CHE)、二氢白屈菜红碱(dihydrochelerythrine,DHCHE)、二氢血根碱(dihydrosanguinarine,DHSG)等异喹啉类生物碱被认为是其主要活性成分[5]。
目前,国内外博落回研究主要集中在成分[6-7]、药理[8-9]等方面,而关于活性成分在植株体内的组织分布规律少见报道。本研究团队在前期利用改良碘化铋钾结合荧光显微镜法对博落回体内生物碱进行了组织化学定位研究,但只能根据显色深浅来进行相对定量,方法专属性不强,不能准确定位某一种生物碱在植物组织中的分布[10]。激光显微切割结合液相色谱-质谱联用技术能将同一类细胞用激光从植物切片中分离出来,经适当样本前处理,采用液相色谱-质谱联用仪对其进行定性和定量分析。Liang[11-12]、Yi[13]和Chen[14]等运用此法对青风藤、大黄、柴胡及射干等药材次生代谢产物进行了定性、定量研究,为药材品质评价和合理利用提供了科学依据。本研究拟建立基于激光显微切割与高效液相串联三重四级杆质谱联用仪(high performance liquid chromatographytriple quadrupole,HPLC- QQQ)
相结合的定量分析方法,对不同时期博落回根不同组织中的PRO、ALL、SG、CHE、DHCHE及DHSG的量进行分析检测,阐明目标化合物在不同组织的分布,以期为进一步博落回根中生物碱合成、转运和贮存机制研究奠定基础。
1 材料与仪器 1.1 材料采自国家中药材生产(湖南)技术中心博落回改良种植基地苗期、花期、果期及果后期的两年生博落回植株根,经湖南农业大学曾建国教授鉴定为罂粟科博落回属植物博落回Macleaya cordata (Willd.) R. Br. 的新鲜根。
1.2 仪器和试剂美国Agilent公司1260液相色谱-6460三重四极杆串联质谱仪,配有电喷雾离子源(ESI);冷冻切片机(英国Thermo Shandon公司);显微镜滑动钢片(德国Leica Microsystems);Leica LMD 7000显微镜系统(德国Leica公司);AE204型精密天平(上海梅特勒托利多仪器公司),PRO、SG和CHE购自中国食品药品检定研究院。ALL、DHC HE和DHSG(自制,质量分数大于98.0%)。乙腈和甲醇(色谱级,德国Merck公司);甲酸(色谱级,美国Tedia公司);超纯水。
2 方法 2.1 供试品溶液制备新鲜根用冷冻切片机在−20 ℃的条件下切成30 μm的薄片,并迅速转移至显微镜滑动钢片的非荧光PET膜上。载样钢片于Leica LMD 7000显微镜系统荧光模式下观察并切割:DPSS激光束波长处于349 nm,光圈35,切割速度3,能量50~60 μJ。每个组织的切割面积约1.5×106 μm2,切割组织在重力的作用下掉入500 μL的离心管(Leica,德国)管帽中。4 ℃,1×104 r/min离心10 min将组织样本转移至离心管底部,加入100 μL甲醇,超声提取30 min。1×104 r/min,4 ℃再次离心10 min,移取90 μL的上清液至液相小瓶的内插管中,储存于4 ℃的冰箱,备用。
2.2 对照品溶液制备精密称取PRO、ALL、SG、CHE、DHCHE、DHSG对照品适量,分别置于量瓶中,加入甲醇溶解并稀释至刻度,得对照品储备液。精密吸取上述6种对照品溶液混合制备成混合对照品储备液,PRO、ALL、SG、CHE、DHCHE、DHSG质量浓度分别为1 025.6、935.9、520.8、529.7、103.9、109.4 ng/mL。
2.3 HPLC-MS/MS条件色谱条件:色谱柱为Agilent ZORBAX Extend C18(100 mm×2.1 mm,3.5 μm,美国);柱温为40 ℃;进样量为3 μL;流动相为0.2%的甲酸水溶液(A)和乙腈(B);梯度洗脱程序为0~5 min,15%~28% B;5~10 min,28%~100% B;10~15 min,100% B;体积流量为0.4 mL/min。
质谱参数:离子源为电喷雾离子源,采用正离子扫描模式;雾化气为氮气;雾化气压力为379 kPa;检测方式为多反应离子监测(MRM);干燥气温度为320 ℃;干燥气体积流量为12 L/min;毛细管电压为+3 500 V。6种生物碱的定性和定量离子对及相关参数见表 1。
|
|
表 1 目标化合物的质谱参数 Table 1 MS parameters for targeted compounds |
2.4 HPLC-MS/MS方法学考察 2.4.1 标准曲线的绘制
精密吸取7个不同质量浓度的混合对照品溶液3 μL,进样,记录各待测组分的色谱峰面积,以各成分的质量浓度为横坐标(X),各成分的峰面积为纵坐标(Y),利用最小二乘法进行线性回归分析,得各化合物标准曲线,见表 2。
|
|
表 2 标准曲线方程及其线性范围和相关系数 Table 2 tandard curve equations,linear ranges,and correlation coefficients |
2.4.2 定量限和检出限
将对照品溶液进样分析,测定信噪比(S/N),将对应的S/N=10和S/N=3的各标准溶液质量浓度分别作为定量限(LOQ)、检出限(LOD)。PRO、ALL、SG、CHE,DHCHE和DHSG LOD分别为0.013、0.018、0.056、0.285、0.006、0.007 ng/mL,LOQ分别为0.066、0.092、0.56、0.57、0.013、0.013 ng/mL。
2.4.3 精密度试验取含PRO、ALL、SG、CHE、DHCHE及DHSG质量浓度依次为51.3、46.8、26.0、26.5、5.2、5.5 ng/mL的对照品溶液,连续进样3 d,每次连续进样5针,记录各峰面积,计算峰面积的RSD,考察仪器的日内和日间精密度。日内精密度的RSD在0.7%~1.6%,日间精密度的RSD为1.8%~2.4%。
2.4.4 稳定性试验取样本3木质部维管束组织,按“2.1”项方法制备,于室温条件下放置,分别在0、2、4、8、12、24、48 h进样,记录各待测物各时间点的峰面积,分别计算峰面积RSD,考察样本的稳定性。48 h内的稳定性试验的RSD为4.7%~8.4%。
2.4.5 重复性试验选取样本3连续切3片,每个横切片上挑选3个以上的点激光切割木质部维管束1.5×106 μm2,获得3个重复性考察样本,按“2.1”项样本制备方法制得重复性试验供试品溶液,精密吸取3 μL进样,记录各样本中各待测物的峰面积,分别计算RSD均低于13.2%。
2.4.6 加样回收率试验选取样本3连续切6片,每个横切片上挑选3个以上的点激光切割木质部维管束7.5×105 μm2,每个回收率样本中加入PRO、ALL、SG、CHE、DHCHE及DHSG对照品,按“2.1”项制备,记录各峰面积,计算峰面积的RSD,考察方法的准确性。加样回收率为85.1%~133.9%,RSD为9.4%~20.7%。
上述结果表明基于HPLC-MS/MS的定量分析方法灵敏度高、稳定性好、准确可靠。由于组织细胞中代谢的差异性,切割的组织样本中的代谢物水平存在不均匀性,并且切割样本在微量水平,因此本研究中重复性试验和加样回收率试验的RSD值相对较大,但认为仍在可以接受的范围内[11-12]。
2.5 切割样本中目标化合物的定量分析检测将各样本切割下来的组织样品,按“2.1”项中的方法得到供试品溶液,经色谱柱分离后注入质谱仪进行定量分析检测,所得峰面积代入相应的标准曲线,计算单位面积中各目标生物碱的量。
3 结果与分析 3.1 HPLC-MS/MS分析方法建立在色谱分离条件优化过程中,流动相酸度的调节可改善色谱峰的峰形及分离度,并对质谱离子源中化合物的离子化效率产生影响。本研究通过对流动相的A和B相中甲酸的不同添加比例进行考察,最终发现0.2%甲酸水溶液-乙腈效果最佳。随后对不同的柱温30、35、40、45 ℃对色谱分离效果的影响进行了考察,结果表明当柱温设定为40 ℃时,色谱峰的分离度最佳。
将色谱条件和质谱参数确定后,各生物碱对照品溶液不经色谱柱分离分别直接注入质谱仪,在正离子检测方式下对各目标化合物进行一级质谱扫描,得到每种生物碱的分子离子数据,继续对每种生物碱的分子离子进行二级质谱扫描,得到相应的子离子信息。随即对各目标化合物的源内碎裂电压、碰撞能量(CE)等参数进行优化,使每种生物碱的子离子的强度达到最大,最后选择各目标化合物的定性和定量离子对,建立了各目标生物碱化合物的MRM定量分析方法。如图 1所示,各目标化合物具有良好的峰形和分离度。
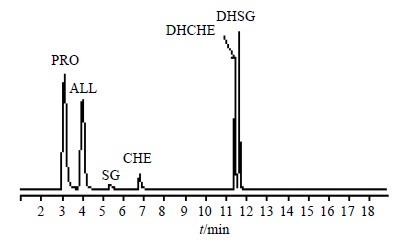
|
图 1 PRO、ALL、SG、CHE、DHCHE及DHSG的MRM模式下的代表色谱图 Fig.1 Represent MRM chromatogram for PRO,ALL,SG,CHE,DHCHE,and DHSG |
3.2 组织荧光特点及激光切割
根据在显微镜下观察到的样本切片的横切面,将其分成木栓层、皮层、韧皮部、木质部维管束及木射线(图 2-B)。可看出博落回根不同组织具有不同的形态学特征,如木栓层由几列排列整齐的细胞组成,皮层较宽广且细胞疏松,韧皮部狭窄且细胞较小,木质部维管束和木射线相对较宽阔。在荧光显微镜下不同的组织显示出不同的荧光,如木栓层显示红棕色荧光,皮层显示黄偏蓝色荧光,韧皮部显示黄色荧光,木质部维管束显示出亮橙色荧光,而木射线则显示出浅蓝色荧光(图 2-B)。
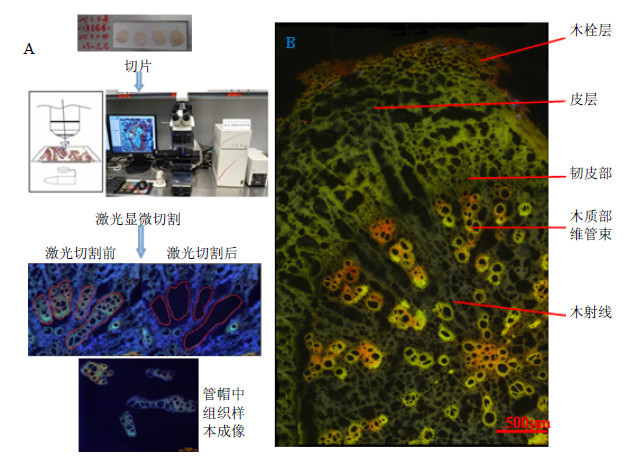
|
图 2 激光显微切割过程及博落回根横切面在紫外显微镜下的微观成像 Fig.2 Process of laser-microdissection and microscopic imaging of cross section from M. cordata root under UV microscopy |
据文献报道[9, 11],植物组织呈现的荧光颜色常常与其中所含代谢产物的类型和量相关。值得注意的是,在博落回根整个切片中木栓层和木质部维管束呈现出最强的荧光,暗示这2个组织中生物碱的类型和量可能具有其特殊性。本研究结合不同组织的形态学特点及其在荧光显微镜下呈现不同颜色将其辨认,并用激光将其切割开来(图 2-A)。
3.3 切割组织样品中各目标生物碱的测定利用上述建立的HPLC-MS/MS定量分析方法,对切割样品中各目标生物碱的进行检测,所得结果见表 3。从表 3中可以看出,同一组织在不同生长时期的植株根中所含同一目标生物碱的量不同,如木栓层中PRO的单位面积量在两年生植株根的苗期为0.041 μg/mm2,在其花期为0.18 μg/mm2;不同组织在同一生长时期植株根中同一目标生物碱的单位面积量也不同,如在两年生根的苗期PRO在木栓层、皮层、韧皮部、木质部维管束及木射线中的量分别为0.041、0.040、0.029、0.078、0.055 μg/mm2。但总体来说,各个生长期6种生物碱的量在木栓层和木质部维管束中高于其他组织,结合在荧光显微镜下观察到的木栓层和木质部较其他组织呈现更强荧光这一结果,推测可能博落回根显示出的荧光强度与其中所含PRO、ALL、SG、CHE、DHCHE和DHSG的量呈正相关。另外,本研究团队前期利用改良碘化铋钾结合荧光显微镜法对博落回根中生物碱进行了组织化学染色,发现沉淀反应后维管柱的导管附近颜色更深的结果与本研究相一致[10]。
|
|
表 3 博落回根不同生长期、不同切割组织样品中目标化合物的量 Table 3 Contents of targeted compounds in different dissected tissue samples from various growing stages M. cordata roots |
4 讨论
本研究建立了激光显微切割与HPLC-MS/MS技术相结合的博落回根中生物碱的组织化学定量分析方法,经系统的方法学考察,结果表明该方法具有专属强、灵敏度高及准确可靠的特点,能够满足激光显微切割所获得的微量或痕量样品中的生物碱类成分的定量分析检测。利用该定量分析方法对博落回根中木栓层、皮层、韧皮部、木质部维管束和木射线中的PRO、ALL、SG、CHE、DHCHE和DHSG的量进行了检测,发现这6种生物碱主要积累在木栓层及木质部维管束。
早期研究者常常利用组织化学染色的方法对植物组织中的次生代谢产物进行组织化学研究[15-18],尽管该方法快速、简单,然而有些化学反应专属性并不强,容易呈现假阳性反应,如用碘化铋钾定位植物组织中的生物碱,蛋白质、多肽、鞣质等常产生干扰反应而影响研究结果的准确性。并且化学染色法只能根据显色的颜色深浅来相对定量某类次生代谢产物在组织中的分布,不能定位具体一种化合物[15-16],缺乏客观数据显示的差异。本研究利用基于激光显微切割与HPLC-MS/MS技术相结合的方法实现了组织中代谢产物的特异性定量分析,能做到定性与定量相结合,为博落回根组织中生物碱的合成积累研究提供了基础。
| [1] | Psotova J, Vecera R, Zdarilova A, et al. Safety assessment of sanguiritrin, alkaloid fraction of Macleaya cordata, in rats[J]. Vet Med, 2006, 51 (4) :145–155 . |
| [2] | 田书音, 李冰, 朱宇旌. 博落回生物碱的研究进展[J]. 养殖与健康, 2010,13 (11) :65–68. |
| [3] | 程辟, 曾建国. 苯并啡啶类生物碱及其衍生物合成研究进展[J]. 有机化学, 2012,32 (9) :1605–1619. |
| [4] | 郭小青, 唐莉苹, 聂建超, 等. 博落回的药理作用及其在动物保健中的应用[J]. 中国动物保健, 2005,16 (5) :34–35. |
| [5] | Zeng J, Liu Y, Liu W, et al. Integration of transcriptome, proteome and metabolism data reveals the alkaloids biosynthesis in Macleaya cordata and Macleaya microcarpa[J]. PLoS One, 2013, 8 (1) :36–38 . |
| [6] | Qing Z X, Cheng P, Liu X B, et al. Structural speculation and identification of alkaloids in Macleaya cordata fruits by high-performance liquid chromatography/quadrupoletime-of-flight mass spectrometry combined with a screening procedure[J]. Rapid Commun Mass Spectr, 2014, 28 (9) :1033–1044 . |
| [7] | Chen Y Z, Liu G Z, Shen Y, et al. Analysis of alkaloids in Macleaya cordata (Willd.) R. Br. using high-performance liquid chromatography with diode array detection and electrospray ionization mass spectrometry[J]. J Chromatogr A, 2009, 1216 (11) :2104–2110 . |
| [8] | 周农林, 于泉林, 武宝悦, 等. 博落回根提取物对黄粉虫的触杀活性[J]. 安徽农业科学, 2012,40 (7) :4041–4043. |
| [9] | Zhong M, Li G Y, Zeng J G. Evaluation of molluscicidal activities of benzo[c]phen-anthridine alkaloids from Macleaya cordata (Willd) R. Br. on snail hosts of Schistosoma japonicum[J]. J Med Plants Res, 2011, 5 (4) :521–526 . |
| [10] | 程巧, 乐捷, 曾建国. 药用植物博落回形态与发育解剖学研究[J]. 植物学报, 2015,50 (1) :72–82. |
| [11] | Liang Z, Sham T, Yang G, et al. Profiling of secondary metabolites in tissues from Rheum palmatum L. using laser microdissection and liquid chromatography mass spectrometry[J]. Anal Bioanal Chem, 2013, 405 (12) :4199–4212 . |
| [12] | Liang Z, Kayan Oh, Wang Y, et al. Cell typespecific qualitative and quantitative analysis of saikosaponins in three Bupleurum species using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pham Biomed Anal, 2014, 97 (3) :157–165 . |
| [13] | Yi L, Liang Z T, Peng Y, et al. Tissue-specific metabolite profiling of alkaloids in Sinomenii Caulis using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Chromatogr A, 2012, 1248 (6) :93–103 . |
| [14] | Chen Y J, Liang Z T, Zhu Y, et al. Tissue-specific metabolites profiling and quantitative analyses of flavonoids in the rhizome of Belamcanda chinensis by combining laser-microdissection with UHPLC-Q/TOFMS and UHPLC-QqQ-MS[J]. Talanta, 2014, 130 (2) :585–597 . |
| [15] | 康杰芳, 李娜, 袁琴琴, 等. 银线草营养器官结构及主要成分的组织化学定位[J]. 西北植物学报, 2010,30 (12) :2412–2416. |
| [16] | 彭华胜, 刘文哲, 胡正海, 等. 栽培太子参块根中皂苷的组织化学定位及其含量变化[J]. 分子细胞生物学报, 2009,42 (1) :1–6. |
| [17] | 闫晋晋, 慕小倩, 崔宏安, 等. 乌头营养器官中生物碱组织化学与积累动态研究[J]. 西北植物学报, 2008,28 (1) :85–89. |
| [18] | 李玉萍, 龙绛雪, 曹福祥, 等. 蛇根木根部生物碱积累的组织化学定位研究[J]. 中南林业科技大学学报, 2010,30 (9) :157–161. |
 2016, Vol. 47
2016, Vol. 47


