2. 河北医科大学第四医院 科研中心, 河北 石家庄 050011 ;
3. 承德医学院附属医院 输血科, 河北 承德 067000
2. Research Center, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China ;
3. Affiliated Hospital of Chengde Medical University, Chengde 067000, China
恶性黑素瘤是死亡率最高的皮肤恶性肿瘤[1],恶性程度高且广泛耐药,转移早,进展快,平均生存期为8~9个月,3年生存率不到15%[2],急需寻找一种新的有效治疗恶性黑素瘤的方法[3]。诱导恶性肿瘤细胞向正常或接近正常的细胞方向分化逆转,作为恶性肿瘤的一种新型治疗方法,为抗肿瘤研究开辟了一条崭新的途径。我国丰富的中药资源是开发肿瘤分化诱导剂的优势之一,很多动、植物中提取的生物活性成分都被证实具有分化诱导作用,研究显示,人参总皂苷可以诱导人肝癌细胞分化[4];葛根有效成分S86019可使HL-60细胞沿粒细胞系统定向分化[5]。
木鳖子Momordicae Semen为葫芦科植物木鳖Momordica cochinchinensis (Lour.) Spreng. 的成熟种子,始载于宋代《开宝本草》,具有消肿散结、祛毒之功效,用于治疗痈肿、疔疮和无名肿毒等。本课题组前期研究发现,木鳖子醇提物具有抑制黑素瘤B16细胞增殖和诱导其分化的作用,且以对羟基桂皮醛(p-hydroxycinnamaldehyde,PHD)成分的抑瘤效果最为明显[6-8]。研究还发现,PHD能降低p-ERK蛋白的表达水平,提高p-P38蛋白的表达水平,激活黑色素合成相关基因,从而发挥诱导细胞分化的作用[9-10]。本研究旨在探讨木鳖子单体化合物PHD体内对黑素瘤细胞增殖的影响及其可能的作用机制,为开发肿瘤分化诱导剂提供依据。
1 材料 1.1 药品与试剂木鳖子购自北京同仁堂药店,经河北医科大学药学院生药学教研室杜肖娜副教授鉴定为葫芦科植物木鳖Momordica Cochinensis (Lour) Spreng的成熟种子;PHD由华北制药集团新药研究开发有限责任公司从木鳖子中提取并鉴定,质量分数≥96%。RPMI 1640培养液和0.25%胰蛋白酶购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;青霉素、链霉素购自上海博光生物科技有限公司;MTS购自美国Sigma公司;免疫组织化学SP法检测试剂盒(包含生物素标记的山羊抗兔二抗及辣根过氧化物酶标记的链酶卵白素三抗)和二氨基联苯胺(diaminobenzidine,DAB)试剂盒均购自北京中杉金桥生物技术有限公司;兔抗人酪氨酸酶(Tyr)、MMP-9和S-100B抗体购自美国Santa Cruz 公司;兔抗人p-P38和p-ERK抗体购自美国CST公司。
1.2 主要仪器台式离心机,德国Heraeus公司;LH50A型倒置相差显微镜,日本Olympus公司;无菌滤器,日本Millipore公司;JA5003电子分析天平,上海精科天平厂;全自动高压蒸汽消毒器,日本三洋公司;SCR20B 型低温高速离心机,日本日立公司;HT2型酶标仪,奥地利Anthos公司。
1.3 细胞小鼠黑素瘤B16细胞株购自中国科学院上海细胞库。
1.4 实验动物C57BL/6小鼠购自北京维通利华实验动物技术有限公司,共12只,均为雄性,5~6周龄,体质量为(22.1±0.3)g。所有小鼠均在河北医科大学第四医院动物实验中心无特定病原体级屏障系统(SPF)条件下饲养,动物使用许可证号SYXK(冀)2013-0051。本研究设计已经河北医科大学动物管理使用委员会和伦理委员会批准。
2 方法 2.1 PHD对细胞增殖的影响小鼠黑素瘤B16细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液,置于37 ℃、5% CO2的条件下培养。每1~2 d换液1次,细胞生长至融合度为70%~80%时,用0.25%胰蛋白酶消化细胞并传代。取对数生长期黑素瘤B16细胞,制成1×105/mL细胞悬液,接种于96孔板中,每孔90 μL,待细胞贴壁后,各孔加0、100、200、400 μmol/L PHD 10 μL,使其终浓度为0、10、20、40 μmol/L。37 ℃、5% CO2条件下作用24、48、72 h,每组设3个复孔。分别于药物作用B16细胞24、48、72 h后,每孔加入10 μL MTS,继续培养2.5 h后,用酶标仪于490 nm波长检测各孔吸光度(A)值。计算细胞增殖率。
细胞增殖率=实验组A值/对照组A值
2.2 PHD对B16细胞形态的影响取对数生长期的B16细胞,调整细胞浓度为5×104/mL,接种于6孔培养板中,每孔2 mL,待细胞贴壁后,分别用终体积分数0.01%的二甲基亚砜(DMSO)和20 μmol/L PHD作用B16细胞48 h,倒置相差显微镜下观察B16细胞形态的变化,并计数2组的细胞数量。
2.3 PHD对黑素瘤B16移植性肿瘤小鼠的影响 2.3.1 模型制备、分组及给药于C57BL/6小鼠右侧腋窝处sc 0.1 mL 黑素瘤B16细胞(含1×106个细胞),当肿瘤体积增长至约50 mm3时,将小鼠随机分为2组,每组6只。PHD组每只小鼠ip 2 mg/kg PHD(预试验显示2 mg/kg有效),模型组小鼠sc相同体积的0.9%氯化钠溶液,每2天给药1次,共12次22 d;从注射药物的第5天开始,每3天测量1次肿瘤长短径,按公式计算肿瘤体积:肿瘤体积=1/2×长径×短径2。末次注射药物后第4天,即药物治疗第25天时以颈椎脱位法处死小鼠,切取移植瘤组织标本,称取瘤体质量,并拍照。
2.3.2 免疫组织化学法检测Tyr、MMP-9、S-100B、p-P38和p-ERK蛋白表达裸鼠移植瘤标本用适量中性甲醛溶液固定24 h,然后经固定、脱水和浸蜡后,行包埋及切片,置于65 ℃烤箱中30 min,以常规脱蜡,最终制成5 μm厚的病理切片,然后按SP免疫组织化学试剂盒说明书所述方法检测Tyr、MMP-9、S-100B、p-P38和p-ERK蛋白的表达情况。生物素标记的山羊抗兔二抗和辣根过氧化物酶标记的链酶卵白素三抗均为试剂盒中的原液。DAB试剂显色后,用苏木精对比染色,中性树胶封片。在光学显微镜下观察阳性细胞为相比核/细胞质着色,呈棕黄色颗粒状分布。选取5个高倍视野,每个视野计数500个细胞,以阳性细胞所占百分率进行评分:≤10%为0分,>10%且≤50%为1分,>50%且≤75%为2分,>75%为3分;再按染色强度进行评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。上述2项评分相加:0分为“−”,1~2分为“+”,3~4分为“++”,5~6分为“+++”。将“−”和“+”定义为阴性表达,“++”和“+++”定义为阳性表达。
2.3.3 苏木精-伊红(HE)染色法检测肝和肺组织的细胞形态变化取2组用药治疗后小鼠肿瘤、肝和肺组织,按“2.3.2”项方法制成石蜡切片。然后行常规脱蜡水化,苏木精染色5 min,0.5~1%盐酸(70%乙醇配制)分化30 s,酸化伊红对比染色细胞核1 min。最后常规脱水、透明和中性树胶封固,置于光学显微镜下观察细胞形态的变化。
2.4 统计学方法 应用SPSS 13.0统计学软件对实验结果进行统计学分析。以上实验均独立重复3次,计量资料以
10、20、40 μmol/L PHD处理B16细胞24、48和72 h后,对B16细胞增殖具有明显的抑制作用。其中10 μmol/L PHD处理B16细胞72 h的抑制率显著高于24 h和48 h的抑制率(P<0.01),而40 μmol/L PHD处理B16细胞24 h的抑制率显著高于10、20 μmol/L组(P<0.05、0.01),结果见图 1。以上结果表明,PHD在体外可抑制小鼠黑素瘤B16细胞的增殖,且具有时间和浓度依赖性。
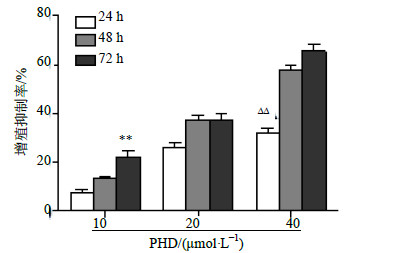
|
图 1 PHD对黑素瘤B16细胞增殖的抑制作用 (  |
与0.01% DMSO处理组相比,20 μmol/L PHD处理B16细胞48 h后细胞数量[(1.30±0.22)×105],显著低于对照组[(4.50±0.36)×105](P<0.01);且细胞体积增大为梭形,排列有序,成纤维状生长,多数细胞出现树突状结构,为典型的细胞分化形态(图 2),证明PHD可能诱导黑素瘤B16细胞的分化,与前期研究结果一致[8]。
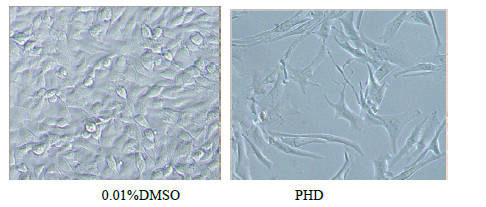
|
图 2 PHD对小鼠黑素瘤B16细胞形态的影响 Fig.2 Effects of PHDon morphologic change of melanoma B16 cells |
3.2 PHD对小鼠体内移植瘤形成的抑制作用
与模型组比较,PHD能够明显抑制肿瘤细胞在小鼠体内的生长。模型组小鼠的肿瘤体积增长速度较快,而2 mg/kg PHD治疗组小鼠肿瘤体积增长缓慢,在治疗后第11天后增长速度开始慢于模型组。治疗结束后,PHD治疗组小鼠的肿瘤体积和质量均明显低于模型组(P<0.001),见图 3。以上结果表明,PHD能够明显抑制B16细胞在小鼠体内的生长。
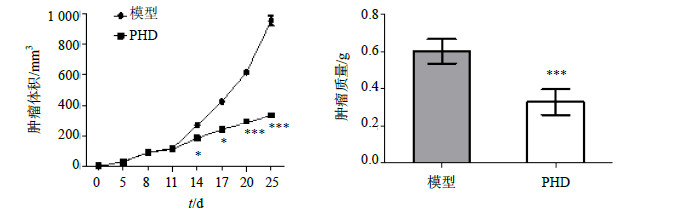
|
图 3 PHD对小鼠体内黑素移植瘤生长的影响 (  |
3.3 PHD对小鼠体内Tyr、MMP-9、S-100B、p-P38和p-ERK蛋白表达的影响
免疫组织化学染色法检测结果(图 4)显示,Tyr和p-P38蛋白在PHD治疗组中阳性表达率分别为100%(6/6)和83%(5/6),均明显高于模型组的17%(1/6)(P<0.05),MMP-9、S-100B和p-ERK蛋白在PHD治疗组中阳性表达率均为17%(1/6),明显低于模型组的100%(6/6)、100%(6/6)和83%(5/6)(P<0.05)。
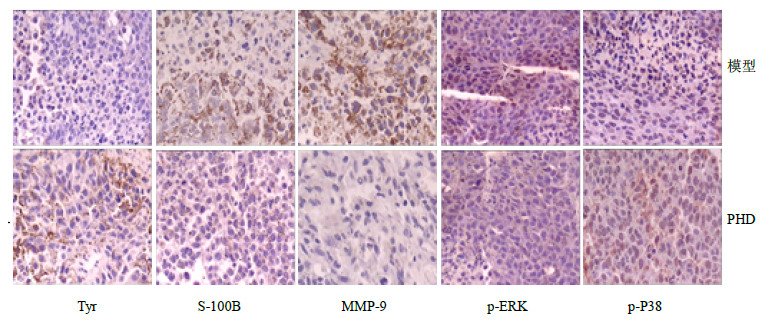
|
图 4 免疫组织化学法检测PHD治疗后小鼠体内移植瘤细胞相关蛋白的表达 Fig.4 Expression of protein in xenograft tumors treated with PHD detected by immunohistochemistry |
3.4 PHD对移植瘤小鼠肝和肺组织形态的影响
HE染色结果(图 5)显示,PHD治疗组小鼠肝组织内可见肝细胞大小均一,排列紧密整齐,无明显的极性变化;模型组肺组织中有明显的肿瘤结节,而PHD治疗组小鼠的肝和肺中均未见明显的组织病理学变化,表明PHD可能对小鼠没有潜在的肝毒性,并可抑制黑色素瘤向肺组织的转移。
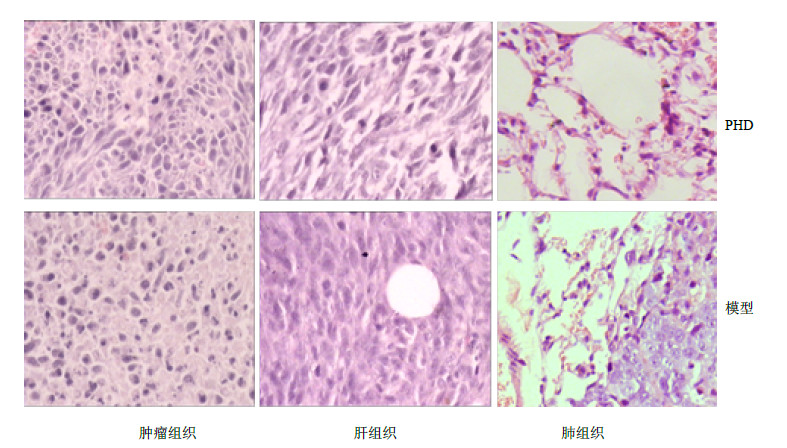
|
图 5 HE染色法检测PHD治疗后小鼠体内肝、肺组织形态学变化 Fig.5 Morphological changes of liver and lung tissues in xenograft tumors treated with PHD detected by HE staining |
4 讨论
近年来,天然药物抗肿瘤新药开发的品种迅速增多,发挥的治疗作用也涉及到各个方面。本课题组前期研究结果[9-10]显示,木鳖子PHD能够显著抑制B16细胞的生长并能够诱导其分化。在前期研究基础上,本研究探索了PHD对小鼠体内黑素瘤细胞移植瘤的抑制作用和初步机制。
本研究结果表明,PHD可明显抑制黑素瘤B16细胞的体外增殖,并且治疗组B16细胞出现典型的细胞分化状态,与以往研究结果相符。黑色素的量增加是黑素瘤细胞功能分化的标志之一[11],而在黑色素细胞中,Tyr控制黑色素的合成,是黑色素合成通路中的关键酶。S-100B蛋白是评价黑素瘤预后的一种生物标记物[12-13],本研究结果发现,PHD在体内可降低黑色素瘤组织中S-100B和MMP9蛋白的表达水平,升高Tyr蛋白的表达水平,进一步证实PHD不但能够诱导黑素瘤细胞向正常黑色素细胞方向分化,而且能够明显降低已经分化细胞的恶性程度,从而发挥体内的抗肿瘤作用。
MAPKs为丝氨酸、苏氨酸蛋白激酶的一个家族,调节细胞的凋亡、增殖及分化等,在黑色素细胞生物活性中具有重要作用[14-15]。MAPKs超家族中3个特征性亚家族为Erks、JNK和P38 MAPKs。有研究发现[16],P38-MAPKs通路活化与黑色素合成增加有关,P38-MAPKs 的级联反应参与了B16的黑色素的合成。本研究结果表明,PHD能够降低体内黑色素瘤组织中p-ERK蛋白的表达水平,升高p-P38蛋白的表达水平,说明PHD可能通过增强P38通路活性,降低ERK通路活性而激活黑色素合成相关基因,促进小鼠黑素瘤B16细胞的分化。本研究结果还显示,与模型组相比,PHD治疗组小鼠的肝和肺组织均未发现明显的病理学改变,证明PHD有望成为一种较安全的抗癌药物。
综上所述,PHD在体内能够抑制小鼠黑素瘤B16细胞增殖和分化,其机制可能与MAPK通路相关,为PHD应用于黑素瘤治疗提供了理论基础。关于PHD诱导B16细胞分化的深入作用机制,尚有待进一步研究。
| [1] | Prignano F, Coronnello M, Pimpinelli N, et al. Immunophenotypical markers, ultrastructure and chemosensitivity profile of metastatic melanoma cells[J]. Cancer Lett, 2002, 186 (2) :183–192 . |
| [2] | Balch C M, Gershenwald J E, Soon S J, et al. Final version of 2009 AJCC melanoma staging and classication[J]. J Clin Oncol, 2009, 27 (36) :6199–6206 . |
| [3] | 田红, 肖桂芝, 田苗, 等. 黑色素瘤治疗药物的研究进展[J]. 现代药物与临床, 2015,30 (7) :890–896. |
| [4] | 王英凯, 张明磊, 张立波. 人参三醇组皂甙诱导分化人肝癌细胞的研究[J]. 临床肝胆病杂志, 2003,19 (4) :242–243. |
| [5] | 景永奎, 韩锐. 大豆甙元(S86019)与乳香有效成分Bc-4或阿糖胞昔对HL-60细胞分化的联合诱导[J]. 药学学报, 1993,28 (1) :11–16. |
| [6] | Wang N, Wang L W, Gou B D, et al. Realgar-induced differentiation is associated with MAPK pathways in HL-60 cells[J]. Cell Biol Int, 2008, 32 (12) :1497–1505 . |
| [7] | 赵连梅, 韩丽娜, 商晓辉, 等. 木鳖子醇提物对黑素瘤B16细胞增殖的抑制作用及其可能机制[J]. 中国肿瘤生物治疗杂志, 2010,17 (1) :13–18. |
| [8] | 赵连梅, 韩丽娜, 耿艺曼, 等. 木鳖子醇提物诱导小鼠黑素瘤B16细胞分化的作用机制[J]. 中国肿瘤生物治疗杂志, 2012,19 (4) :381–386. |
| [9] | 耿艺曼, 赵连梅, 朱秀丽, 等. 木鳖子对羟基桂皮醛对黑素瘤B16细胞分化的影响及其机制[J]. 中草药, 2013,44 (14) :1951–1956. |
| [10] | 赵连梅, 耿艺曼, 孙士萍, 等. 木鳖子单体化合物对羟基桂皮醛诱导小鼠黑素瘤B16细胞的分化及其机制[J]. 中国肿瘤生物治疗杂志, 2014,21 (3) :282–287. |
| [11] | Zhao L M, Han L N, Ren F Z, et al. An ester extract of Cochinchina momordica seeds induces differentiation of melanoma B16F1 cells via MAPKs signaling[J]. Asian Pac J Cancer Prev, 2012, 13 (8) :3795–3802 . |
| [12] | Jiang Z, Xu J, Long M, et al. 2,3,5,4'-tetrahydroxystilbene-2-O-β-D-gluco-side (THSG) induces melanogenesis in B16 cells by MAP kinase activation and tyrosinase upregulation[J]. Life Sci, 2009, 85 (9/10) :345–350 . |
| [13] | Wevers K P, Kruijff S, Speijers M J, et al. S-100B:a stronger prognostic biomarker than LDH in stage IIIB-C melanoma[J]. Ann Surg Oncol, 2013, 20 (8) :2772–2779 . |
| [14] | Kruijff S, Hoekstra H J. The current status of S-100B as a biomarker in melanoma[J]. Eur J Surg Oncol, 2012, 38 (4) :281–285 . |
| [15] | Selimovic D, Hassan M, Haikel Y, et al. Taxol-induced mitochondrial stress in melanoma cells is mediated by activation of c-Jun N-terminal kinase (JNK) and p38 pathways via uncoupling protein 2[J]. Cell Signal, 2008, 20 (2) :311–322 . |
| [16] | Krishna M, Narang H. The complexity of mitogenactivated protein kinases (MAPKs) made simple[J]. Cell Mol Life Sci, 2008, 65 (22) :3525–3544 . |
 2016, Vol. 47
2016, Vol. 47


