乳腺癌细胞的恶性生物学行为主要表现在其增殖、侵袭和迁移的能力上,癌细胞从原发灶脱离进入体循环,必须要有迁移以及穿过细胞外基质(extracellular matrix,ECM)的过程(侵袭),ECM的降解在很大程度上受到IV型胶原酶的调节[1]。基质金属蛋白酶-2(MMP-2)、MMP-9都属于IV型胶原酶,它们参与了ECM的主要成分的降解,所以在肿瘤细胞的浸润和转移灶的形成等过程中扮演着重要的角色[2]。近年来发现,磷脂酰肌醇3-激酶(PI3K)和其下游分子蛋白Akt(RAC-alpha serine/threonine- protein kinase)所组成的信号通路与乳腺癌的发生发展密切相关[3]。该通路调节乳腺癌细胞的增殖和存活,其活性异常不仅能导致细胞恶性转化,而且与乳腺癌的迁移、黏附、肿瘤血管生成以及ECM的降解等相关,目前以PI3K-Akt信号通路关键分子为靶点的肿瘤治疗策略正在发展中[4]。
高良姜Alpinia officinarum Hance,别名小良姜,为姜科植物,是一种热带多年生长的山姜,属药食兼用植物。高良姜素是从高良姜中提取的有效成分,是一种天然的黄酮醇类化合物,不仅具有抗氧化、抗溃疡、镇痛抗炎、抗菌作用,还有抗肿瘤作用[5-8],但其抗乳腺癌转移的功效及分子机制未被证实,因此本研究采用体外人乳腺癌MDA-MB-231细胞模型来考察高良姜素对迁移及侵袭关键环节的影响,采用Western blotting、免疫荧光等方法探究高良姜素对PI3K、Akt、MMP-2和MMP-9蛋白表达影响,探究高良姜素抑制迁移及侵袭相关蛋白表达的分子机制。本研究还观察高良姜素对小鼠体内肿瘤生长的影响,进一步验证其抗肿瘤作用,为其抗肿瘤作用研究与开发提供依据。
1 材料 1.1 细胞株与动物MDA-MB-231乳腺癌细胞从ATCC细胞库(美国)获得。BALB/c雌性裸鼠,SPF级,体质量18~22 g,许可证号SCXK(沪)2008-0016,购自上海西普尔必凯实验动物有限公司。
1.2 试剂与药品高良姜素购自南京青泽医药科技开发有限公司(批号485-49-4,质量分数98%)。DMEM培养基、胎牛血清购自美国Gibco公司;MTT购自Promega公司;Transwell迁移小室和侵袭小室购自美国Corning公司;PI3K、AKT、MMP-2、MMP-9、磷酸化-NF-κB p65(p-NF-κB p65Ser 276)、总NF-κB p65(t-NF-κB p65)和GAPDH一抗抗体、荧光二抗(辣根过氧化物标记的羊抗兔IgG)、FITC荧光二抗购自Santa Cruz公司;Hoechest购自上海碧云天生物技术有限公司;青霉素-链霉素溶液购自上海碧云天生物技术有限公司。
1.3 仪器DM1L莱卡倒置荧光显微镜(德国莱卡公司);3111型CO2培养箱(Forma);BT323S电子天平(德国赛多利斯有限公司);KA-1000离心机(上海安亭科学仪器厂);TECAN 3360063酶标仪(Sunrise公司)。
2 方法 2.1 高良姜素体外对MDA-MB-231细胞增殖、迁移及侵袭的影响 2.1.1 细胞培养MDA-MB-231乳腺癌细胞于含10%胎牛血清以及1×105 U/L青霉素、100 mg/L链霉素的DMEM培养基中,于37℃、5% CO2培养箱中进行常规培养。
2.1.2 对MDA-MB-231细胞增殖的影响MDA-MB-231细胞生长至80%融合,0.25%胰蛋白酶消化,DMEM完全培养基重悬,每孔5×103个细胞接种于96孔板。待细胞贴壁后,加入高良姜素,使其终浓度分别为10、25、50、100、200 μmol/L,对照组加入20 μL PBS,每个药物浓度设5个复孔。培养24 h后加入20 μL MTT溶液(5 mg/mL),在培养箱中孵育4 h,96孔板震摇15 min,吸弃上清,加入二甲基亚砜(DMSO)震荡,用全自动酶标仪在490 nm测定吸光度(A)值,计算细胞增殖抑制率。实验重复3次[9]。
细胞增殖抑制率=1-给药组A值/对照组A值
2.1.3 对MDA-MB-231细胞水平运动能力的影响取对数生长期MDA-MB-231细胞,消化细胞,调整细胞密度至2×105个/mL,备用。将上述细胞悬液加入6孔板中,每孔体积2 mL,放入37 ℃、5% CO2培养箱继续培养,待细胞呈融合状态,用100 μL无菌枪头进行划痕。划痕完毕后,用移液枪吸出培养液,加入适量的PBS将细胞清洗3遍,除去细胞碎片,弃去PBS,每孔加入用无血清DMEM培养基配制的不同浓度高良姜素(0、25、50、100 μmol/L)溶液,每个浓度3个复孔,在划痕的不同时间点(0、24 h)将6孔板置于倒置显微镜下拍照,测量每组MDA-MB-231细胞显微镜图像中空白间距(单位为cm),并计算24 h与0 h空白距离的比值,观察划痕愈合的程度[10]。
2.1.4 对MDA-MB-231细胞迁移能力的影响常规培养MDA-MB-231细胞,实验前24 h撤血清饥饿。消化细胞,用无血清的DMEM培养基重悬浮,调整细胞密度为2×106个/mL,在24孔板中加入DMEM培养基,每孔600 μL。取上述细胞悬液90 μL加入Transwell迁移小室上室中,同时各孔加入浓度分别为250、500、1 000 μmol/L的高良姜素药液,体积10 μL,终浓度为25、50、100 μmol/L,对照组加入等体积PBS,每个浓度3个复孔。将小室浸于24孔板的培养液中,37 ℃、5% CO2孵箱内孵育6 h,取出小室,用镊子轻轻取下滤膜,5%戊二醛4 ℃固定10 min,取出用0.1%结晶紫染液于水平摇床上染色30 min,PBS漂洗3次,用棉签擦掉膜上层未穿过的细胞,置于载玻片上,观察细胞迁移情况并拍照,200倍镜下,随机选取5个视野,计数穿膜细胞数目[11],根据公式计算迁移抑制率。
迁移抑制率=(对照组穿膜细胞数-给药组穿膜细胞数)/对照组穿膜细胞数
2.1.5 对MDA-MB-231细胞侵袭能力的影响取对数生长期MDA-MB-231,调整细胞浓度至1×105个/mL,取90 μL细胞悬液加入Transwell侵袭小室上室中,同时各孔加入浓度分别为250、500、1 000 μmol/L的高良姜素药液,体积10 μL,终浓度为25、50、100 μmol/L,对照组加入等体积PBS,每个浓度3个复孔。下室24孔板中每孔加入900 μL含10% FBS的DMEM培养基。将小室放入24孔板中,37 ℃、5% CO2培养箱常规培养24 h,取出小室,用镊子取下滤膜,5%戊二醛4 ℃固定,用0.1%结晶紫染液染色30 min,PBS漂洗3次,用棉签擦掉膜上层未穿过的细胞,置于载玻片上,观察细胞迁移情况并拍照,200倍镜下随机选取5个视野,观察侵袭细胞数目[12],根据公式计算侵袭抑制率。
侵袭抑制率=(对照组侵袭细胞数-给药组侵袭细胞数)/对照组侵袭细胞数
2.1.6 对MDA-MB-231细胞迁移及侵袭相关蛋白表达的影响Western blotting检测:取MDA-MB-231细胞接种于培养皿中,每个培养皿各加入1 mL细胞悬液(密度为1×105个/mL),其余为含10%胎牛血清的DMEM培养液,共10 mL体系。细胞分组及给药方式同“2.1.5”项,37 ℃、5% CO2培养箱培养24 h后提取蛋白,并采用BCA法测定蛋白浓度。变性后取50 μg上样,用10%分离胶、5%浓缩胶电泳:每块胶0.02 A,至溴酚蓝消失,之后转到PVDF膜上。一抗(PI3K、AKT、MMP-2、MMP-9和GAPDH)以1∶1 000,4 ℃孵育过夜后加辣根过氧化物标记的羊抗兔IgG(1∶10 000)。加入化学发光试剂,用Kodak胶卷曝光,以GAPDH作为内参,采用Adobe Photoshop CS6软件进行灰度分析[13],实验重复3次。
免疫荧光检测:MDA-MB-231单层生长细胞在传代培养时,将细胞接种到预先放置有处理过的盖玻片的培养皿中,待细胞接近长成单层后,细胞分组及给药方式同“2.1.5”项。取出盖玻片,PBS洗2次;用多聚甲醛固定细胞。固定完毕后的细胞使用Triton对细胞进行通透处理5~15 min,通透后用PBS洗涤3×5 min,加入一抗抗体(PI3K、Akt、MMP-2、MMP-9)孵育4 ℃过夜。PBST漂洗3次,每次冲洗5 min。结合FITC荧光二抗,室温避光孵育2 h。PBST漂洗3次,每次冲洗5 min,滴加封片剂1滴,封片,荧光显微镜观察细胞FITC荧光染色强度。
2.1.7 对NF-κB p65表达及入核的影响Western blotting法考察高良姜素对NF-κB p65表达的影响,具体操作同“2.1.6”项。免疫荧光实验中将玻片放入6孔板,MDA-MB-231细胞悬液滴至玻片,且不能溢出,待细胞贴壁后,加足含高良姜素培养液(浓度为0、100 μmol/L)培养24 h。取出细胞玻片后用甲醇固定15 min,现用现配。PBS冲洗,0.1% Triton作用20 min,PBS洗3次,10%正常羊血清封闭10 min。加入NF-κB p65一抗(1:500),4 ℃孵育过夜。加入FITC荧光二抗,室温30 min,90%甘油封片,用Hochest染核,直接于显微镜下观察[14]。
2.2 高良姜素体内对荷瘤裸鼠肿瘤生长的影响 2.2.1 动物模型制备、分组及给药将单层培养的MDA-MB-231细胞消化脱壁后稀释为5×105的细胞悬液,将MDA-MB-231细胞悬液接种于BALB/c雌性裸鼠背部一侧皮下,接种48 h后,观察肿瘤生长状况,将裸鼠随机分为2组:模型组(0.9%生理盐水)、高良姜素组(200 μg/kg,预试验结果提示200 μg/kg给药,对裸鼠体质量无影响,对裸鼠主要脏器没有毒性作用),每组3只裸鼠。高良姜素组ig给予质量浓度为20 μg/mL的高良姜素溶液,模型组ig给予含1% DMSO的生理盐水,体积均为10 mL/kg,每天1次,连续25 d。实验期间自由饮食饮水,每3天用游标卡尺测量瘤体长径(a,mm)和短径(b,mm),并称裸鼠体质量。给药结束后的第2天处死裸鼠拍照,计算瘤体积(V,V=ab2/2),绘制肿瘤生长曲线。剥取瘤组织,称质量,计算抑瘤率。
抑瘤率=1-药物组平均瘤质量/模型组平均瘤质量
2.2.2 对荷瘤裸鼠肿瘤组织相关蛋白表达及NF-κB p65表达及入核的影响称取肿瘤组织200 mg,在研钵中用液氮研磨,加入1 000 μL的细胞裂解液,吸入1.5 mL的灭菌离心管中,将含有蛋白裂解液的离心管在冰上冰浴20 min,15 000 r/min离心20 min,吸取上清。按照“2.1.6”和“2.1.7”项方法检测肿瘤组织中PI3K、Akt、MMP-2、MMP-9蛋白表达水平及NF-κB p65表达及入核水平。
2.3 统计学分析 采用SPSS 17.0软件包进行统计学处理,结果以
MTT结果显示,10、25 μmol/L高良姜素对MDA-MB-231细胞增殖无影响,在50 μmol/L时对MDA-MB-231细胞增殖有显著抑制作用(P<0.01),抑制率达30.5%,在100、200 μmol/L时对MDA-MB-231细胞增殖有极显著抑制作用,抑制率分别为48.65%和70.58%(P<0.001)。结果见图 1。
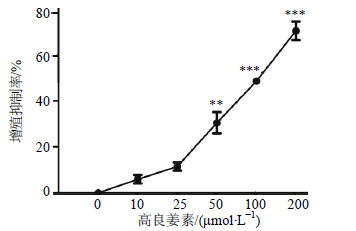
|
图 1 高良姜素对MDA-MB-231细胞增殖的影响 (  |
3.1.2 抑制MDA-MB-231细胞水平运动的能力
观察不同浓度高良姜素于不同时间点对乳腺癌细胞划痕愈合能力的影响,随着高良姜素浓度的增加,MDA-MB-231细胞划痕的愈合程度呈递减趋势,结果以0 h和24 h两个时间点为例,呈现对照组和高良姜素组细胞的划痕愈合情况,见图 2。24 h时,对照组划痕区域的乳腺癌MD-MB-231细胞发生明显迁移,而随着高良姜素浓度的增加,划痕区域细胞愈合程度呈降低趋势。

|
图 2 高良姜素对MDA-MB-231细胞划痕愈合能力的影响 (  |
3.1.3 抑制MDA-MB-231细胞迁移
Transwell小室迁移实验结果发现,随着高良姜素浓度的增加,细胞迁移能力呈递减趋势,见图 3。对照组穿膜细胞数目较多,高良姜素各浓度处理6 h后,穿膜细胞数目与对照组比较呈减少趋势。与对照组比较,25、50、100 μmol/L高良姜素对MDA-M-231细胞迁移均有显著抑制作用(P<0.05、0.01、0.001),迁移抑制率分别为23.08%、35.29%和51.63%。
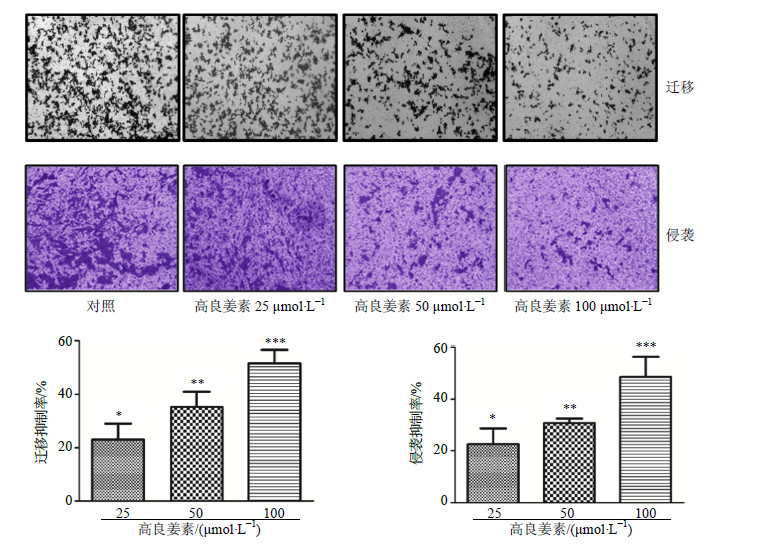
|
图 3 高良姜素对MDA-MB-231细胞迁移和侵袭能力的影响 (  |
3.1.4 抑制MDA-MB-231细胞侵袭
Transwell小室侵袭实验结果发现,随着高良姜素浓度的增加,细胞侵袭能力呈递减趋势,见图 3。对照组侵袭细胞数目较多,高良姜素各浓度处理24 h后,侵袭细胞数目与对照组比较呈减少趋势。与对照组比较,25、50、100 μmol/L高良姜素对MDA-M-231细胞侵袭均有显著抑制作用(P<0.05、0.01、0.001),侵袭抑制率分别为22.55%、30.84%和48.67%。
3.1.5 抑制迁移及侵袭相关蛋白表达Western blotting结果(图 4)显示,实验各组GAPDH的条带灰度相近,高良姜素作用24 h后可以在一定程度上剂量依赖性抑制MDA-MB-231细胞中PI3K和Akt的蛋白表达;高良姜素可以显著抑制MDA-MB-231细胞中MMP-2和MMP-9的蛋白表达。细胞免疫荧光实验结果也证实高良姜素处理细胞后,MDA-MB-231细胞的MMP-2表达亮度有明显的减弱,结果见图 5。实验结果证实高良姜素可以下调MDA-MB-231细胞PI3K-Akt-MMPs信号通路。
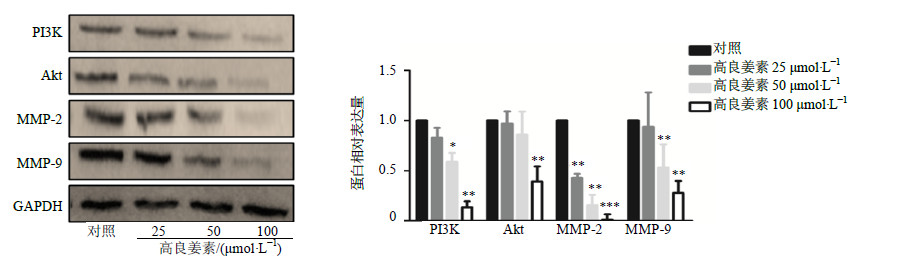
|
图 4 高良姜素对MDA-MB-231细胞PI3K、Akt、MMP-2和MMP-9蛋白表达的影响 (Western blotting,   |

|
图 5 免疫荧光染色法检测MDA-MB-231细胞PI3K、Akt、MMP-2和MMP-9蛋白表达 Fig.5 Protein expression of PI3K,Akt,MMP-2,and MMP-9 in MDA-MB-231 cells by immunofluorescent staining |
3.1.6 抑制MDA-MB-231细胞NF-κB p65磷酸化表达及入核
Western blotting结果(图 6)显示,实验各组GAPDH的条带灰度相近,t-NF-κB p65蛋白表达与对照组比较无显著变化,但p-NF-κB p65Ser276表达水平在高良姜素处理后显著低于对照组,50、100 μmol/L高良姜素组条带灰度较对照组明显减弱(P<0.05、0.01)。免疫荧光染色检测NF-κB的主要亚基p65是否被转移到MDA-MB-231细胞核内,判断NF-κB是否被激活。高姜良素作用24 h后,高姜良素100 μmol/L组MDA-MB-231细胞核内NF-κB p65蛋白的量显著低于对照组。结果见图 7。
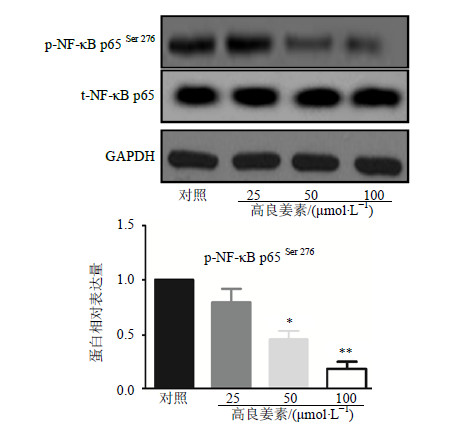
|
图 6 高良姜素对MDA-MB-231细胞p-NF-κB p65 Ser 276及 t-NF-κB p65蛋白表达的影响 (  |

|
图 7 高良姜素对MDA-MB-231细胞NF-κB p65入核的影响 (免疫荧光染色) Fig.7 Effect of galangin on NF-κB p65 nuclear translocation in MDA-MB-231 cells(immunofluorescent staining) |
3.2 体内对荷瘤裸鼠肿瘤生长的抑制作用 3.2.1 对荷瘤裸鼠肿瘤生长的抑制作用
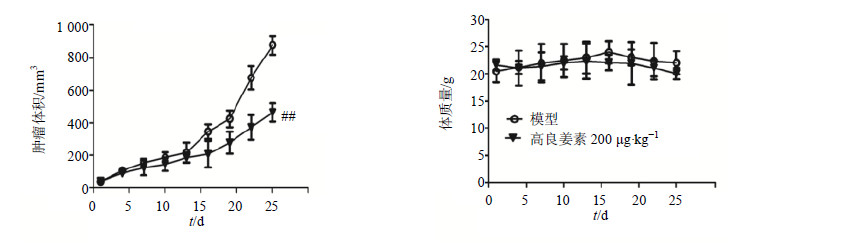
与模型组比较,高良姜素组对荷瘤裸鼠肿瘤生长具有明显抑制作用。图 8和9结果显示,高良姜素(200 μg/kg)给药25 d,具有较强的抑制乳腺癌MDA-MB-231荷瘤裸鼠肿瘤质量和体积增长的作用(P<0.01)。

|
图 8 高良姜素对乳腺癌荷瘤裸鼠肿瘤质量的影响 (  |
|
图 9 高良姜素对乳腺癌荷瘤裸鼠肿瘤体积和体质量的影响 (  |
与模型组比较,高良姜素组瘤质量轻于模型组的瘤质量(P<0.01),高良姜素的抑瘤率为43.66%。而与模型组比较,高良姜素给药后对裸鼠的体质量(图 9)并没有明显影响,提示高良姜素抑瘤效率并不是由高良姜素药物毒性所导致的。 与模型组比较,高良姜素组p-NF-κB p65 Ser 276的表达下调,对t-NF-κB p65蛋白表达水平无影响。
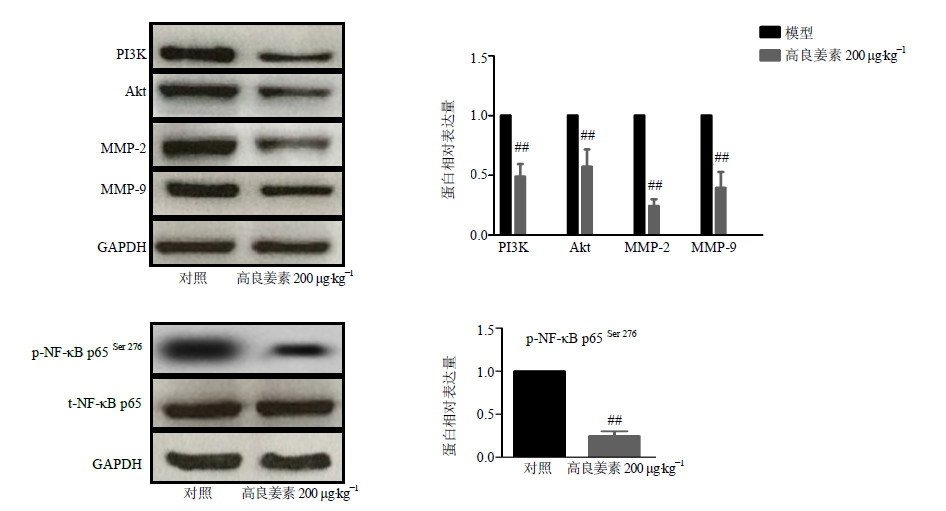
3.2.2 抑制瘤组织PI3K、Akt、MMP-2、MMP-9、p-NF-κB p65的表达如图 10所示,与模型组比较,高良姜素组裸鼠肿瘤组织中PI3K、Akt、MMP-2、MMP-9蛋白表达明显减少,特别是MMP-2的表达。
|
图 10 高良姜素对乳腺癌荷瘤裸鼠肿瘤组织内PI3K、Akt、MMP-2、MMP-9及p-NF-κB p65蛋白表达的影响 (  |
4 讨论
乳腺癌是严重威胁女性生命健康的重大疾病之一,乳腺癌术后复发转移并不少见,其发生率一般在10%~30%。西医通过术后化疗、放疗、生物治疗以及内分泌治疗等手段延缓其复发转移时间,降低其发生率。但对患者创伤较大,并且有严重的副作用,严重影响患者的生活质量,故研发毒副作用较小,疗效好的新型抗乳腺癌药物尤为重要[15]。
乳腺癌细胞的迁移、侵袭在转移过程中发挥重要作用。乳腺癌细胞在原发部位降解细胞外基质及基底膜,迁移进入血管,随着血液流动到达远端器官形成转移灶。由于PI3K-Akt与乳腺癌转移密切相关,PI3K-Akt过度活化后影响下游多种效应分子MMP-2和MMP-9的表达,在乳腺癌细胞内发挥促进增殖、迁移侵袭等关键作用。抑制PI3K、Akt表达,则可以抑制乳腺癌细胞迁移侵袭,减缓肿瘤进展[16]。
核转录因子NF-κB由2类亚基形成同源或异源二聚体。一类亚基包括p65(也称RelA)、RelB和C-Rel;另一类亚基包括p50和p52。最常见的NF-κB亚基组成形式为p65/p50或p65/p65。NF-κB未被激活时和IκB-α形成一个复合物,分布在细胞浆中。NF-κB激活后,IκB-α会在Ser32和Ser36被磷酸化,随后被泛素-蛋白酶体途径降解。NF-κB和IκB-α解聚后,其核定位序列被暴露,从而被转运到细胞核内促进NF-κB依赖的基因转录。很早就有研究提出NF-κB在癌变的过程中起着重要作用,特别是RelA(p65)亚基可反式激活很多基因,调节细胞的生长、凋亡、血管形成和侵袭转移。更重要的是在决定肿瘤致命性的转移和侵袭方面,NF-κB也具有重要作用,它能调节与肿瘤转移有关的PI3K-Akt、MMPs(MMP-9)等基因的表达[17]。
本研究表明高良姜素对乳腺癌细胞MDA-MB-231的增殖抑制作用明显(P<0.01),在浓度为50 μmol/L时,抑制率可达30.5%。通过观察高良姜素对乳腺癌细胞水平运动能力的影响,随着高良姜素给药浓度的增加,乳腺癌MDA-MB-231细胞的水平运动迁移能力逐渐减弱。通过观察高良姜素对乳腺癌MDA-MB-231细胞Transwell小室侵袭能力的影响,发现随着高良姜素给药浓度的增加,MDA-MB-231侵袭基底膜的能力逐渐减弱。
因为PI3K-Akt介导了MDA-MB-231细胞的迁移侵袭过程,因此推测高良姜素可能对MDA-MB-231细胞PI3K-Akt以及MMPs的表达有调控作用。本研究采用Western blotting法检测了高良姜素对MDA-MB-231细胞PI3K-Akt和MMP-2/9表达的影响,发现高良姜素可以下调PI3K、Akt的蛋白表达;进一步用免疫荧光实验方法对PI3K-AKT调控的MMP-2/9的蛋白表达进行了测定,发现高良姜素同时下调MMP-2的蛋白表达,初步说明了高良姜素具有下调PI3K-Akt以及MMPs表达的功能。进一步分子机制研究发现高良姜素对MDA-MB-231核转录因子NF-κB p65的磷酸化,对NF-κB p65的入核同样具有抑制作用。在人乳腺癌MDA-MB-231细胞裸鼠移植瘤模型中,实验结果表明,高良姜素也能抑制MDA-MB-231乳腺癌细胞在体的生长,同时高良姜素对瘤组织内PI3K、Akt、MMP-2/9蛋白表达和核转录因子NF-κB p65的活化有明显抑制作用。
研究初步证实高良姜素能有效抑制乳腺癌MDA-MB-231在体内外的生长,能够抑制乳腺癌MDA-MB-231细胞核转录因子NF-κB p65入核,抑制NF-κB p65的磷酸化表达,阻断NF-κB p65的激活,抑制PI3K-Akt信号通路,下调MMP-2和MMP-9的表达,发挥阻断乳腺癌MDA-MB-231细胞的迁移侵袭作用。
| [1] | Ha T K, Kim M E, Yoon J H, et al. Galangin induces human colon cancer cell death via the mitochondrial dysfunction and caspase-dependent pathway[J]. Exp Biol Med, 2013, 238 (9) :1047–1054 . |
| [2] | 赵欣, 张键. 高良姜素对肺癌肿瘤细胞DNA拓扑异构酶的抑制及细胞杀伤作用[J]. 中南大学学报:医学版, 2015,40 (5) :479–485. |
| [3] | Kim D A, Jeon Y K, Nam M J. Galangin induces apoptosis in gastric cancer cells via regulation of ubiquitin carboxy-terminal hydrolase isozyme L1 and glutathione S-transferase P[J]. Food Chem Toxicol, 2012, 50 (3/4) :684–688 . |
| [4] | Wen M, Wu J, Luo H, et al. Galangin induces autophagy through upregulation of p53 in HepG2 cells[J]. Pharmacology, 2012, 89 (5/6) :247–255 . |
| [5] | Zhang H T, Wu J, Wen M, et al. Galangin induces apoptosis in hepatocellular carcinoma cells through the caspase 8/t-Bid mitochondrial pathway[J]. J Asian Nat Prod Res, 2012, 14 (7) :626–633 . |
| [6] | Zhang H, Li N, Wu J, et al. Galangin inhibits proliferation of HepG2 cells by activating AMPK via increasing the AMP/TAN ratio in a LKB1-independent manner[J]. Eur J Pharmacol, 2013, 718 (1/3) :235–244 . |
| [7] | Zhang H T, Luo H, Wu J, et al. Galangin induces apoptosis of hepatocellular carcinoma cells via the mitochondrial pathway[J]. World J Gastroenterol, 2010, 16 (27) :3377–3384 . |
| [8] | 霍仕霞, 彭晓明, 高莉, 等. 不同质量分数高良姜素对人黑色素瘤A375细胞黑素合成及相关基因表达的影响[J]. 中草药, 2014,45 (2) :244–249. |
| [9] | Zhang H T, Wu J, Wen M, et al. Galangin induces apoptosis in hepatocellular carcinoma cells through the caspase 8/t-Bid mitochondrial pathway[J]. J Asian Nat Prod Res, 2012, 14 (7) :626–633 . |
| [10] | Zhang W, Tang B, Huang Q, et al. Galangin inhibits tumor growth and metastasis of B16F10 melanoma[J]. J Cell Biochem, 2013, 114 (1) :152–161 . |
| [11] | Zhang N, Chu E S, Zhang J, et al. Peroxisome proliferator activated receptor alpha inhibits hepatocarcinogenesis through mediating NF-κB signaling pathway[J]. Oncotarget, 2014, 5 (18) :8330–8340 . |
| [12] | 顾星, 姚敏, 王司晔, 等. 肿瘤坏死因子α/核因子-κB信号通路活化干预对肝癌细胞增殖的抑制作用[J]. 中华肝脏病杂志, 2014,22 (6) :434–439. |
| [13] | Gwak J, Oh J, Cho M, et al. Galangin suppresses the proliferation of β-catenin response transcription-positive cancer cells by promoting adenomatous polyposis coli/Axin/glycogen synthase kinase-3β-independent β-catenin degradation[J]. Mol Pharmacol, 2011, 79 (6) :1014–1022 . |
| [14] | Zhang W, Lan Y, Huang Q, et al. Galangin induces B16F10 melanoma cell apoptosis via mitochondrial pathway and sustained activation of p38 MAPK[J]. Cytotechnology, 2013, 65 (3) :447–455 . |
| [15] | Touil Y S, Fellous A, Scherman D, et al. Flavonoid-induced morphological modifications of endothelial cells through microtubule stabilization[J]. Nutr Cancer, 2009, 61 (3) :310–321 . |
| [16] | 吴金霞, 曹文嘉, 桑苗苗, 等. PLC对人骨肉瘤细胞迁移侵袭影响的实验研究[J]. 中国药理学通报, 2014,30 (10) :1388–1392. |
| [17] | Peng Y, Li L, Huang M, et al. Angiogenin interacts with ribonuclease inhibitor regulating PI3K/AKT/mTOR signaling pathway in bladder cancer cells[J]. Cell Signal, 2014, 26 (12) :2782–2792 . |
 2016, Vol. 47
2016, Vol. 47


