2. 山西大学化学化工学院, 山西 太原 030006 ;
3. 中国医学科学院药物研究所, 北京 100050 ;
4. 山西振东制药股份有限公司, 山西 长治 047100
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China ;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China ;
4. Shanxi Zhendong Pharmaceutical Co., Ltd., Changzhi 047100, China
黄芩Scutellariae Radix为唇形科(Labiatae)植物黄芩Scutellaria baicalensis Georgi的干燥根,始载于东汉《神农本草经》,列为中品,自此之后各个朝代的医药学专著《名医别录》《本草经集注》《新修本草》《千金翼方》《证类本草》《本草纲目》等均有记载,现为我国的大宗药材之一。具有清热燥湿、泻火解毒、止血、安胎、降血压等功效,在临床上应用广泛。近来,有研究通过对快速老化模型小鼠胸腺指数和抗氧化酶活性的检测,表明黄芩水提物具有抗衰老作用[1],也有研究表明黄芩醇提物能改善老年痴呆小鼠体内的氧化损伤以及神经炎症[2],但关于黄芩是否具有延长寿命的功效却未见报道。衰老是机体随着时间的推移,生物体的结构和机能发生系统性变化的复杂的生物学过程。近年来对抗衰老药物的研究有很多,但关于黄芩抗衰老作用及机制的进一步研究却少有报道。果蝇具有深厚的遗传学知识背景并且具有寿命短的优势,对其寿命的影响可以作为抗衰老作用研究中最直观、最重要的指标,是用于神经退行性疾病研究的一种重要的模式生物[3],但用于黄芩延缓衰老作用及机制的研究尚未见报道。之前已经有许多抗衰老的研究在果蝇这种模式生物上得到实现,但是国内结合1H-NMR代谢组学技术的研究却未见报道。代谢组学是研究关于生物体基因的改变或所处的环境变化后其代谢产物(内源性代谢物质)种类、数量及其变化规律的科学,能够揭示内在和外在因素影响下代谢整体的变化轨迹进而来反映机体生理变化过程中所发生的一系列生物事件,因此在研究系统性病变中有其独特的优势[4-5]。核磁共振是一种代谢组学常用的技术,其优点在于样本的前处理方式相对简单,对样本无破坏性,并且对代谢物的检测比较全面,能够更加完整地展现出整个代谢轮廓[6-9]。本研究以果蝇为模式生物,旨在通过观察黄芩醇提物(SAE)对果蝇寿命的影响来评价黄芩是否具有抗衰老的活性,通过研究黄芩对果蝇内源性代谢产物的影响,进一步探索黄芩抗衰老的作用机制。
1 材料 1.1 果蝇种类及培养条件W1118品系野生型黑腹果蝇Drosophila melanogaster Meigen,由山西大学应用生物学研究所提供。饲养温度(25±1)℃;湿度(50±20)%;自然昼夜节律光照,每3天更换1次培养基。
1.2 药品、主要试剂与仪器黄芩(采自山西省晋城市陵川县)经山西大学中医药现代研究中心秦雪梅教授鉴定均为《中国药典》2015年版所收录的正品黄芩Scutellaria baicalensis Georgi;D2O(美国默克试剂公司);3-三甲基硅基 [2,2,3,3-d4] 氘代丙酸钠(TSP,Cambridge Isotope Laboratories Inc.,MA,美国);Bruker 600-MHz AVANCE III核磁共振检测仪(德国布鲁克公司);CENTRIFUGE TDL-5型离心机(上海安亭科学仪器厂);FA2004电子天平(上海良平仪器仪表有限公司);MGC-HP人工气候箱(上海一恒科技有限公司);KYJ-3氮吹仪专用空气源及SPT-24氮空吹扫浓缩仪(北京斯珀特科技有限公司)。
2 方法 2.1 黄芩醇提物的制备参照文献方法[10]将黄芩粉碎后用10倍量60%乙醇回流提取2次,每次2 h,滤过,合并滤液,挥尽乙醇,浓缩,将浓缩液冷冻干燥即得SAE(其中黄芩苷质量分数为11.46%)。
2.2 果蝇培养基的制备空白培养基:琼脂10 g、玉米粉85 g、蔗糖70 g、酵母粉18 g、水1 L加热煮沸,最后加入丙酸5 mL制成空白培养基。在制成的空白培养基中分别添加SAE(0.1、1.0、5.0、10.0 g/L)作为含药培养基。
2.3 果蝇寿命实验收集3 d内羽化的果蝇成虫,雌、雄分开,随机分为5组,即对照组、黄芩醇提物(SAE)4个给药组(给药量分别为0.1、1.0、5.0、10.0 g/L),每组雌雄各100只,分别用空白培养基以及含药培养基喂养,每天统计死亡的果蝇数量,直至果蝇全部自然死亡,计算各组果蝇的平均寿命和最高寿命[11]。
2.4 果蝇代谢组学实验 2.4.1 分组及给药收集3 d内羽化的果蝇成虫,雌、雄分开,随机分为4组,每组1 200只,分别为对照3 d龄组(对照-3 d)以空白培养基喂养的3 d龄果蝇;对照30 d龄组(对照-30 d)以空白培养基喂养的30 d龄果蝇;1.0 g/L黄芩醇提物组(SAE-1)以1.0 g/L含药培养基喂养的30 d龄果蝇;5.0 g/L黄芩醇提物组(SAE-5)以5.0 g/L含药培养基喂养的30 d龄果蝇。所有实验组果蝇,均在相同条件下培养。
2.4.2 果蝇样品的收集与处理用于代谢组学分析的果蝇样本,分别于果蝇培养的第3天和第30天将各组果蝇分别收集于EP管中,并以液氮速冻,置于−80 ℃保存,待测。
2.4.3 1H-NMR果蝇组织样品测定根据参考文献报道方法[12]并稍加改进,果蝇样品前处理方法如下:称取果蝇组织100 mg,于2 mL EP管中,加氯仿-甲醇-水(2∶7∶1)1.5 mL,于冰浴上匀浆提取,涡旋,以13 000 r/min离心15 min,将上清液转移至2 mL EP管中以空气吹,吹干后的样品加含TSP的磷酸盐缓冲液(pH 7.4,包含D2O、0.01% TSP)600 μL,超声溶解,涡旋,再以13 000 r/min离心15 min,取全部上清液置于5 mm核磁管中,于600 MHz NMR仪上进行1H-NMR测定。采用Nuclear Overhauser Effect Spectroscopy(NOESY,RD-90°-t1-90°-tm-90°-acquire)序列以压制水峰,扫描次数为64次。
2.4.4 1H-NMR图谱处理采用Mest ReNova(Mestrelab Research,Santiago de Compostella,西班牙)核磁图谱处理软件,对所有1H-NMR图谱进行傅里叶转换以及相位、基线调整,以TSP(δ 0.00)为标准对谱图进行化学位移的校正,对δ 0.60~10.00区域的谱图进行δ 0.01等宽度分割,切除δ 4.60~5.00区域以消除水峰的影响。对图谱进行分段积分,将所产生的所有积分数据归一化[13]。归一化后的数据导入SIMCA-P 13.0(Umetrics,瑞典)软件,进行多元统计分析。
2.4.5 统计学分析采用SIMCA-P 13.0软件将NMR采集处理的积分数据校正后,进行多元统计分析。对不同组别,采用独立样本t检验进行统计和比较。
2.4.6 代谢通路分析应用MetPA平台分析黄芩醇提物干预机体后显著影响的代谢通路。将筛选出的代谢产物上传到MetPA平台,采用果蝇代谢物数据库进行代谢物匹配,之后进行代谢通路富集分析和拓扑分析。
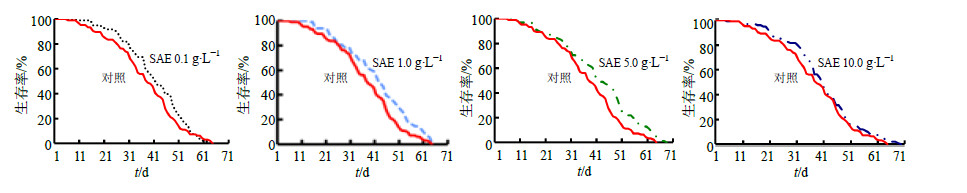
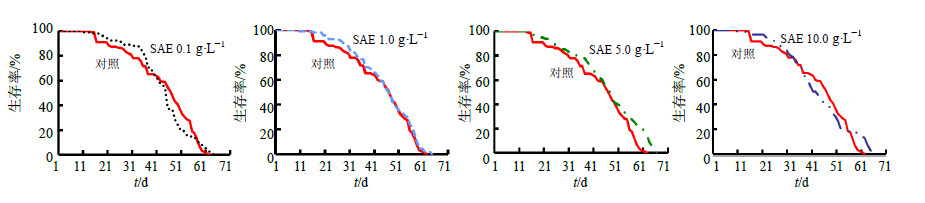
3 结果 3.1 果蝇生存寿命分析对于雌性果蝇,1.0、5.0 g/L SAE组的平均寿命和最高寿命均显著延长(P<0.05、0.01);对于雄性果蝇,5.0 g/L SAE组可以显著延长其平均寿命和最高寿命(P<0.05、0.01),结果见表 1。对果蝇生存曲线进行分析,雌性果蝇,1.0、5.0 g/L SAE 组相对于对照组生存曲线Log-Rank检验均存在显著性差异(P<0.05),见图 1。雄性果蝇,5.0 g/L SAE 组相对于对照组生存曲线Log-Rank检验存在显著性差异(P<0.05),见图 2。
|
图 1 各组雌性果蝇的生存曲线 Fig.1 Lifespan survivorship curves of female D. melanogaster in each group |
|
图 2 各组雄性果蝇的生存曲线 Fig.2 Lifespan survivorship curves of male D. melanogaster in each group |
|
|
表 1 SAE对果蝇寿命的影响 (  |
3.2 NMR图谱的指认与分析
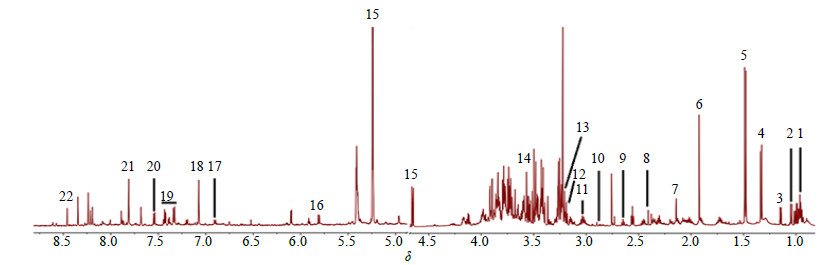
结合每个代谢物的化学位移,裂峰情况及偶合常数,并且参照Chenomx NMR Suite(Chenomx Inc.,Edmonton,AB,加拿大),the Human Metabolome Database(HMDB),Biological Magnetic Resonance Data Bank(BMRB)数据库以及文献报道[14-16]中数据对果蝇组织代谢产物进行指认,结果见图 3和表 2。
|
图 3 果蝇1H-NMR核磁图谱的指认 Fig.3 1H-NMR spectrum of D . melanogaster |
|
|
表 2 果蝇组织中主要代谢物1H-NMR核磁图谱数据归属 Table 2 Peak attribution in 1H-NMR spectra for main metabolites in tissues of D. melanogaster |
3.3 NMR数据多元统计分析
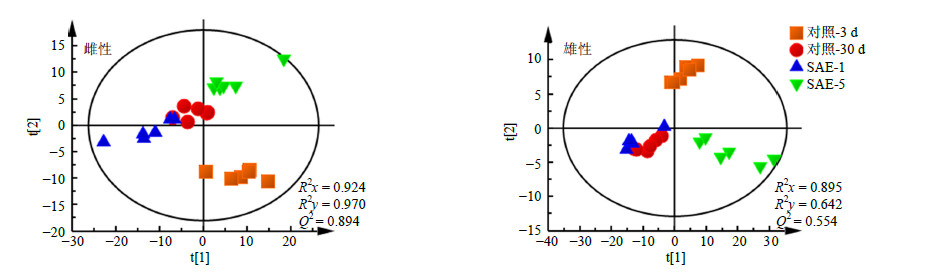
1H-NMR图谱提供了果蝇组织中内源性代谢物的基本信息,为了进一步确定各组间的代谢物差异,需要对复杂数据进行降维处理,以消除多信息共存中的重叠部分而提取出主要成分进行分析。采用偏最小二乘-判别分析(PLS-DA)方法对所有果蝇样本1H-NMR代谢轮廓进行分析,结果见图 4。在雌雄果蝇中,对照-3 d组与对照-30 d组均明显分开,表明伴随年龄的变化,代谢轮廓会产生一定的变化。在雌雄果蝇中SAE-1、SAE-5组与对照-30 d组均呈现分开的趋势,并且以SAE-5组与对照-30 d组分开的更加明显,表明5.0 g/L SAE对30 d龄的果蝇代谢产物回调作用更为显著。
|
图 4 雌雄果蝇1H-NMR谱PLS-DA散点图 Fig.4 PLS-DA scores plots in 1H-NMR spectra of female and male D. melanogaster |
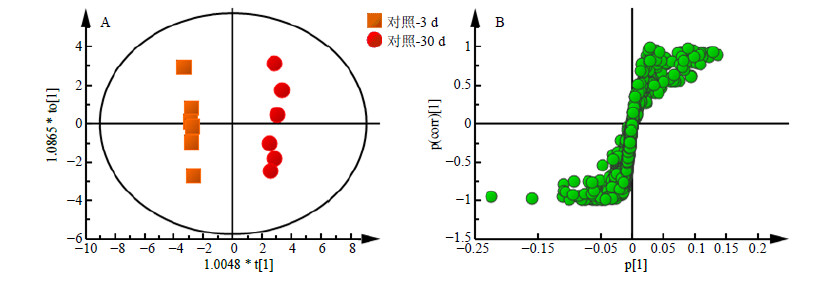
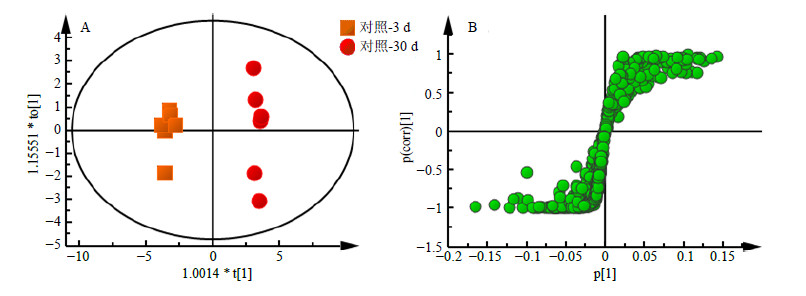
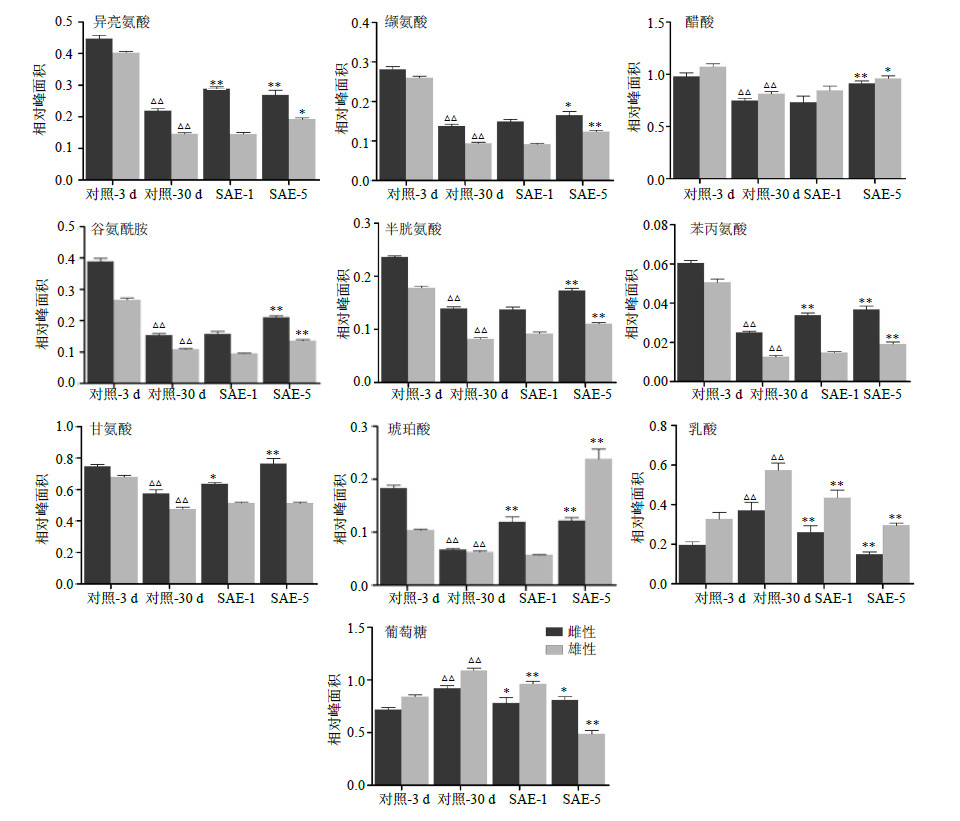
为了确定随年龄变化的代谢产物以及SAE干预后的差异代谢产物,对对照-3 d组与对照-30 d组进行正交偏最小二乘法判别(OPLS-DA)分析,使不同年龄组之间得到最大程度的分离,并有效降低组内个体差异。分别得到OPLS-DA散点图和相应的S-plot图,如图 5、6所示。依据图中“S”曲线上离原点越远的点VIP(variable importance in the projection)值越大,对分组贡献越大的原则,得到VIP>1的代谢产物。对这些代谢物的峰面积进行独立样本t检验,得到峰面积具有显著差异的潜在生物标志物,筛选出雌雄共有的部分(异亮氨酸、缬氨酸、醋酸、谷氨酰胺、半胱氨酸、苯丙氨酸、甘氨酸、琥珀酸、乳酸和葡萄糖),并对这些代谢物进行进一步的统计分析,结果见图 7。计算雌雄共有的代谢物之间Pearson相关系数,进行相关性分析,结果见表 3,由表可知,同一种差异代谢物在雌雄之间均呈正相关,相关性很强,并且这几种差异代谢物同时出现在雌性和雄性两种性别中,所以将这10种代谢物认为是衰老过程中的潜在代谢标志物。
|
图 5 雌性果蝇1H-NMR谱OPLS-DA散点图 (A) 及S-plot载荷图 (B) Fig.5 OPLS-DA scores plot (A) and corresponding S-plot (B) derived from 1H-NMR spectra of female D. melanogaster |
|
图 6 雄性果蝇1H-NMR谱OPLS-DA散点图 (A) 及S-plot载荷图 (B) Fig.6 OPLS-DA scores plot (A) and corresponding S plot (B) derived from 1H-NMR spectra of male D. melanogaster |
|
图 7 各组果蝇组织中潜在差异代谢物相对峰面积的比较 Fig.7 Comparison on relative peak areas of some potential differential metabolites in tissues of D. melanogaster |
|
|
表 3 雌雄果蝇间潜在差异代谢物的相关性分析 Table 3 Correlation analysis of protential differential metabolites between female and male D. melanogaster |
3.4 代谢途径分析
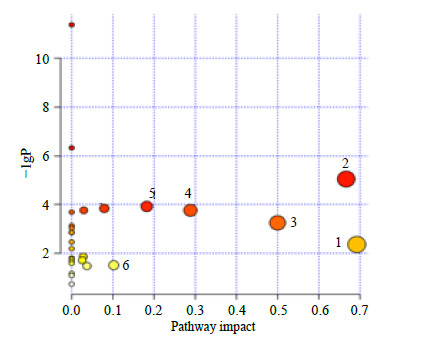
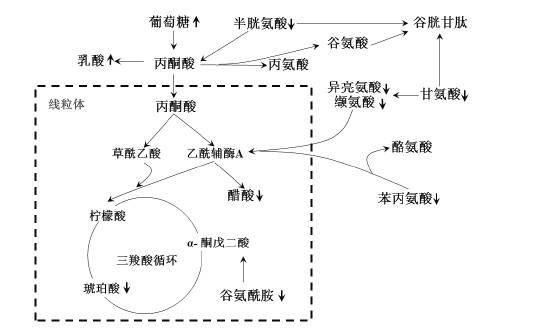
为研究给药组能够调节的所有代谢物所涉及的代谢途径,研究各个标志物之间可能的相互作用关系,参考KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库,寻找10个生物标志物所涉及的代谢通路。MetPA分析的优势在于能够基于代谢物信息数据库(KEGG),利用计算机自动将差异代谢物归纳到相关的生物化学变化网络中,筛选出与疾病最相关的代谢通路[17]。将上述的10个化合物导入MetPA软件,结果如图 8所示,图中横坐标Pathway impact表征由拓扑分析计算所得的代谢通路的重要性值,纵坐标−lgP表示代谢通路富集分析的显著性水平。代谢通路的Pathway impact与−lgP值越大,不同组间代谢差异的相关性越高,图中的圆圈就越大[18]。本研究将代谢通路影响值设置为0.10,当代谢通路影响值高于这个值,即被视为潜在的靶标代谢路径,主要包括:苯丙氨酸代谢;缬氨酸、亮氨酸、异亮氨酸的生物合成;苯丙氨酸、酪氨酸和色氨酸的生物合成;甘氨酸、丝氨酸和苏氨酸代谢;丙氨酸、天冬氨酸和谷氨酸代谢;半胱氨酸和蛋氨酸代谢6条通路;结果显示衰老的过程主要跟一些氨基酸的生物合成和代谢途径密切相关。将这些代谢途径中相关的生物标志物相联系,构建衰老相关的代谢网络示意图,结果如图 9所示。可见衰老主要伴随着线粒体功能的减弱和无氧呼吸的增强,所以SAE主要通过调节机体氨基酸的合成和代谢途径,可能调节线粒体功能来达到延缓衰老的效果。
|
图 8 代谢通路的MetPA Fig.8 MetPA of metabolic pathway |
|
图 9 代谢通路分析图 Fig.9 Analysis plot of metabolic pathways |
4 讨论
衰老是机体随时间的推移,多个组织器官系统性地发生变化的过程。系统生物学的发展为衰老机制的探索提供了契机。本实验以果蝇这种模式生物研究衰老,利用果蝇寿命短的优势,展现出一种自然状态下的衰老过程,更能够反映出SAE对于自然衰老过程的调控作用。结合代谢组学的的方法,从内源性代谢产物出发,与传统中医理念的“整体观念”不谋而合,系统性的研究衰老,从代谢组学的角度阐明黄芩延缓衰老的作用机制。
代谢组学能够较全面地揭示这种系统性变化以及给药过程中生物体系内所发生的一系列生物化学变化,从整体观出发考察衰老和药物对衰老所产生的整体效应。以果蝇整体为生物样本,所含有的代谢物信息都能够更全面地映射出研究对象的生理状况。以1H-NMR为研究方法,能够比较全面地分析出样本中所含有的代谢物[19]。本研究结果显示SAE在调节果蝇代谢标志物方面能够表现出一定的作用。这一点为黄芩延缓衰老药理作用提供了依据。
本研究中,代谢组学的结果显示对照-3 d组与对照-30 d组能明显区分,说明随着年龄的增长果蝇的代谢轮廓会发生一定的变化。通过多元统计分析技术对果蝇样本1H-NMR代谢轮廓进行分析,发现与3 d龄的果蝇相比,30 d龄的果蝇中:异亮氨酸、缬氨酸、醋酸、谷氨酰胺、半胱氨酸、苯丙氨酸、甘氨酸、琥珀酸、乳酸和葡萄糖的量均发生显著性变化,这种变化在雌雄之间呈现一定的正相关,并且SAE能够不同程度的对其发挥回调作用。
30 d龄果蝇的异亮氨酸、缬氨酸、苯丙氨酸含量降低。异亮氨酸和缬氨酸同为支链氨基酸,在调节机体能量代谢平衡方面起着重要的作用,而其含量的降低有可能是衰老机体能量代谢紊乱所造成的[20]。苯丙氨酸在机体内转变为酪氨酸,苯丙氨酸缺乏时,可影响体内酪氨酸合成进而导致多巴胺、甲状腺激素等水平降低,影响其代谢活动[21]。异亮氨酸、缬氨酸和苯丙氨酸又同为必需氨基酸,只能够从食物中摄取,伴随年龄的增加,机体蛋白质、激素等合成速度会变慢,肠道菌群代谢活动紊乱[22],所以异亮氨酸、缬氨酸和苯丙氨酸很有可能是被肠道菌群所吸收用以合成自身蛋白,进而导致其量降低,影响体内的代谢紊乱。给药组中异亮氨酸、缬氨酸和苯丙氨酸量回调,因此SAE可能通过调节这些代谢产物发挥抗菌作用[23]。半胱氨酸是一种还原剂,也是体内生成谷胱甘肽的底物之一,谷胱甘肽是机体内一种主要的抗氧化剂,因此半胱氨酸的缺乏,能够直接或间接地降低机体抗氧化能力[24],SAE含有大量的黄酮类化合物,其具很强的抗氧化能力[23],因此SAE可能通过此作用发挥抗衰老作用。谷氨酰胺能促进营养物质的同化作用,调节蛋白的合成,刺激生长激素的产生,增强免疫系统,同时也是体内铵盐的主要存在形式,其含量伴随年龄的增长降低,而黄芩具有抑制炎性介质产生,增强机体免疫功能的药理作用[23]。由此可见,SAE很可能是通过抗菌、抗氧化、增强机体免疫功能等作用,从而达到延缓衰老的效果。
葡萄糖是体内能量代谢的主要来源,随着年龄的增长,机体细胞吸收葡萄糖的能力会下降,糖原合成及糖氧化代谢也明显降低[25];乳酸是机体无氧呼吸的主产物,乳酸含量的升高表明衰老机体有氧呼吸能力的下降,线粒体功能减弱;醋酸的产生是机体内丙酮酸的一种有效的利用方式[26],醋酸含量的降低很可能表示随着年龄的变化,丙酮酸代谢途径发生紊乱;琥珀酸是三羧酸循环的中间产物,琥珀酸量的降低表明三羧酸循环速率的降低或者线粒体功能的紊乱;甘氨酸是人体非必需氨基酸,在人体合成代谢过程中具有重要作用,甘氨酸在体内代谢主要是通过甘氨酸裂解酶系统进行,甘氨酸裂解酶系统主要存在于肝、肾、脑和胎盘的线粒体膜上[27]。由上可见,无论是糖代谢、丙酮酸代谢、三羧酸循环还是甘氨酸代谢都会不同程度受到线粒体影响,这为线粒体损伤的衰老机制研究[28]提供了依据。给药组上述代谢物不同程度的回调表明黄芩醇提物能够有效干预糖代谢、丙酮酸代谢、三羧酸循环和甘氨酸代谢,从而达到延缓衰老的效果。
综上所述,年龄的增长伴随着机体的线粒体功能和氨基酸代谢的紊乱,SAE能够干预机体氨基酸代谢和线粒体功能,可能通过抗菌、抗氧化、增强机体免疫等功能和修复受损的线粒体进而达到延缓衰老的效果。本研究从代谢组学角度初步分析了伴随年龄变化果蝇组织代谢轮廓的变化,并从代谢谱图中寻找到有生物学意义的代谢标志物,鉴定了与衰老相关的10种生物标志物,为进一步探讨衰老的机制和阐明SAE延缓衰老的作用机制提供了科学的依据。
| [1] | 王岚, 梁日欣, 杨滨, 等. 黄芩及红花水提物对快速老化模型小鼠的抗衰老作用研究[J]. 中国实验方剂学杂志, 2010,16 (13) :159–166. |
| [2] | Jeong K, Shin Y C, Park S, et al. Ethanol extract of Scutellaria baicalensis Georgi prevents oxidative damage and neuroinflammation and memorial impairments in artificial senescense mice[J]. J Biomed Sci, 2011, 18 (69) :277–290 . |
| [3] | 温艾, 刘力. 以果蝇模型研究人类神经退行性疾病[J]. 生物化学与生物物理进展, 2003 (3) :357–362. |
| [4] | Nicholson J K, Lindon J C, Holmes E. ‘Metabonomics’:understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29 (11) :1181–1189 . |
| [5] | 赵珊, 王鹏程, 冯健, 等. 代谢组学技术及其在中医药研究中的应用[J]. 中草药, 2015,46 (5) :756–765. |
| [6] | Williams R E, Lenz E M, Lowden J S, et al. The metabonomics of aging and development in the rat:an investigation into the effect of age on the profile of endogenous metabolites in the urine of male rats using 1H NMR and HPLC-TOF MS[J]. Mol Biosyst, 2005, 1 (2) :166–175 . |
| [7] | 田俊生, 那丽丹, 向欢, 等. 基于核磁代谢组学的驴皮与其伪品的鉴别研究[J]. 中草药, 2015,46 (2) :255–261. |
| [8] | 田俊生, 史碧云, 冯光明, 等. 慢性温和不可预知应激抑郁模型大鼠粪便1H-NMR代谢组学研究[J]. 中草药, 2013,44 (22) :3170–3176. |
| [9] | 张艳花, 王东琴, 李晓伟, 等. 基于1H-NMR代谢组学技术寻找CCl4致大鼠急性肝损伤的代谢标志物[J]. 药物评价研究, 2014,37 (1) :11–16. |
| [10] | 杨宏静. 黄芩乙醇回流提取工艺研究[J]. 实用中医药杂志, 2013 (6) :492–493. |
| [11] | Lin W, Chen J, Wang J, et al. The anti-aging effects of Ludwigia octovalvis on Drosophila melanogaster and SAMP8 mice[J]. Age, 2014, 36 (2) :689–703 . |
| [12] | Zhang Y, Aa J Y, Wang G J, et al. Organic solvent extraction and metabonomic profiling of the metabolites in erythrocytes[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877 (18/19) :1751–1757 . |
| [13] | 彭国茳, 史碧云, 田俊生, 等. 京尼平抗抑郁作用的1H NMR代谢组学机制研究[J]. 药学学报, 2014,49 (2) :209–216. |
| [14] | Overgaard J, Malmendal A, Sorensen J G, et al. Metabolomic profiling of rapid cold hardening and cold shock in Drosophila melanogaster[J]. J Insect Physiol, 2007, 53 (12) :1218–1232 . |
| [15] | Gey C, Seeger K. Metabolic changes during cellular senescence investigated by proton NMR-spectroscopy[J]. Mech Ageing Dev, 2013, 134 (3/4) :130–138 . |
| [16] | 陈磊, 向欢, 邢婕, 等. 补中益气汤干预脾虚证模型大鼠脾脏1H NMR代谢组学机制研究[J]. 药学学报, 2014,49 (9) :1320–1325. |
| [17] | 杨雯晴, 李运伦, 蒋海强. 基于高效液相色谱-质谱技术的缬沙坦作用机制的研究[J]. 药学学报, 2015,50 (7) :875–881. |
| [18] | Su Z H, Jia H M, Zhang H W, et al. Hippocampus and serum metabolomic studies to explore the regulation of Chai-hu-Shu-Gan-San on metabolic network disturbances of rats exposed to chronic variable stress[J]. Mol Biosyst, 2014, 10 (3) :549–561 . |
| [19] | Huo T, Chen X, Lu X, et al. An effective assessment of valproate sodium-induced hepatotoxicity with UPLC-MS and (HNMR)-H-1-based metabonomics approach[J]. J Chromatogr B, 2014, 969 :109–116 . |
| [20] | Li Y, Man S, Li J, et al. The antitumor effect of formosanin C on HepG2 cell as revealed by 1H NMR based metabolic profiling[J]. Chem Biol Interact, 2014, 220 :193–199 . |
| [21] | Gupta A, Mandi A A, Ahmad M K, et al. A proton NMR study of the effect of Mucuna pruriens on seminal plasma metabolites of infertile males[J]. J Pharm Biomed Anal, 2011, 55 (5) :1060–1066 . |
| [22] | 徐大量. 玉竹抗衰老有效成分研究[D]. 广州:广州中医药大学, 2008. |
| [23] | 张瑜. 黄芩药理作用的研究进展[J]. 医学综述, 2013,19 (6) :1091–1093. |
| [24] | Yanshole V V, Snytnikova O A, Kiryutin A S, et al. Metabolomics of the rat lens:A combined LC-MS and NMR study[J]. Exp Eye Res, 2014, 125 :71–78 . |
| [25] | Hoffman J M, Soltow Q A, Li S, et al. Effects of age, sex, and genotype on high-sensitivity metabolomic profiles in the fruit fly, Drosophila melanogaster[J]. Aging Cell, 2014, 13 (4) :596–604 . |
| [26] | Coquin L, Feala J D, McCulloch A D, et al. Metabolomic and flux-balance analysis of age-related decline of hypoxia tolerance in Drosophila muscle tissue[J]. Mol Syst Biol, 2008, 4 (1) :233. |
| [27] | Zhou Y, Zheng X, Liu X, et al. Metabonomic analysis of urine from chronic unpredictable mild stress rats using gas chromatography-mass spectrometry[J]. Chromatographia, 2012, 75 (3/4) :157–164 . |
| [28] | Lauri A, Pompilio G, Capogrossi M C. The mitochondrial genome in aging and senescence[J]. Ageing Res Rev, 2014, 18 :1–15 . |
 2016, Vol. 47
2016, Vol. 47


