2. 江苏康缘药业股份有限公司, 江苏 连云港 222001 ;
3. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. Jangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China ;
3. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
青蒿Artemisiae Annuae Herba是菊科(Compositae)青蒿属Artemisia L. 植物黄花蒿Artemisia annua L. 的干燥地上部分,秋季花盛开时采收,具有清热解暑、除蒸、截疟等功效[1-2]。青蒿作为热毒宁注射液的君药,提取工艺分为挥发油提取(挥发性成分)和加水煎煮(非挥发性成分)两部分。经过高温煎煮,青蒿素类成分受到破坏,其主要有效非挥发性成分为有机酸类[3-4]。由于有机酸类的量较低,在提取精制阶段并无明确的在线控制指标,本实验首次将近红外光谱(NIRS)技术引入到热毒宁注射液原料青蒿的生产工艺过程中,以总酸和固含量为在线监控指标,建立非挥发性成分的快速定量测定模型。NIRS技术作为一种快速、无损的过程分析技术[5],已经在食品、农产品等领域被较为广泛地成功运用[6],但在中药领域的应用还不是很成熟。由于中药体系的复杂性,NIRS技术的应用针对不同的中药材有不同的特性。
在热毒宁注射液青蒿醇沉上清液的单效浓缩生产工艺过程中,青蒿醇沉上清液未浓缩前为透明的淡黄色溶液,由于浓缩过程中水醇溶液的挥发,溶液颜色逐渐变为不透明的深棕色,溶液颜色变化引起的NIRS吸光度(A)变化范围为0~2.0,变化的幅度比较大,据文献报道,A值大于1.5的光谱不宜建模[7-8],但是并无相关的明确研究确切地说明A值的大小对近红外建模效果的影响,只是理论的推测。本实验以青蒿单效浓缩液为研究对象,确切地说明了A值大于1.5的光谱建模的可行性,并分析了原因,为NIRS技术在中药领域的应用做了探索和铺垫。
1 仪器与材料Luminar 3060型AOTF近红外光谱分析仪,美国Brimrose公司;BSA224S-CW型万分之一电子天平,德国Sartorius公司;0.2、1.0 mL移液枪,德国Eppendorf公司;H1650型台式高速离心机,湖南湘仪实验室仪器开发有限公司;DHG-9143BS-III型电热恒温鼓风干燥箱,上海新苗医疗器械制造有限公司;负压自动取样机,无锡维邦工业设备成套技术有限公司;C22N/500单效浓缩罐,浙江温兄机械阀业有限公司;CoriolisMaster CE0045/0044在线密度计,ABB公司。
绿原酸对照品(批号110753-201415,质量分数96.2%),中国食品药品检定研究院;分析纯甲醇,南京化学试剂有限公司;青蒿单效浓缩液(相对密度1.10~1.12,温度60~70 ℃)由江苏康缘药业股份有限公司中药现代化数字化提取工厂提供。
2 方法与结果 2.1 青蒿单效浓缩样品的收集在取样点连接负压取样机,调试取样参数,在浓缩刚开始时启动取样程序,终点浓缩前每5分钟取1个样,进入终点浓缩后每分钟取1个样。共取样9批,分别为Z150417(样10个)、Z150502(样18个)、Z150602(样25个)、Z150603(样20个)、Z150702(样20个)、Z150811(样22个)、Z1508112(样24个)、Z150818(样24个)、Z150819(样26个),共计189个样品。
2.2 在线NIRS的采集打开单效浓缩罐T3015的在线近红外检测16通道,Luminar 3060近红外仪器有关参数设置如下:光谱扫描范围1 100~2 300 nm,扫描次数300次,分辨率1 nm,波长增量2 nm,光纤透射探头光程2 mm,Ratio模式。
2.3 单效浓缩过程中监控指标的测定 2.3.1 密度测定单效浓缩罐上装有在线密度计,可实时在线监测浓缩液的密度。
2.3.2 总酸测定热毒宁注射液有效成分有机酸类成分在青蒿中的量较低,低于近红外的检测限,所以本实验中以总酸的量作为控制指标。
(1)对照品溶液的制备 精密称量绿原酸10.023 mg,用50%甲醇定容到50 mL棕色量瓶中,置于4 ℃的冰箱中作为母液备用。移液枪移取绿原酸母液0.125、0.200、0.250、0.400、0.500、0.800、1.000 mL,用50%甲醇分别定容到10 mL棕色量瓶中,得到系列对照品溶液。
(2)供试品溶液的制备 将取得的生产样品用50%甲醇稀释到合适的质量浓度,即得供试品溶液。
(3)供试品溶液的测定[1] 用50%甲醇作为空白,根据热毒宁注射液质量标准,在327、400 nm下分别测定对照品和样品的A值A1、A2,建立对照品溶液质量浓度(X,μg/mL)和ΔA值(Y=A1-A2)之间的标准曲线(R2≥0.999 8),标准曲线方程Y=0.052 92 X-0.001 04,R2=0.999 9,结果表明总酸在2.51~20.05 μg/mL线性关系良好。测定样品的量,稀释的样品A值控制在0.2~0.7。
2.4 固含量测定[3]固含量可以反映青蒿浓缩液中指标成分的总体变化。中药作为一个复杂的体系,从中药整体性角度出发,选取了固含量作为近红外实时监控指标。
将蒸发皿烘干至恒定质量(M0)。吸取青蒿单效浓缩过程中药液适量(M2)。水浴蒸干后,105 ℃烘至恒定质量,取出置干燥器中冷却30 min,迅速称定质量(M1),固含量=(M1-M0)/(M2-M0)。
2.5 NIRS模型的建立及模型验证青蒿NIRS在线监测模型采用经典的偏最小二乘(PLS)法建立,优化模型主要采用相关系数(R)或决定系数(R2)、校正集均方根误差(RMSEC)和交叉验证集均方根误差(RMSECV)来评价,模型预测准确性主要采用R或R2、预测集相对偏差(RSEP)来验证。
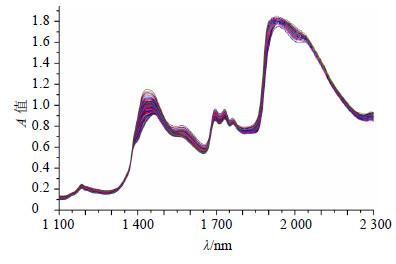
2.5.1 光谱建模波段选择青蒿单效浓缩液的原始光谱图见图 1。因为青蒿单效浓缩液的初始溶剂是80%左右的乙醇,所以光谱在1 450 nm及1 920~1 950 nm附近水峰的干扰没有纯水明显。但还是比较了除去水峰的波段和含水峰波段建模的效果,结果见表 1。由表 1可知,波段1 100~2 300 nm具有更高的R值和更低的RMSEC、RMSECV值,因此,本实验中直接采用的是仪器固有的扫描波段,即1 100~2 300 nm为建模波段。
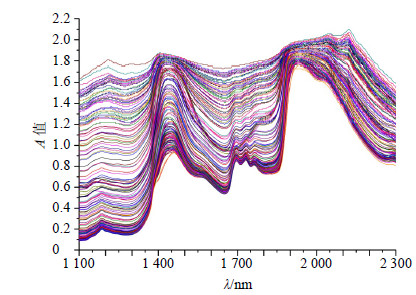
|
图 1 青蒿单效浓缩液的原始NIRS Fig.1 Original NIRS of single-effect concentration solution of AAH |
|
|
表 1 不同波段总酸和固含量的模型参数比较 Table 1 Comparison on model parameters of total acid and soluble solid contents using different wavebands |
2.5.2 光谱预处理方法选择
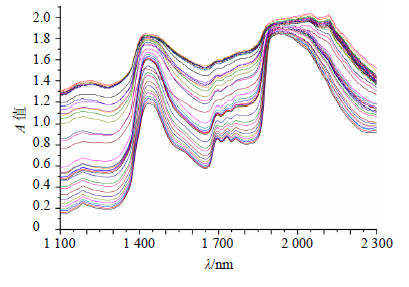
在线采集光谱,会有很多因素的干扰,可能会造成光谱基线的偏移和噪音信号的放大,因而需要对光谱进行预处理,不同预处理方法得到的模型参数见表 2。结果表明,1阶导数结合S-G平滑的方法具有最高的R值和最低的RMESC、RMSECV值,因此光谱预处理方法选择1阶导数结合S-G平滑法,预处理后NIRS见图 2。
|
|
表 2 不同光谱预处理方法所建立的模型参数 Table 2 Comparison on model parameters of total acid and soluble solid content using different preprocessing methods |
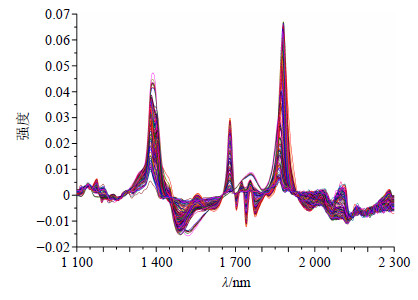
|
图 2 一阶导数+S-G平滑处理后的NIRS Fig.2 NIRS processed by treatment of first-order derivate and Savitzky Golay smooth |
2.5.3 异常样品剔除
总酸和固含量样品的残差-杠杆值分布图见图 3。杠杆值和残差值越接近于0越有利于模型的建立,远远偏离空间样品相对集中分布区域的样品则为异常样品。因此样本10、46、135、52、73为总酸模型的异常样本,样本10、47、135、52、73为固含量模型的异常样本。
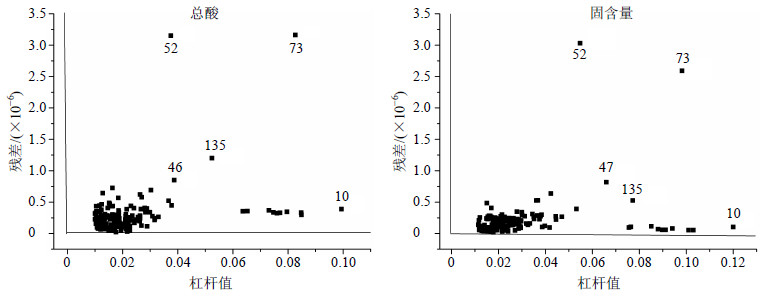
|
图 3 总酸和固含量样品的残差-杠杆值分布图 Fig.3 Distribution of sample residual leverage values of total acid and soluble solid content |
2.5.4 建立PLS定量模型
将优化后的9批光谱数据进行合并,导入Unscrambler建模软件,并将光谱一一对应总酸和固含量的实测值,采用留一交叉验证法建立青蒿总酸和固含量的定量校正模型。总酸和固含量的PLS模型的校正集R2分别为0.967 9和0.962 3,RMSEC分别为0.783 5和0.948 8,RMSECV分别为0.825 8和0.978 0。校正集预测值与真实值的线性关系见图 4。所建模型的R值较大,RMSEC和RMSECV值较小,可用于青蒿单效浓缩过程总酸和固含量的定量测定。
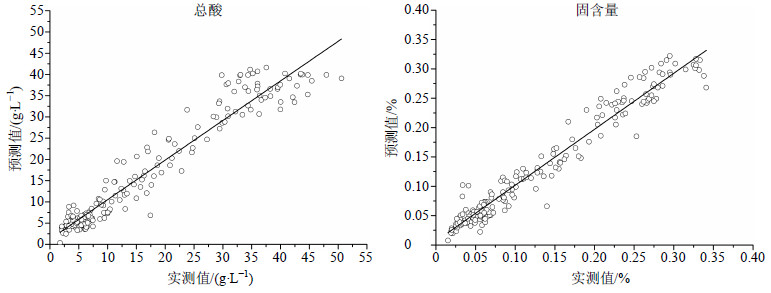
|
图 4 校正集总酸和固含量预测值与实测值的线性相关性图 Fig.4 linear correlation figure of predicted and actual values of total acid and soluble solid contents of calibration set |
2.5.5 模型验证[3, 10]
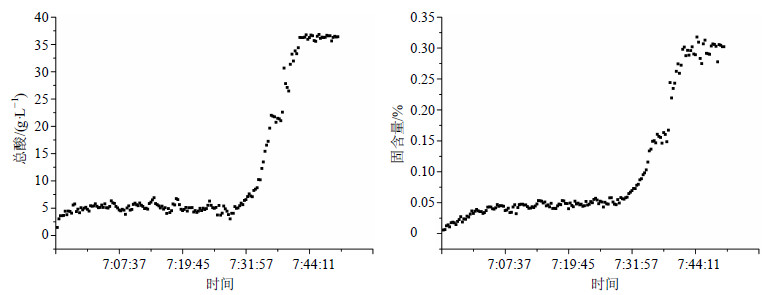
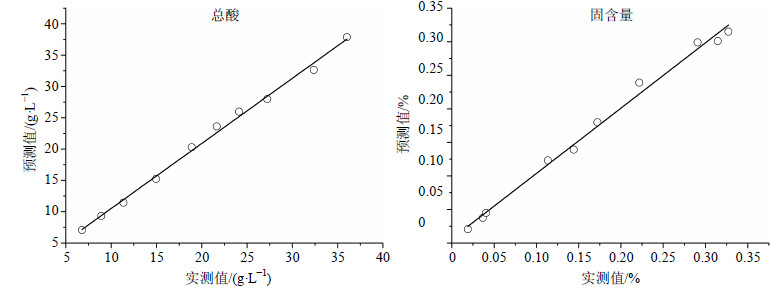
将建好的模型文件导入近红外预测软件中,在线收集单效浓缩液第10批Z150829的NIRS,总酸和固含量预测值的趋势图见图 5。在采集光谱的过程中,在线取10个样测定其总酸与固含量的值,记录取样时间,找出样品对应时间点的光谱及预测值,计算验证集的R2和RSEP。总酸和固含量验证集R2分别为0.995 9和0.993 5,其验证集总酸和固含量预测值与实测值的线性相关性见图 6。RSEP分别为6.15%和7.14%,均在10%以内。
|
图 5 Z150829批总酸和固含量的全过程预测值的趋势图 Fig.5 Trendgram of predicted values of total acid and soluble solid contents in entire procedure of Z150829 |
|
图 6 验证集总酸和固含量预测值与实测值的线性相关性 Fig.6 linear correlation of predicted and actual values of total acid and soluble solid contents of validation set |
3 讨论
单效浓缩过程不同于离线实验旋转蒸发瓶中的浓缩过程,由于浓缩液量大,分为补液浓缩和终点浓缩2部分。本实验中,青蒿补液浓缩约30 min,终点浓缩约15 min。在补液浓缩过程中,浓缩达到一定液位,就会继续加样,其量的变化较为缓慢。进入终点浓缩后,不再补液,其量变化随体积的减少急剧增加,直至达到终点。补液浓缩过程中,青蒿浓缩液的颜色由浅黄色变为深黄色,A值变化见图 7;终点浓缩后,溶液颜色由深黄色变为深棕色,A值变化见图 8。
|
图 7 青蒿单效浓缩液补液浓缩过程A值变化图 Fig.7 Absorbance variation of fluid infusion concentration process of single-effect concentration solution of AAH |
|
图 8 青蒿单效浓缩液终点浓缩过程吸光度变化图 Fig.8 Absorbance variation of endpointconcentration process of single-effect concentration solution of AAH |
A与透过率(T)的关系式为A=−lgT,即T=10−A,当A值在1~2,即光的T在1%~10%,光的T值大小直接影响到有效信息的获取,根据文献报道[7-8],A值大于1.5的光谱不宜建模,主要原因可能是大部分物质如果T值太低,其获取的有效信息也相对较少,因而不提倡建模,但是这个有效信息和物质对近红外的响应有关,T值低不代表响应低,如果运用合适的化学计量学方法,就可以将物质的有效信号再放大,经过化学计量学的计算,响应高的物质虽然透过率低,建模依然是可行的。此理论可通过青蒿的终点浓缩来说明,由图 8可知,终点浓缩过程中光谱A值很快由0.15左右升至1.3左右,光谱波峰A值范围维持在1.6~2.0。本实验中青蒿的终点浓缩过程持续时间约15 min,约12 min的时间光谱波峰A值大于1.5,但是建模效果良好,推测青蒿对近红外的响应良好,样本数和光谱预处理方法可以消除透过率不足造成的误差。在本实验中,补液浓缩过程是每5分钟取1个样,1批约6个样,终点浓缩过程是每分钟取1个样,约15个样,终点浓缩的样本数是补液浓缩的2.5倍左右。预测集补液缩过程的总酸和固含量的RSEP值分别为5.88%和8.64%,终点浓缩过程的总酸和固含量的RSEP值分别为3.77%和3.01%,终点浓缩过程的RSEP值小于补液浓缩过程,由此推测,NIRS模型中1个浓度点的样本数越多,对该浓度点的预测越准确。此外,青蒿PLS模型建立前,光谱预处理采用了1阶导数结合S-G平滑方法,可以降低外界因素对NIRS模型的干扰,提取更多的有效建模信息。本实验中青蒿单效浓缩PLS模型的建立说明样本数和光谱预处理可以消除吸光度过高带来的理论偏差,NIRS模型的建立是可行的。
4 结论本研究首次建立了青蒿单效浓缩过程总酸和固含量的快速定量测定模型,该模型能够实时监控青蒿单效浓缩过程中总酸和固含量的变化,增进了对该浓缩过程的了解和控制。此外,通过青蒿浓缩液颜色的变化导致NIRS吸光度的变化,阐述了增加样本数和优选光谱预处理方法可以消除吸光度过高即透过率太低带来的系统误差。在线的模型由于受药液温度、流速、固体颗粒的影响,光谱噪音很大,需要进行光谱预处理,来提取更多的建模有效信息;同时在线模型样本数量要远大于实验室离线样本数,为了得到更精确的模型,需不断地补充样本数,对模型进行更新和校正,使预测的结果更加准确。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 张秋红, 朱子微, 李晋, 等. 中药青蒿化学成分与种植研究现状[J]. 中国医药导报, 2011,8 (19) :10–12. |
| [3] | 杜文俊, 刘雪松, 陶玲艳, 等. 热毒宁注射液金银花和青蒿(金青)醇沉过程中多指标的近红外快速检测[J]. 中草药, 2015,46 (1) :61–62. |
| [4] | 李海波. 热毒宁注射液药效物质基础研究[D]. 南京:南京中医药大学, 2013. |
| [5] | 张广仁, 吴云, 靳瑞婷, 等. 基于近红外光谱分析技术的散结镇痛胶囊药物质量分数分析[J]. 中国中药杂志, 2015,40 (16) :3204–3208. |
| [6] | 孙通, 徐惠荣, 应义斌. 近红外光谱分析技术在农产品/食品品质在线无损检测中的应用研究进展[J]. 光谱学与光谱分析, 2009,29 (1) :122–125. |
| [7] | 金叶, 丁海樱, 吴永江, 等. 近红外光谱技术用于血必净注射液提取过程的在线检测研究[J]. 药物分析杂志, 2012,32 (7) :1214–1219. |
| [8] | Niu X Y, Shen F, Yu Y F, et al. Analysis of sugar in Chinese rice wine by fourier transform near-infared spectroscopy with partial least-squares regression[J]. J Agric Food Chem, 2008, 56 (16) :7271–7278 . |
| [9] | 王雪, 张伟, 张亚飞, 等. 热毒宁注射液中总有机酸含量的快速测定[J]. 时珍国医国药, 2015,26 (4) :836–837. |
| [10] | 吴莎, 刘启安, 李云, 等. 最小二乘支持向量机和偏最小二乘法在栀子中间体纯化工艺近红外定量分析中的应用[J]. 中草药, 2015,46 (7) :990–991. |
 2016, Vol. 47
2016, Vol. 47


