2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001 ;
3. 暨南大学中药及天然药物研究所, 广东 广州 510632
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China ;
3. Institute of Traditional Chinese Medicine and Natural Products, Jinan University, Guangzhou 510632, China
中药复方热毒宁注射液是江苏康缘药业股份有限公司独家产品,处方由栀子、青蒿和金银花3味中药精制而成,具有清热、疏风、解毒的功效,临床上主要用于治疗外感风热所致的感冒、咳嗽;上呼吸道感染、急性支气管炎等症[1-4]。其临床疗效确切,效果显著,本课题组前期已从热毒宁注射液抗病毒活性部位中分离鉴定了20个化合物[5],在上述研究的基础上,继续对抗病毒活性部位进行系统的化学成分研究,从中分离得到14个化合物,分别鉴定为(2E,6S)-8-[α-L-arabinopyranosyl-(1″-6′)-β-D- glucopyranosyloxy]-2,6-dimethylct-2-eno-1,2″-lactone(1)、落叶脂素(lyoniresinol,2)、5′-甲氧基异落叶松树脂醇(5′-methoxyisolariciresinol,3)、异落叶松脂素(5′-methoxyisolariciresinol,4)、(7R,8R)-4,7,9,9′- tetrahydroxy-3,3′-dimethoxy-8-O-4′-neolignan(5)、(7S,8R)-4,7,9,9′-tetrahydroxy-3,3′-dimethoxy-8-O-4′- neolignan(6)、肥牛木素(ceplignan,7)、5′-甲氧基肥牛木素(5′-methoxyceplignan,8)、(−)-二氢脱氢二松柏醇 [(−)-dihydrodehydrodiconiferyl alcohol,9]、(7S,8R)-3,3′,5-trimethoxy-4′,7-epoxy-8,5′-neolignan- 4,9,9′-triol(10)、2-顺式-4-反式-脱落酸 [(2-cis,4-trans)-abscisic acid,11]、2-反式-4-反式-脱落酸 [(2-trans,4-trans)-abscisic,12]、(1S,3R,4R,5S,7R,9R)- decane-6-carboxylic acid(13)、(1S,3R,4S,5S,7R,9R)- decane-6-carboxylic acid(14)。其中,化合物8为新化合物,其他化合物均为首次从中药复方热毒宁注射液中分离得到。对分离所得到的化合物进行体外抗登革热病毒的活性测试,结果显示化合物1对登革热病毒的EC50值为74.76 μmol/L,选择指数(SI)值大于1.07,具有体外抗登革热病毒的活性。
1 仪器与材料Brucker AVANCE400型核磁共振仪(瑞士Brucker公司),Finnigan LCQ Advantage MAX质谱仪(美国Thermo Fisher Scientific公司),Waters Snapt G2 mass spectrometer高分辨质谱仪(美国Waters公司),JASCO J-810 CD光谱仪(日本分光株式会社),Shimadzu分析高效液相色谱(日本Shimadzu公司,Shimadzu LC-6AD泵,紫外检测器),Shimadzu制备型高效液相色谱(日本Shimadzu公司)。分析高效液相色谱柱为C18柱(250 mm×4.6 mm,5 μm,Nacalai Tesque Inc.,日本),制备高效液相色谱柱为C18柱(250 mm×20 mm,5 μm,Nacalai Tesque Inc.,日本)。薄层硅胶GF254和柱色谱硅胶(青岛海洋化工厂),HP-20大孔树脂(Mitsubishi-Chemical,日本),反相ODS填料(Merck公司),Sephadex LH-20填料(Amersham Biosciences公司),Toyo-pearl HW-40填料(Toyo Soda MFG);热毒宁注射液(江苏康缘药业股份有限公司生产,批号100906);乳仓鼠肾细胞(BHK细胞,中国科学院武汉病毒所),登革热报告病毒(中国科学院武汉病毒所)。
Brucker AVANCE400型核磁共振仪(瑞士Brucker公司),Finnigan LCQ Advantage MAX质谱仪(美国Thermo Fisher Scientific公司),Waters Snapt G2 mass spectrometer高分辨质谱仪(美国Waters公司),JASCO J-810 CD光谱仪(日本分光株式会社),Shimadzu分析高效液相色谱(日本Shimadzu公司,Shimadzu LC-6AD泵,紫外检测器),Shimadzu制备型高效液相色谱(日本Shimadzu公司)。分析高效液相色谱柱为C18柱(250 mm×4.6 mm,5 μm,Nacalai Tesque Inc.,日本),制备高效液相色谱柱为C18柱(250 mm×20 mm,5 μm,Nacalai Tesque Inc.,日本)。薄层硅胶GF254和柱色谱硅胶(青岛海洋化工厂),HP-20大孔树脂(Mitsubishi-Chemical,日本),反相ODS填料(Merck公司),Sephadex LH-20填料(Amersham Biosciences公司),Toyo-pearl HW-40填料(Toyo Soda MFG);热毒宁注射液(江苏康缘药业股份有限公司生产,批号100906);乳仓鼠肾细胞(BHK细胞,中国科学院武汉病毒所),登革热报告病毒(中国科学院武汉病毒所)。
2 提取与分离热毒宁注射液成品浓缩液840 g,用适量水溶解后经HP-20大孔吸附柱色谱,乙醇-水(水及30%、95%乙醇)梯度洗脱,得到水洗脱部位RDN-1(410 g),30%乙醇洗脱部位RDN-2(318 g),95%乙醇洗脱部位RDN-3(84 g)。取RDN-3(65 g)进行硅胶柱色谱分离,氯仿-甲醇(98︰2、95︰5、90︰10、80︰20、70︰30、50︰50、30︰70、0︰100)梯度洗脱共得到9个流分Fr. 1~9。Fr. 1经反复硅胶、ODS和Sephadex LH-20柱色谱以及反相HPLC分离,得到化合物12(11.6 mg)、13(8.6 mg)、14(5.2 mg)。Fr. 2经反复硅胶、ODS和Sephadex LH-20柱色谱以及反相HPLC分离,得到化合物2(15.6 mg)、3(5.6 mg)、4(6.2 mg)、5(4.7 mg)、6(11.9 mg)、7(6.3 mg)、8(7.1 mg)、9(3.3 mg)、10(8.8 mg)和11(12.5 mg)。Fr. 4经过ODS中低压柱色谱分离,甲醇-水(10%甲醇-水、30%甲醇-水、50%甲醇-水、70%甲醇-水和100%甲醇)梯度洗脱,50%甲醇-水洗脱部分经HPLC制备(25%乙腈)得到化合物1(69.5 mg)。
3 结构鉴定化合物8:黄色无定形粉末,ESI-MS m/z: 377 [M+H]+,375 [M-H]−,提示相对分子质量为376。HR-ESI-Q-TOF-MS给出m/z 377.123 3 [M+H]+(计算值为377.123 6),确定化合物分子式为C19H20O8,不饱和度为10。1H-NMR (400 MHz,CD3OD) 谱中显示了20个氢信号,其中4个芳香质子信号[δ 6.69 (2H,s,H-2′,6′),7.59 (1H,brs,H-6),7.63 (1H,brs,H-4)],推测结构中可能存在2个四取代苯环;3个甲氧基质子信号 [δ 3.83 (6H,s,3′,5′-OCH3),3.92 (3H,s,7-OCH3)];13C-NMR (100 MHz,CD3OD) 结合DEPT图谱显示了19个碳信号,9个季碳信号 [δ 170.0 (C-8),133.3 (C-1′),145.9 (C-3′,5′),136.6 (C-4′),125.3 (C-5),145.1 (C-7),153.3 (C-7a),130.2 (C-3a)];4个芳香次甲基碳信号 [δ 104.3 (C-2′,6′),115.5 (C-6),120.7 (C-4)];1个亚甲基碳信号 [δ 64.7 (C-9)];2个亚甲基碳信号 [90.3 (C-2),54.8 (C-3)] 以及3个甲氧基碳信号 [δ 56.8 (3′,5′-OCH3),56.7 (7-OCH3)]。以上数据通过与文献报道[6]的已知木脂素类化合物的核磁数据进行比对,揭示化合物8为C-3′,C-5′和C-7三甲氧基取代和C-8位氧化的苯并二氢呋喃型木脂素。进一步通过HMBC谱进行验证,在HMBC谱中可见δH 3.83 (6H,s,3′,5′-OCH3) 与δC 145.9 (C-3′,5′) 相关,δH 3.92 (3H,s,7-OCH3) 与δC 145.1 (C-7) 相关,δH 7.63 (1H,brs,H-4) 与δC 170.7 (C-8)/115.5 (C-6)/153.3 (C-7a) 相关,通过主要的HMBC相关(图 1)确定了化合物的平面结构与文献报道中的2,3-dihydro-2-(4-hydroxy-3,5- dimethoxyphenyl)-3-(hydroxymethyl)-7-methoxy-5- benzofurancarboxylic acid相一致[7]。通过偶合常数 (J2,3 = 6.3 Hz) 判断化合物8的H-2与H-3处于反式[8]。化合物8的CD谱中,220 (Δ−6.21) 显示负的Cotton效应,与文献进行对比[9],确定化合物8的绝对构型为7S,8R。对所有的碳氢信号进行了归属(表 1),最终确定化合物的结构,命名为5′-甲氧基肥牛木素。
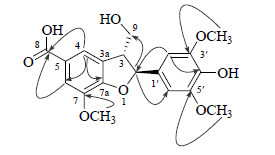
|
图 1 化合物8的主要HMBC相关 Fig.1 Key HMBC correlations of compound 8 |
|
|
表 1 化合物8的NMR数据 Table 1 NMR data of compound 8 |
化合物1:淡黄色无定型粉末,ESI-MS m/z: 485 [M+Na]+,507 [M+HCOO−]−,HR-ESI-Q-TOF-MS给出 m/z 463.217 0 [M+H]+(计算值为463.217 9),确定化合物分子式为C21H34O11,不饱和度为5。1H-NMR (300 MHz,CD3OD) δ: 0.93 (3H,d,J = 6.6 Hz,10-OCH3),1.13 (1H,m,H-7),1.56 (1H,m,H-7),1.37 (1H,m,H-5),1.66 (1H,m,H-5),1.64 (1H,m,H-6),1.81 (3H,brs,9-OCH3),2.39 (1H,m,H-4),2.01 (1H,m,H-4),1.60 (1H,m,H-7),1.14 (1H,m,H-7),6.92 (1H,ddd,J = 8.1,6.0,4.8 Hz,H-3);13C-NMR (75 MHz,CD3OD) δ: 169.6 (C-1),128.1 (C-2),145.5 (C-3),26.9 (C-4),37.2 (C-5),30.7 (C-6),34.6 (C-7),67.6 (C-8),12.1 (C-9),20.7 (C-10),103.2 (C-1′),75.1 (C-2′),78.1 (C-3′),71.1 (C-4′),76.0 (C-5′),63.8 (C-6′),104.4 (C-1″),73.3 (C-2″),72.5 (C-3″),72.4 (C-4″),68.6 (C-5″)。以上数据与文献报道一致[10],故鉴定化合物1为 (2E,6S)-8-[α-L-arabinopyranosyl- (1″-6′)-β-D-glucopyranosyloxy]-2,6-dimethylct-2-eno- 1,2″-lactone。
化合物2:白色固体粉末,ESI-MS m/z: 443 [M+Na]+,419 [M-H]−,相对分子质量为420。结合1H-NMR和13C-NMR数据确定分子式为C22H28O8,不饱和度为9。1H-NMR (300 MHz,CD3OD) δ: 6.38 (2H,s,H-2,6),6.58 (1H,brs,H-2′),4.31 (1H,d,J = 5.7 Hz,H-7),3.86 (3H,s,3′-OCH3),3.74 (6H,s,3,5-OCH3),3.37 (3H,s,5′-OCH3),3.59 (1H,m,H-9′),3.51 (1H,o,H-9′),3.49 (1H,m,H-9),3.46 (1H,m,H-9),2.71 (1H,dd,J = 15.3,5.1 Hz,H-7′),2.52 (1H,dd,J = 15.7,11.4 Hz,H-7′),1.97 (1H,m,H-8′),1.63 (1H,m,H-8);13C-NMR (75 MHz,CD3OD) δ: 138.9 (C-1),106.8 (C-2,6),149.0 (C-3,5),134.5 (C-4),48.9 (C-7),42.3 (C-8),64.1 (C-9),130.1 (C-1′),107.7 (C-2′),148.6 (C-3′),138.9 (C-4′),147.7 (C-5′),126.2 (C-6′),33.8 (C-7′),40.9 (C-8′),66.2 (C-9′),56.7 (3,5-OCH3),56.6 (3′-OCH3),60.1 (5′-OCH3)。以上数据与文献报道一致[11],故鉴定化合物2为落叶脂素。
化合物3:白色固体粉末,ESI-MS m/z: 413 [M+Na]+,389 [M-H]−,相对分子质量为390。结合1H-NMR和13C-NMR数据确定分子式为C21H26O7,不饱和度为9。1H-NMR (400 MHz,CD3OD) δ: 6.42 (2H,s,H-2,6),6.65 (1H,s,H-2′),6.20 (1H,s,H-5′),3.81 (1H,m,H-7),3.80 (3H,s,3′-OCH3),3.77 (6H,s,3,5-OCH3),3.63 (2H,d,J = 3.5 Hz,H-9′),3.40 (1H,dd,J = 11.3,4.0 Hz,H-9),3.67 (1H,m,H-9),2.78 (2H,d,J = 7.7 Hz,H-7′),1.99 (1H,m,H-8′),1.79 (1H,m,H-8);13C-NMR (100 MHz,CD3OD) δ: 137.8 (C-1),107.8 (C-2,6),149.3 (C-3,5),135.0(C-4),48.6 (C-7),47.9 (C-8),62.3 (C-9),129.0 (C-1′),112.4 (C-2′),147.3 (C-3′),145.3 (C-4′),117.3 (C-5′),134.0 (C-6′),33.6 (C-7′),39.9 (C-8′),65.9 (C-9′),56.8 (3,5-OCH3),56.4 (3′-OCH3)。以上数据与文献报道一致[12],故鉴定化合物3为5′-甲氧基异落叶脂素。
化合物4:白色固体粉末,ESI-MS m/z: 383 [M+Na]+,359 [M-H]−,相对分子质量为360。结合1H-NMR和13C-NMR数据确定分子式为C20H24O6,不饱和度为9。1H-NMR (400 MHz,CD3OD) δ: 6.67 (1H,d,J = 1.8 Hz,H-2),6.73 (1H,d,J = 8.0 Hz,H-5),6.60 (1H,dd,J = 8.0,1.8 Hz,H-6),6.65 (1H,s,H-2′),6.17 (1H,s,H-5′),3.80 (1H,m,H-7),3.80 (3H,s,3′-OCH3),3.77 (3H,s,3-OCH3),3.66 (2H,m,H-9′),3.39 (1H,dd,J = 11.3,4.0 Hz,H-9),3.68 (1H,m,H-9),2.77 (2H,d,J = 7.8 Hz,H-7′),1.99 (1H,m,H-8′),1.75 (1H,m,H-8);13C-NMR (100 MHz,CD3OD) δ: 138.6 (C-1),113.8 (C-2),149.0 (C-3),145.9 (C-4),116.0 (C-5),123.2 (C-6),48.0 (C-7),48.1 (C-8),62.2 (C-9),129.0 (C-1′),112.4 (C-2′),147.2 (C-3′),145.3 (C-4′),117.4 (C-5′),134.2 (C-6′),33.6 (C-7′),40.0 (C-8′),65.9 (C-9′),56.4 (3-OCH3),56.3 (3′-OCH3)。以上数据与文献报道一致[13],故鉴定化合物4为异落叶脂素。
化合物5:白色固体粉末,ESI-MS m/z: 401 [M+Na]+,377 [M-H]−,提示相对分子质量为378。结合1H-NMR和13C-NMR数据确定分子式为C20H26O7,不饱和度为8。1H-NMR (400 MHz,CD3OD) δ: 7.01 (1H,d,J = 2.0 Hz,H-2),6.75 (1H,d,J = 8.0 Hz,H-5),6.85 (1H,dd,J = 2.0,8.0 Hz,H-6),6.84 (1H,d,J = 2.0 Hz,H-2′),6.96 (1H,d,J = 8.0 Hz,H-5′),6.70 (1H,dd,J = 2.0,8.0 Hz,H-6′),4.86 (1H,d,J = 4.0 Hz,H-7),4.52 (1H,brs,H-8),3.70 (1H,dd,J = 12.0,4.2 Hz,H-9),3.45 (1H,dd,J = 12.0,5.6 Hz,H-9),2.62 (2H,t,J = 7.8 Hz,H-7′),1.80 (2H,m,H-8′),3.55 (2H,t,J = 6.4 Hz,H-9′),3.81 (3H,s,3-OCH3),3.85 (3H,s,3′-OCH3);13C-NMR (100 MHz,CD3OD) δ: 133.8 (C-1),111.8 (C-2),148.9 (C-3),147.6 (C-4),115.9 (C-5),120.8 (C-6),74.2 (C-7),87.8 (C-8),61.9 (C-9),138.3 (C-1′),114.0 (C-2′),151.7 (C-3′),147.2 (C-4′),119.2 (C-5′),122.1 (C-6′),32.7 (C-7′),35.5 (C-8′),62.2 (C-9′),56.4 (3-OCH3),56.6 (3′-OCH3)。以上数据与文献报道一致[14],故鉴定化合物5为 (7R,8R)-4,7,9,9′-tetrahydroxy-3,3′-dimethoxy-8- O-4′-neolignan。
化合物6:白色固体粉末,ESI-MS m/z: 401 [M+Na]+,377 [M-H]−,提示相对分子质量为378。结合1H-NMR和13C-NMR数据确定分子式为C20H26O7,不饱和度为8。1H-NMR (300 MHz,CD3OD) δ: 7.00 (1H,d,J = 1.8 Hz,H-2),6.73 (1H,d,J = 8.1 Hz,H-5),6.83 (1H,dd,J = 1.8,8.1 Hz,H-6),6.70 (1H,d,J = 2.0 Hz,H-2′),6.81 (1H,d,J = 8.4 Hz H-5′),6.66 (1H,dd,J = 2.0,8.4 Hz,H-6′),4.82 (1H,d,J = 8.0 Hz,H-7),4.28 (1H,m,H-8),3.84 (1H,dd,J = 12.0,6.0 Hz,H-9),3.74 (1H,dd,J = 12.0,3.6 Hz,H-9),2.60 (2H,m,H-7′),1.79 (2H,m,H-8′),3.55 (2H,t,J = 6.5 Hz,H-9′),3.78 (3H,s,3-OCH3),3.80 (3H,s,3′-OCH3);13C-NMR (75 MHz,CD3OD) δ: 134.2 (C-1),111.8 (C-2),148.7 (C-3),147.0 (C-4),115.7 (C-5),121.0 (C-6),74.1 (C-7),86.7 (C-8),62.2 (C-9),138.1 (C-1′),114.0 (C-2′),151.9 (C-3′),147.2 (C-4′),119.7 (C-5′),121.9 (C-6′),32.7 (C-7′),35.6 (C-8′),62.2 (C-9′),56.3 (3-OCH3),56.5 (3′-OCH3)。以上数据与文献报道一致[14],故鉴定化合物6为(7S,8R)-4,7,9,9′-tetrahydroxy-3,3′-dimethoxy-8-O-4′- neolignan。
化合物7:黄色无定形粉末,ESI-MS m/z: 347 [M+H]+,345 [M-H]−,提示相对分子质量为346。结合1H-NMR和13C-NMR数据确定分子式为C18H18O7,不饱和度为10。1H-NMR (400 MHz,CD3OD) δ: 7.62 (1H,s,H-6′),7.59 (1H,brs,H-2′),6.94 (1H,d,J = 1.2 Hz,H-2),6.77 (1H,d,J = 8.2 Hz,H-5),6.82 (1H,dd,J = 8.2,1.2 Hz,H-5′),5.61 (1H,d,J = 6.4 Hz,H-7),3.55 (1H,m,H-8),3.83 (2H,m,H-9),3.81 (3H,s,3-OCH3),3.88 (3H,s,3′-OCH3);13C-NMR (100 MHz,CD3OD) δ: 134.0 (C-1),110.7 (C-2),149.2 (C-3),147.8 (C-4),116.3 (C-5),119.8 (C-6),90.2 (C-7),54.6 (C-8),64.6 (C-9),125.7 (C-1′),115.4 (C-2′),145.2 (C-3′),153.8 (C-4′),130.4 (C-5′),120.8 (C-6′),170.6 (C-7′),56.4 (3-OCH3),56.7 (3′-OCH3)。以上数据与文献报道一致[15],故鉴定化合物7为肥牛木素。
化合物9:白色固体粉末,ESI-MS m/z: 383 [M+Na]+,359 [M-H]−,提示相对分子质量为360。结合1H-NMR和13C-NMR数据确定分子式为C20H24O6,不饱和度为9。1H-NMR (300 MHz,CD3OD) δ: 6.95 (2H,d,J = 1.8 Hz,H-2),6.76 (1H,d,J = 8.1 Hz,H-5),6.83 (1H,dd,J = 8.1,1.8 Hz,H-6),6.73 (2H,brs,H-2′,6′),5.49 (1H,d,J = 6.3 Hz,H-7),3.48 (1H,dd,J = 12.3,6.2 Hz,H-8),3.82 (1H,o,H-9),3.75 (1H,dd,J = 7.1,11.1 Hz,H-9),2.63 (2H,t,J = 7.8 Hz,H-7′),1.82 (2H,m,H-8′),3.57 (2H,t,J = 6.5 Hz,H-9′),3.81 (3H,s,3-OCH3),3.85 (3H,s,3′-OCH3);13C-NMR (75 MHz,CD3OD) δ: 134.2 (C-1),110.5 (C-2),149.1 (C-3),147.5 (C-4),116.1 (C-5),119.7 (C-6),89.0 (C-7),55.5 (C-8),65.0 (C-9),129.9 (C-1′),114.0 (C-2′),145.2 (C-3′),147.5 (C-4′),130.9 (C-5′),117.9 (C-6′),32.9 (C-7′),35.8 (C-8′),62.2 (C-9′) 56.3 (3-OCH3),56.7 (3′-OCH3)。以上数据与文献报道一致[16],故鉴定化合物9为 (−)-二氢脱氢二松柏醇。
化合物10:白色固体粉末,ESI-MS m/z: 413 [M+Na]+,389 [M-H]−,提示相对分子质量为390。结合1H-NMR和13C-NMR数据确定分子式为C21H26O7,不饱和度为9。1H-NMR (400 MHz,CD3OD) δ: 6.68 (2H,brs,H-2,6),6.73 (2H,s,H-2′,6′),5.50 (1H,d,J = 6.3 Hz,H-7),3.57 (1H,overlap,H-8),3.84 (2H,m,H-9),2.63 (2H,t,J = 7.8 Hz,H-7′),1.82 (2H,m,H-8′),3.57 (2H,t,J = 6.5 Hz,H-9′),3.81 (6H,s,3,5-OCH3),3.86 (3H,s,3′-OCH3);13C-NMR (75 MHz,CD3OD) δ: 134.1 (C-1),104.2 (C-2,6),149.3 (C-3,5),137.0 (C-4),89.1 (C-7),55.6 (C-8),65.0 (C-9),136.4 (C-1′),114.1 (C-2′),145.2 (C-3′),147.5 (C-4′),129.8 (C-5′),117.9 (C-6′),32.9 (C-7′),35.8 (C-8′),62.2 (C-9′) 56.7 (3,5-OCH3),56.8 (3′-OCH3)。以上数据与文献报道一致[17],故鉴定化合物10为 (7S,8R)-3,3′,5-trimethoxy-4′,7-epoxy-8,5′-neolignan-4,9,9′-triol。
化合物11:黄色无定形粉末,ESI-MS m/z: 265 [M+H]+,263 [M-H]−,提示相对分子质量为264。HR-ESI-Q-TOF-MS给出m/z 287.127 2 [M+Na]+(计算值为287.125 9),确定化合物分子式为C15H20O4,不饱和度为6。1H-NMR (400 MHz,CD3OD) δ: 5.90 (1H,s,H-3′),2.53 (1H,d,J = 15.7 Hz,H-5′),2.16 (1H,d,J = 15.7 Hz,H-5′),1.00 (3H,s,6′-CH3),1.05 (3H,s,6′-CH3),2.25 (3H,s,2′-CH3),6.24 (1H,d,J = 16.0 Hz,H-5),6.46 (1H,d,J = 16.0 Hz,H-4),5.83 (1H,brs,H-2),1.90 (3H,d,J = 1.2 Hz,3-CH3);13C-NMR (100 MHz,CD3OD) δ: 200.9 (C-4′),127.4 (C-3′),166.3 (C-2′),80.3 (C-1′),42.8 (C-6′),50.7 (C-5′),24.7 (5′-CH3),23.6 (5′-CH3),14.2 (2′-CH3),136.6 (C-5),135.3 (C-4),151.7 (C-3),122.0 (C-2),169.0 (C-1),19.4 (3-CH3)。以上数据与文献报道一致[18],故鉴定化合物11为2-顺式-4-反式-脱落酸。
化合物12:黄色无定形粉末,ESI-MS m/z: 265 [M+H]+,263 [M-H]−,提示相对分子质量为264。HR-ESI-Q-TOF-MS给出m/z 287.127 2 [M+Na]+(计算值为287.125 9),确定化合物分子式为C15H20O4,不饱和度为6。1H-NMR (400 MHz,CD3OD) δ: 5.92 (1H,brs,H-3′),2.53 (1H,d,J = 16.9 Hz,H-5′),2.18 (1H,d,J = 16.9 Hz,H-5′),1.03 (3H,s,6′-CH3),1.06 (3H,s,6′-CH3),1.92 (3H,d,J = 0.8 Hz,3-CH3),6.22 (1H,d,J = 16.3 Hz,H-5),7.76 (1H,d,J = 16.0 Hz,H-4),5.74 (1H,brs,H-2),2.04 (3H,s,3-CH3);13C-NMR (100 MHz,CD3OD) δ: 201.0 (C-4′),127.5 (C-3′),166.5 (C-2′),80.6 (C-1′),42.8 (C-6′),50.6 (C-5′),24.6 (5′-CH3),23.6 (5′-CH3),19.6 (2′-CH3),137.8 (C-5),129.4 (C-4),150.8 (C-3),119.8 (C-2),168.0 (C-1),21.2 (3-CH3)。以上数据与文献报道一致[18],故鉴定化合物12为2-反式-4-反式-脱落酸。
化合物13:白色无定形粉末,ESI-MS m/z: 227 [M+H]+,225 [M-H]−,提示相对分子质量为226。HR-ESI-Q-TOF-MS给出m/z 249.073 7 [M+Na]+(计算值为249.073 9),确定化合物分子式为C11H14O5,不饱和度为5。1H-NMR (400 MHz,CD3OD) δ: 5.04 (1H,overlap,H-1),5.48 (1H,t,J = 1.8 Hz,H-3),3.60 (1H,m,H-4),2.68 (1H,m,H-5),2.19 (1H,d,J = 13.4 Hz,H-6),2.04 (1H,d,J = 13.4 Hz,H-6),5.04 (1H,t,J = 1.6 Hz,H-7),6.07 (1H,ddd,J = 7.1,10.6,17.6 Hz,H-8),2.81 (1H,brd,J = 7.0 Hz,H-9),5.29 (1H,m,H-10),3.73 (3H,s,11-OCH3);13C-NMR (100 MHz,CD3OD) δ: 96.3 (C-1),94.0 (C-3),48.9 (C-4),31.5 (C-5),26.8 (C-6),94.7 (C-7),137.2 (C-8),47.0 (C-9),118.3 (C-10),171.8 (C-11),52.5 (11-OCH3)。以上数据与文献报道一致[19],故鉴定化合物13为 (1S,3R,4R,5S,7R,9R)-decane-6-carboxylic acid。
化合物14:白色无定形粉末,ESI-MS m/z: 227 [M+H]+,225 [M-H]−,提示相对分子质量为226。HR-ESI-Q-TOF-MS给出m/z 249.073 7 [M+Na]+(计算值为249.073 9),确定化合物分子式为C11H14O5,不饱和度为5。1H-NMR (400 MHz,CD3OD) δ: 4.97 (1H,brs,H-1),5.13 (1H,m,H-3),3.23 (1H,t,J = 2.1 Hz,H-4),2.70 (1H,brs,H-5),1.95 (1H,brd,J = 15.0 Hz,H-6),2.44 (1H,m,H-6),5.50 (1H,t,J = 1.8 Hz,H-7),6.02 (1H,ddd,J = 7.0,10.7,17.6 Hz,H-8),2.83 (1H,d,J = 7.3 Hz,H-9),5.25 (1H,m,H-10),3.75 (3H,s,11-OCH3);13C-NMR (100 MHz,CD3OD) δ: 96.8 (C-1),94.1 (C-3),48.7 (C-4),31.7 (C-5),30.6 (C-6),94.0 (C-7),137.4 (C-8),43.0 (C-9),118.1 (C-10),172.0 (C-11),52.5 (11-OCH3)。以上数据与文献报道一致[19],故鉴定化合物14为 (1S,3R,4S,5S,7R,9R)-decane-6-carboxylic acid。
4 化合物体外抗登革热病毒的活性评价 4.1 化合物的细胞毒性检测实验采用AlamarBlue®(Invitrogen)试剂盒检测化合物对细胞的毒性作用。单体化合物的最高毒性测试浓度均为500 μmol/mL。
AlamarBlue®是一种氧化还原指示剂,能根据代谢活性产生吸光度变化和荧光信号。AlamarBlue®易溶于水,其氧化形式进入细胞后经线粒体酶还原产生可测量的荧光及颜色变化,用于细胞活性和细胞增殖的定量分析以及体外细胞毒性研究。这种测定是基于具有代谢活性的细胞将试剂转换成荧光和比色指示剂的能力,受损和无活性细胞具有较低的天然代谢活性,对应的信号较低。因此荧光信号强弱可以反映细胞活性的高低。
细胞活性=(样品孔荧光值-空白对照孔荧光值)/(细胞对照孔荧光值-空白对照孔荧光值)
将单体化合物从起始浓度80 μmol/L连续3倍稀释6个梯度。加药培养后,光镜下观察药物引起的BHK细胞病变效应(CPE),加入AlamarBlue®,37 ℃孵育2 h,荧光检测AlamarBlue®的还原情况,激发光570 nm,发射光595 nm。实验结果见表 2。
|
|
表 2 化合物体外抗登革热病毒活性 Table 2 Anti-Dengue virus activity of isolated compounds in vitro |
4.2 用报告病毒评估化合物抗登革热病毒的活性
实验原理:含Rluc(海肾荧光素酶)报告基因的登革热病毒感染细胞后,Rluc随着病毒的复制得以表达,Rluc报告基因的表达水平可以反映登革热病毒感染水平[20]。实验步骤:(1)细胞铺板:BHK细胞接种于96孔细胞培养板中,待细胞贴壁后备用;(2)加药处理:将单体化合物从起始浓度80 μmol/L连续3倍梯度稀释6个梯度。待细胞长成单层后加入100 μL含2倍药物的DMEM培养液,然后加入100 μL DMEM稀释的登革热报告病毒,37 ℃培养;(3)活性检测:病毒感染后继续培养48 h后,用Luciferase Assay Kit检测Rluc读值。实验设药物组、病毒对照组(病毒感染后未加药物)、细胞对照组(无病毒感染)。
抑制率=1-(药物组-细胞对照组)/(病毒对照组-细胞对照组)
实验结果在检测浓度下,这些化合物对BHK细胞没有明显的细胞毒性,所测试的CC50值大于被测试的最高浓度,且在光学显微镜下看不到明显的细胞病变,其中化合物1具有抗登革热病毒的活性,其EC50值为74.76 μmol/L,SI值大于1.07,其余化合物均未检测到抗登革热病毒的活性。
5 讨论在前期研究的基础上,本研究继续采用活性成分追踪分离的研究思路,从热毒宁注射液抗病毒活性部位(经HP-20大孔吸附树脂,95%乙醇洗脱部位)中分离并鉴定了14个化合物,其中化合物8为新化合物,于洋等[11]从中药栀子中分离得到结构类似的木脂素类化合物,推测化合物8可能来源于栀子,而非生产工艺过程中产生,其余13个化合物均为首次从热毒宁注射液中分离得到。通过采用检测Rluc报告基因的表达水平来反映病毒感染水平的方法,对分离得到的化合物进行了体外抗登革热病毒的活性测试,发现化合物1对登革热病毒的EC50值为74.76 μmol/L,SI值大于1.07,具有体外抗登革热病毒的活性。本研究丰富了热毒宁注射液的化学成分,为全面揭示热毒宁注射液抗病毒临床功效的科学内涵提供一定依据,以期使热毒宁注射液的物质组成谱与功效谱相关联,建立与功效相关联的质量控制方法。
| [1] | Li X H, Zhang X, Ding J B, et al. Comparison between Chinese herbal medicines and conventional therapy in the treatment of severe hand, foot and mouth disease:a randomized controlled trial[J]. Evid-based Complement Alternat Med, 2014, 140764 :1–7 . |
| [2] | 罗先才. 热毒宁注射液药理作用、临床应用及不良反应[J]. 中国药物警戒, 2013,10 (4) :215–218. |
| [3] | 吴彩霞, 张娟娟, 顾雪竹, 等. 热毒宁注射液的临床应用概况[J]. 中国药房, 2014,25 (7) :666–669. |
| [4] | 孙兰, 周军, 王振中. 热毒宁注射液药理作用与临床研究进展[J]. 中国中医急症, 2014,23 (12) :2247–2249. |
| [5] | 李海波, 于洋, 王振中, 等. 热毒宁注射液抗病毒活性成分研究(I)[J]. 中草药, 2014,45 (12) :1682–1688. |
| [6] | Seidel V, Bailleul F, Waterman P G. Novel oligorhamnosides from the stem bark of Cleistopholis glauca[J]. J Nat Prod, 2000, 63 (1) :6–11 . |
| [7] | Katayama T, Nakatsubo F, Higuchi T. Degradation of a phenylcoumaran, a lignin substructure model, by Fusarium solani M-13-1[J]. J Jpn Wood Res Soc, 1986, 32 (7) :535–544 . |
| [8] | Matsuda N, Kikuchi M. Studies on the constituents of Lonicera species. X. Neolignan glycosides from the leaves of Lonicera gracilipes var. glandulosa MAXIM[J]. Chem Pharm Bull, 1996, 44 (9) :1676–1679 . |
| [9] | Liu Q B, Huang X X, Song S J, et al. Neolignans from the seeds of Prunus tomentosa (Rosaceae) and their chemotaxonomic interest[J]. Biochem Syst Ecol, 2014, 55 :236–240 . |
| [10] | Rie K, Mio I, Masao K, et al. A new glycoside from the flower buds of Lonicera japonica[J]. Nat Med, 2000, 54 (6) :314–317 . |
| [11] | 于洋, 高昊, 姚新生, 等. 栀子中的木脂素类成分研究[J]. 中草药, 2010,41 (4) :509–514. |
| [12] | 刘泉, 林文翰. 中国南海红树植物老鼠簕的化学成分研究[J]. 哈尔滨商业大学学报:自然科学版, 2008,24 (6) :648–651. |
| [13] | 周先礼, 张钰, 梁辉, 等. 鳞腺杜鹃化学成分的研究[J]. 中国中药杂志, 2012,37 (4) :483–489. |
| [14] | Ouyang F, Liu Y, Yao X S, et al. Five lignans and an iridoid from Sambucus williamsii[J]. Chin J Nat Med, 2011, 9 (1) :26–29 . |
| [15] | 梅文莉, 戴好富, 吴大刚. 肥牛木中一个新的降新木脂素[J]. 高等学校化学学报, 2006,27 (8) :1480–1481. |
| [16] | 徐巧林, 谢海辉, 吉川雅之. 欧洲李种子的化学成分研究[J]. 热带亚热带植物学报, 2012,20 (3) :299–302. |
| [17] | Wang Y H, Sun Q Y, Yang F M, et al. Neolignans and caffeoyl derivatives from Selaginella moellendorffii[J]. Helve Chim Acta, 2010, 93 (12) :2467–2476 . |
| [18] | 王芳, 蒋跃平, 石建功, 等. 金银花的化学成分研究[J]. 中国中药杂志, 2013,38 (9) :1378–1385. |
| [19] | Gabor K, Akos K, Laszlo F S, et al. Formation of trioxadamantane type aglucones of 3-methoxy secologanin derivatives[J]. Tetrahedron, 1997, 54 (34) :11659–11668 . |
| [20] | Qing M, Liu W, Yuan Z M, et al. A high-throughput assay using dengue-1 virus-like particles for drug discovery[J]. Antiviral Res, 2010, 82 (2) :163–171 . |
 2016, Vol. 47
2016, Vol. 47


