2. 河北医科大学药学院 天然药物化学教研室, 河北 石家庄 050017
2. Department of Natural Medicinial Chemistry, College of Pharmaceutical Sciences, Hebei Medical University, Shijiazhuang 050017, China
海洋约占地球表面积的71.2%,达3.6亿平方公里,占地球总生物圈(biosphere)体积中的95%,是迄今所知最大的生命栖息地。海洋生物占自然界36个动物门类中的35个,其中13个门类是海洋生物所特有的,海洋中存在的海洋生物估计超过1 000万种,海洋生物总量占地球总生物量(biomass)的87%。生命起源于海洋,从海洋中出现最原始的生命到现在已有40多亿年的历史。与对陆生植物的研究相比,人们对海洋生物的认识还相当有限。从最初的单细胞生物开始,在几十亿年的生命演化过程中创造出了丰富多彩的海洋生物世界,加之海洋生物的生存环境与陆生生物迥然不同,如高压、高盐度、寡营养、低温但相对恒温(火山口附近有高温、极地地区还有超低温)、有限的光照和有限的含氧量等,这些生存环境的巨大差异决定了海洋生物在新陈代谢、生存方式、信息传递、适应机制等方面具 有显著的特点,造成海洋生物次级代谢的途径和酶反应机制与陆地生物几乎完全不同,使海洋生物成为资源最丰富、保存最完整、最具有新药开发潜力的新领域。近20年来药物开发越来越困难,耐药性的产生致使每年新药上市的速度几乎等于老药被淘汰的速度,人类迫切需要结构新颖、生物活性和作用机制独特的新天然产物作为新药特别是开发抗癌药物的先导化合物,于是众多研究者把目光投向了海洋[1-7],海洋被誉为人类在21世纪的药库和粮库。
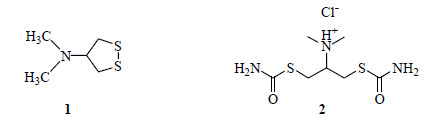
从陆生植物中寻找药物的历史可以追溯到4 000年前,但从海洋生物中研究开发现代药物的历史则较晚。对海洋天然产物的研究可以追溯到20世纪二三十年代,1922年日本学者从生活在浅海泥沙中的异足索沙蚕Lumbriconeris heteropoda体内分离到具有杀虫作用的沙蚕毒素(nereistoxin,1,图 1),1934年明确了其化学结构,其结构异常简单但是毒性却极大,后来以沙蚕毒素为先导化合物成功开发了一系列拟沙蚕毒素杀虫剂用于农业,巴丹(杀螟丹,padan,2,图 1)是这类药剂第一个商品化的杀虫剂,巴丹对害虫具有触杀和胃毒作用,具有一定的内吸作用和杀卵作用,后来开发出杀虫双(dimehypo)、杀螟丹(cartap)和杀虫环(tiocyclam)等。
|
图 1 沙蚕毒素(1)和巴丹(2)的结构 Fig.1 Structures of nereistoxin (1) and padan (2) |
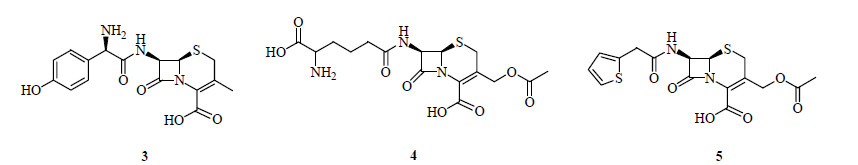
20世纪40年代已经有少数有远见的科学家如美国的Bergman等注意到了海洋天然产物的巨大潜力[8]。1945年,意大利科学家Brotzu(1895—1976)从撒丁岛海洋污泥中分离到一株海洋真菌顶头孢霉菌Cephalosporium acremonium,发现这些顶头孢分泌出的一些物质可以有效抵抗伤寒杆菌、葡萄球菌、链球菌和布鲁氏杆菌,由于当时缺乏必要的设备和经费,1946年他把这种真菌送到了牛津大学。1955年牛津大学的生物化学家Abraham(1913—1999)和Newton从头孢菌液中分离获得若干结构不同于青霉素的第2大类内酰胺类抗菌素头孢菌素类化合物(cephalosporins),其代表化合物是头孢菌素(cephalosporin,3,图 2)和头孢菌素C(cephalosporin C,4,图 2)。此后,经水解获得的头孢烯母核成为一系列头孢菌素类抗生素的合成材料,并在此基础上开发出头孢菌素钠(cefoperazone sodium),为海洋微生物中发现并开发成功的第一个“海洋新抗”,而后进一步开发出先锋霉素(cephalothin,5,图 2),开创了开发海洋新抗生素药的先例。
|
图 2 头孢菌素、头孢菌素C和先锋霉素(3~5)的结构 Fig.2 Structures of cephalosporin, cephalosporin C, and cephalothin(3—5) |
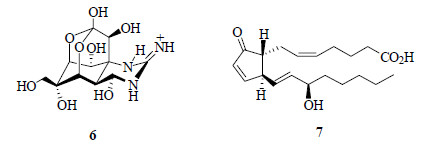
由于20世纪四五十年代正值合成药物和抗生素的黄金时代,海洋天然药物的研究与开发的巨大潜力并没有引起科学界的足够重视。随着20世纪60年代初河豚毒素(tetrodotoxin,TTX,6,图 3)结构鉴定的完成和在Na+通道药理学研究中的广泛应用[9-11],特别是1969年美国科学家Weinheimer和Spraggins从加勒比海柳珊瑚Plexaura homomalla中分离得到了量高达1.4%~1.8%的前列腺素15R-PGA2(15R-prostaglandin A2,7,图 3)[12],也使20世纪60年代末至70年代初海洋天然药物研究出现了一个小高潮。前列腺素是具有强烈生理活性和广谱药理效应的一类物质,但它们在自然界中的量极微,全合成也非常困难,限制了对其深入研究,高含量前列腺素15R-PGA2在海洋生物中的发现具有重大意义,彻底改变了前列腺素研究的被动局面。“向海洋要药物”的概念从此开始逐渐被科学界所接受。
|
图 3 河豚毒素(6)和前列腺素15R-PGA2(7)的结构 Fig.3 Structures of TTX(6)and 15R-prostaglandin A2(7) |
本文主要对近年来已经上市或者具有非常良好前景的10个海洋药物的发现过程及化学结构进行简要介绍,以期能引起更多专业工作者的兴趣,并借此激励有志于科学研究的年轻工作者。
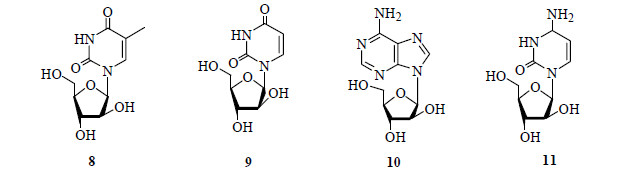
1 阿糖腺苷(Ara-A)和阿糖胞苷(Ara-C)20世纪30年代初,美国耶鲁大学的青年化学家Bergmann等开始了对海洋甾醇类化合物的研究[13],大约在1945年他和他的同事从佛罗里达海域生长的海绵,后来被命名为隐南瓜海绵Crypthoteca crypta的海洋生物中分离得到一种罕见的非甾体含氮化合物,后来进一步证实其为类似于胸腺嘧啶核苷(thymidine)的特异核苷类化合物,为了纪念研究的海绵,把该化合物命名为海绵阿糖核苷(spongothymidine,Ara-T,8,图 4);1951年又从中分离出海绵阿糖尿苷(spongouridine,9,图 4)[14-16],这2个化合物后来成为重要的抗病毒药物阿糖腺苷(vidarabine,Ara-A,10,图 4)和抗癌药物阿糖胞苷(arabinosylcytosine,cytarabine,cytosine arabinoside,cytosar-U,depocyt,arabinofuranosyl cytidine,Ara-C,11,图 4)的先导化合物。
|
图 4 化合物8~11的结构 Fig.4 Structures of compounds 8—11 |
Ara-C(11)具有抗病毒作用,对病毒性眼病、带状疱疹、单纯疱疹性结膜炎有效,1955年被美国FDA批准用于治疗人眼单纯疱疹病毒感染,成为第一个抗病毒的海洋药物,也是第一个由海洋天然产物衍生而来并最终成功上市的药物[17-20]。1956年,Ara-T(8)的全合成完成,并在此基础上研究开发了抗艾滋病及其他抗病毒药物,可以认为它们是核苷类抗病毒药物的先驱,也开创了海洋天然药物研究的先河。如治疗急性淋巴性白血病(acute lymphoblastic leukemia,ALL)的guanine arabinoside(Ara-G,12,图 5)、抗病毒的Acyclovir(13,图 5)、抗HIV的AZT(azidothymidine,zidovudine,14,图 5)和抗癌药物gemticibine(15,图 5),它们都是阿糖核苷和阿糖尿苷的结构类似物。
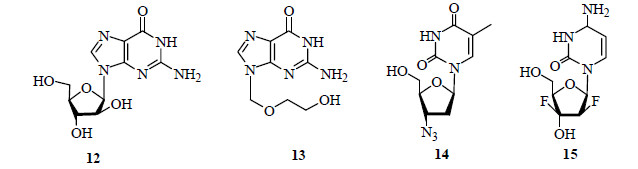
|
图 5 化合物12~15的结构 Fig.5 Structures of compounds 12—15 |
1961年,美国的Upjohn小组完成了Ara-C的人工全合成,并报道了其在动物实验中抗白血病活性研究;后来Ara-C被发现对治疗急性粒细胞白血病有相当好的效果,对恶性淋巴瘤、肺癌、消化道癌、头颈癌也有一定的疗效,又被批准为临床抗肿瘤药物。1987年,AZT(14)成为第一个抗艾滋病毒的药物,商品名Retrovir®,其作用机制是核苷类似物逆转录酶抑制剂(nucleoside analog reverse- transcriptase inhibitor,NRTI),AZT还可以防止孕妇将HIV病毒传染给孩子。AZT已被列入世界卫生组织基本药物名录(World Health Organization’s Model List of Essential Medicines)[21-25]。科学家从柳珊瑚Eunicella中分离得到了天然Ara-A及其乙酰衍生物Ara-U[26]。
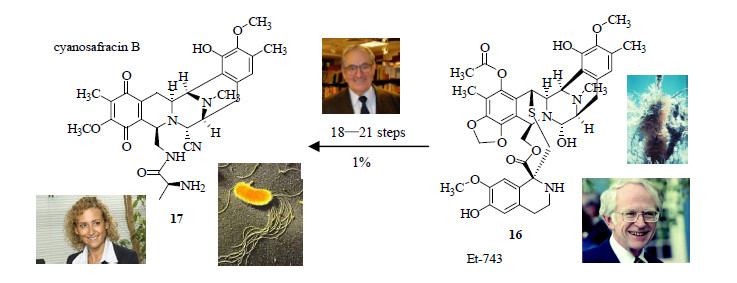
2 海鞘素(曲贝替定,Yondelis®,ecteinascidin 743,Et-743)对Et-743的研究可以追溯到1975年,美国医生Lichter等[27]报道加勒比海被囊动物海鞘Ecteinascidia turbinate Herdman对癌症有一定的治疗作用,由于条件限制并没有活性成分的报道。1990年,佛罗里达大西洋大学的Wright和伊利诺伊大学香槟分校的Rinehart几乎同时从西印度群岛海鞘Ecteinascidia turbinate Herdman中分离得到并确定了ET-743的化学结构(16,图 6),其为含有3个四氢异喹啉环、1个含硫醚键以及1个十元内酯环的生物碱,这是非常独特的结构[28-29]。
|
图 6 Et-743和cyanosafracin B的结构 Fig.6 Structures of Et-743 and cyanosafracin B |
体外实验发现Et-743对微管可产生干扰;Et-743与DNA双螺旋小沟结合,烃化N-2侧链上的鸟嘌呤,进而阻断DNA的复制与合成,达到抑制肿瘤细胞分裂生长的效果;活体测试中Et-743能有效抑制卵巢癌;Et-743能够抑制直接从癌症患者体内取出的胰脏癌、肺癌、大肠癌、乳癌、卵巢癌等细胞生长,认为Et-743是具有开发为抗癌药物的潜力[30-33]。西班牙制药公司PharmaMar获得了Rinehart教授的授权开发了Et-743,但在开发时首先遇到的难题是原料供应问题。Et-743在海洋生物海鞘Ecteinascidia turbinata中量极低,仅百万分之一,为了生产足够的先导化合物trabectedin以用于临床开发,PharmaMar公司养殖了250 t的海鞘Ecteinascidia turbinata,以期从中提取足够的先导化合物,然而复杂的分离和纯化过程导致trabectedin的产量很低,每吨生物原料只能提取不到1 g。哈佛大学的Corey研究小组终于在1996年完成了ET-743全合成路线[34],经过40多步,总收率低于0.53%;2001年的Endo研究小组也完成了其全合成,也是经过40多步,但总收率提高到0.78%;2006年又有2个小组完成了其全合成路线,经过31步,总收率提高到1.7%。Et-743人工全合成尽管已经完成,但成本十分昂贵,研究者不得不寻找其他的解决途径[35]。1999年,PharmaMar的研发总监Cuevas开始利用荧光假单胞菌Pseudomonas fluorescens的生物发酵过程生产抗生素safracin B,该分子拥有许多Et-743的稠环结构,包括稠合哌嗪,但其并不含有十元环,且非常不稳定。Cuevas发现,如果在发酵结束时加入氰化钾(KCN)可以解决该反应的不稳定性并能得到更稳定的cyanosafracin B(17,图 6)。在Ⅲ期临床试验的压力下,Cuevas和另外2名PharmaMar公司的科学家需要制备足量的化合物,他们开始对Corey的合成步骤进行改进,2001年底,该方法终于实现了工业化[36-38]。
2001年5月由欧洲药品评估机构(European Commission,EC)批准Et-743作为治疗难以控制的软组织肉瘤的孤药(orphan drug)进入临床研究;2003年10月又批准其作为治疗卵巢癌的孤药;2007年9月欧盟已批准该药(商品名Yondelis®,曲贝替定)用于晚期软组织肿瘤的治疗,成为第一个现代海洋药物。2009年欧洲药品评估机构批准Yondelis®和DOXIL®/Caelyx®一起用于治疗复发性铂类敏感卵巢癌。2015年10月23日,美国FDA批准Yondelis®用于治疗不可切除的或晚期(转移性)脂肪肉瘤和平滑肌肉瘤,软组织肉瘤是一种较罕见的恶性肿瘤,每年有约5 000人死于此疾病,获批的2项适应症是该肿瘤中恶性程度较高的类型,其适应人群是既往接受过蒽环类化疗药物治疗的患者。目前已在80个国家销售该药物,全球年收入已超过上亿美元。
研究表明,作为全新概念的抗肿瘤烷化制剂,Yondelis®直接作用于肿瘤细胞中的DNA双螺旋间的沟槽,影响并抑制蛋白质的合成,从而抑制肿瘤细胞的分裂和增殖来达到抑制肿瘤的作用[39-41],目前正在进行卵巢癌、前列腺癌和乳腺癌的临床研究[42]。
3 Ziconotide (SNX-111,Prialt®,齐考诺肽)芋螺又称鸡心螺和锥形螺,最早出现在5 500万年前,是最古老的海洋生物物种之一,也是海洋中最大一个属的无脊椎动物。芋螺具有强大的自然进化能力,使之成为海洋无脊椎动物中进化最成功的生物之一。芋螺毒素(conotoxins,conopeptides,CTX)是从海洋腹足纲软体动物芋螺Conus magus Linnaeus的毒液管和毒囊内壁的毒腺分泌出来的、由多达200种单一毒肽组成的混合毒素,主要化学成分是一些对不同离子通道及神经受体高度专一的活性多肽化合物,但是与其他天然肽类毒素相比,芋螺毒素具有相对分子质量小、结构稳定、高活性、高选择性及易于合成等突出优点,它们能特异性地作用于乙酰胆碱受体及其他神经递质的各种受体亚型以及钙、钠、钾等多种离子通道,不仅可直接作为药物,还可作为理想的分子模板用于发展新药先导化合物,对研究神经生物学也具有重要意义。
Ziconotide(18,图 7)是天然芋螺毒素ω-conotoxin的等价合成肽类化合物,1987年通过固相合成获得[43],其结构中含有2个罕见的二硫醚(disulfide)结构。Ziconotide是1979年美国犹他大学菲律宾裔科学家Olivera(图 8)研究小组的McIntosh(图 8)发现的[44-47]。Ziconotide后又被Corporation开发成镇痛药物,商品名为Prialt®,2004年2月28日被美国FDA批准上市,2005年2月22日被欧盟EMEA(European Medicines Agency)批准上市,从临床研究到批准上市历经约30年。
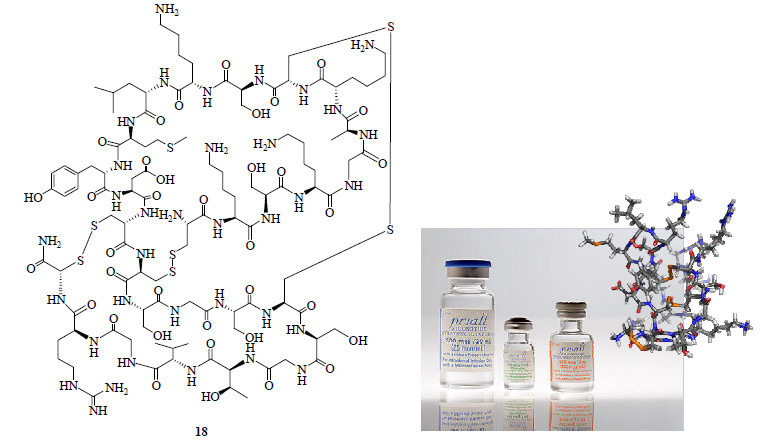
|
图 7 Ziconotide的结构 Fig.7 Structure of ziconotide |

|
图 8 Olivera B. M. 教授(左)和Mcintosh J. M. 教授(右) Fig.8 Prof. Olivera B. M.(left)and Prof. Mcintosh J. M.(right) |
研究表明,Prialt®通过阻断脊髓处的N-型电敏感钙离子通道来抑制主要传出神经元的中心电端释放与疼痛有关的神经传导物质起作用。Elan公司生产的Prialt®通过鞘内注射用于治疗慢性严重疼痛,包括癌症、艾滋病(AIDS)、外伤、背部手术和某些神经系统疾病。Prialt®是目前唯一一个经FDA和EMEA批准的无阿片类成分的鞘内注射镇痛药,镇痛效果是吗啡的上千倍,但没有吗啡的成瘾性,已被推荐作为一线药使用,是第一个海洋来源的肽类药物,也是继吗啡之后临床研究最为彻底的一个镇痛药[48-55]。该药物研发成果曾经登上1990年美国Science杂志封面。2010年Azur Pharma公司获得全球的经销权,仅在2010年的销售额就达到610万美元,2012年达到880万美元。目前科学家们正在开发芋螺毒素多肽用于治疗癫痫病、阿尔茨海默症和帕金森病。
4 艾日布林(eribulin,Halaven®)据调查,目前妇女中乳腺癌的患病率约23%,全球每年有超过百万妇女罹患乳腺癌,患癌率排第1位;因患乳腺癌而死亡人数约占妇女总死亡人数的18%,仅次于肺癌。乳腺癌已经成为妇女的头号杀手。寻找更好的治疗乳腺癌的药物一直是科学家们奋斗的目标之一。继紫杉醇(Taxol®)后,艾日布林(eribulin,E-7389,商品名为Halaven®,19,图 9)是从天然产物中开发的用于治疗转移性乳腺癌药物的又一重大突破。
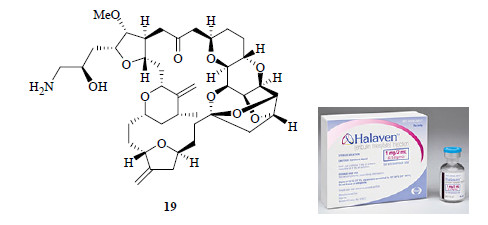
|
图 9 艾日布林的结构 Fig.9 Structure of eribulin |
2010年11月美国FDA批准Halaven®上市,由日本卫材制药公司(Eisai)开发。2016年1月,Halaven®再获美国FDA批准用于治疗晚期脂肪肉瘤新适应症,这也是美国FDA基于统计学显著改善的总生存期(OS)数据所批准的Halaven®的第2个适应症,而Halaven®也由此成为全球首个可显著延长晚期脂肪肉瘤患者生存的新型抗癌药。在美国和日本,Halaven®均被授予治疗软组织肉瘤的孤药地位,近期欧盟及日本监管机构也正在审查Halaven®治疗软组织肉瘤新适应症的申请。软组织肉瘤(soft tissue sarcoma)是对发生于全身软组织(脂肪、肌肉、神经、纤维组织、血管)的一大类恶性肿瘤的统称。据估计,在美国每年确诊病例约1.2万例、欧洲约2.9万例,据日本卫生劳动福利部(MHLW)开展的一项调查显示,日本也约有4 000例患者。Halaven®在2011年就取得了2 800万美元的销售额。Halaven®对于前列腺癌、膀胱癌、卵巢癌和非小细胞肺癌的临床研究也正在进行中。
1985年,日本名古屋大学教授平田义正(Hirata Yoshimasa)实验室的上村大辅(Daisuke Uemura)首先从日本黑海绵Halichondria okadai Kadota中分离出1个具有59个碳链的长链大环内酯聚醚降大田软海绵素A(norhalichondrin A,20,图 10)[56],该化合物具有很强细胞毒作用及抗黑色素瘤B16(IC50为5 ng/mL)活性,这一发现引起了化学家、生物学家和医学界的极大兴趣。1986年又收集了600 kg的日本黑海绵并从其中分离得到7个软海绵素类(halichondrins)化合物,其中以大田软海绵素B(halichondrin B,21,图 10)对黑色素瘤B16活性最好(IC50为0.093 ng/mL)。大田软海绵素B的结构特征是其60个碳的聚醚大环顺式连接的船式吡喃环[57],Halaven®实际是大田软海绵素B的合成衍生物。日本黑海绵是一种日本特有的海绵,1981年日本东北大学的安元健教授从这种海绵中分离出大田软海绵酸(okadaic acid,22,图 10),与此同时美国夏威夷大学的Schueur教授也从加勒比海海绵Halichondria melanodocia Laubenfels中分离出大田软海绵酸[58-59]。大田软海绵酸为含有38个碳长链脂肪酸形成的聚醚类分子,是引起人类食用水生贝壳类发生腹泻性中毒的主要毒素。大田软海绵酸是一种肿瘤促进剂,还能抑制由钙激活的磷脂依赖性蛋白激酶,是一种特殊的蛋白质磷酸酯酶1、2A和2B的抑制剂,还可以用于作为研究细胞调控的工具药[60-61]。
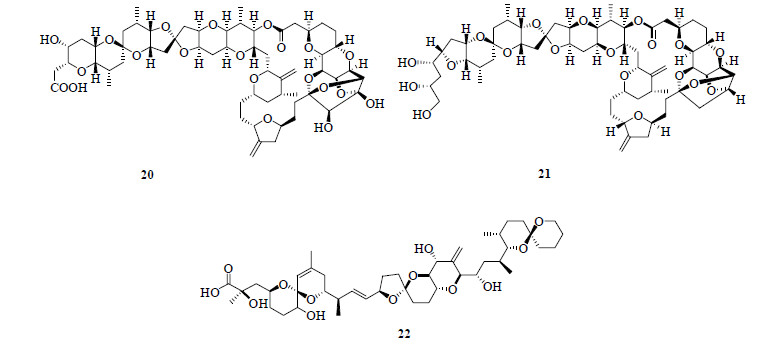
|
图 10 化合物20~22的结构 Fig.10 Structures of compounds 20—22 |
目前大田软海绵素B及其天然类似物仅在5种海洋生物海绵中被发现,即1986年在日本黑海绵、1991年在西太平洋海绵Axinella sp.、1987年在新西兰黑海绵Raspalia agminata、1993年在东印度洋海绵Phakellia carteri以及1987年在新西兰亮黄色海绵Lissodendoryxn sp. 中被发现,其中Lissodendoryxn sp. 是最具开发潜力的海绵品种。海绵Lissodendoryxn sp. 主要分布在新西兰南岛东岸半岛水深80~100 m的海域和日本Kaikoura半岛附近海域水下约5 km2的范围内,总存量仅为300 t左右,每吨该种海绵中仅含有约310 mg的大田软海绵素B。虽然大田软海绵素B在几种天然海洋海绵物种中被发现,但1 t海绵才能提取不到400 mg的大田软海绵素B,仅临床开发就至少需要10 g以上,因此从天然海绵中提取大田软海绵素B不太现实,极大地限制了大田软海绵素B的研发。
大田软海绵素B的全合成的问题摆在了世界有机合成化学家的面前。大田软海绵素B是一个具有32个立体中心的大环聚酮结构,拥有多达40亿个的异构体,但是只有其中1个异构体有很好的活性,其全合成对于合成化学家是极大的挑战。1992年,哈佛大学的岸义人(Yishito Kishi)研发团队终于完成了大田软海绵素B的全合成[62],并且在合成过程中合成了一系列的衍生物。在研究软海绵素B的构效关系时,岸义人发现分子中的38元大环内酯片段对抗肿瘤活性是必须的,这一发现加之其强大的抗肿瘤活性和独特的作用机制引起了制药公司的极大兴趣,经与日本Eisai制药公司合作研究发现,用简单的酮羰基取代原来不稳定的酯基,导致了结构更简单、药效更好、更稳定的eribulin(E7389)即Halaven®的发现[63-64]。Halaven®是目前批量生产的最复杂的小分子药物。
微管靶向药物是乳腺癌治疗中最常用的化疗药物种类之一,但是目前使用的微管靶向药物也存在着诸多的不足,如肿瘤细胞的原发或继发性耐药以及神经病变等副作用,这些都促成了更新、更有效药物的研发和临床应用[65-67]。Halaven®是非紫杉烷类微管抑制剂,通过以微管蛋白为基础的抗有丝分裂机制阻滞、破坏有丝分裂纺锤体,抑制微管的生长,从而导致细胞复制大部分在G2/M期受到抑制,延长有丝分裂时间,导致细胞凋亡而发挥治疗作用。Halaven®能抑制对紫杉耐药的具有β微管蛋白突变的肿瘤细胞生长,能够克服基因改变引起的对紫杉烷类药物的耐药性,与秋水仙碱和长春碱的作用位点和作用机制不同,因此也都不存在竞争机制[68-73]。
5 Brentuximab vedotin(Adcetris®)在20世纪70年代,美国亚利桑那州立大学癌症研究所所长Pettit教授(图 11)等开始对印度洋无壳软体动物截尾海兔Dolabella auricularia中的抗肿瘤活性成分进行研究,发现海兔提取物可以延长P388白血病小鼠的寿命。但是,当时由于获得的这种活性物质量太低以及技术条件的限制,直到20世纪80年代才开始以小鼠白血病P388模型为筛选体系,对印度洋、太平洋等海域的海兔进行了系统的研究。经过用现代色谱技术对2 t原料进行反复分离筛选,1987年从海洋无壳软体动物截尾海兔中分离得到18种由4个氨基酸组成的天然毒性线性缩肽类化合物海兔毒素1~18(dolastatin 1~18)[74-76],后来研究发现海兔毒素实际上是由海兔的食物蓝藻菌Symploca hydnoides Kutzing ex Gomont和Lyngbya majuscula中产生的[77]。药理研究表明,海兔毒素10(dolastatin 10,23,图 12)和海兔毒素 15(dolastatin 15)的活性最好,活性圴超过长春花碱(vinblastine),海兔毒素10的活性又是海兔毒素15的9倍。海兔毒素10对P388白血病细胞的IC50为0.046 ng/mL,是迄今发现活性最强的天然产物之一。除抗肿瘤活性外,最近又发现海兔毒素10具有强烈的抗真菌活性[78-82]。

|
图 11 George Robert(Bob)Pettit教授 Fig.11 Prof. George Robert(Bob)Pettit |
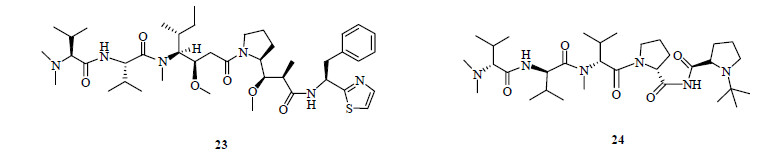
|
图 12 海兔毒素10和tasidotin的结构 Fig.12 Structures of dolastatin 10 and tasidotin |
虽然海兔毒素10的抗肿瘤生物活性非常强,但对正常细胞的毒副作用超出了作为药物的要求,因此科学家合成了大量的衍生物来进行构效关系研究,2008年有2个衍生物进入Ⅱ期临床研究,其中tasidotin(24,图 12)在代谢稳定性、水溶性、生物利用度、毒副作用等方面都比较理想,目前正在进行对其他癌症和联合用药的研究。
Monomethyl auristatin E(MMAE)是人工合成的具有特殊氨基酸的短链肽类抗肿瘤药海兔毒素10的一个衍生物,因其本身具有毒性不能药用,但是可作为微观破坏剂,因此专门从事抗体药物研究的美国西雅图基因公司(Seattle Genetics’ Proprietary)与日本武田制药(Takeda Pharmaceutical Company)合作开发,设想把MMAE与一个单克隆抗体连接,通过连接物把MMAE共价地附着至抗体,如抗体是一种靶向CD30嵌合IgG1,形成抗体偶联药物(antibody-drug conjugates,ADCs),指引其直接作用于多种癌细胞表面的抗原。Brentuximab vedotin(商品名为Adcetris®,25,图 13)即为开发出的最为成功的一个抗体偶联药物,或者称为抗体药物结合物。Adcetris®的抗癌活性是由于ADC靶向地结合至CD30-表达癌细胞,接着ADC-CD30复合物进入癌细胞并通过蛋白水解裂解释放MMAE。在癌细胞内MMAE结合至微管,破坏微管网络,随后引起细胞周期停滞和细胞的凋亡。

|
图 13 Brentuximab vedotin的结构 Fig.13 Structure of brentuximab vedotin |
美国FDA于2011年8月1批准Adcetris®用于治疗霍奇金淋巴瘤(Hodgkin lymphoma,HL)和一种称为系统性间变性大细胞淋巴瘤(systemic anaplastic large cell lymphoma,sALCL)的罕见的淋巴瘤,这也是自1977年第1个被FDA批准用于治疗HL和第1个专门适用于治疗sALCL的新药。目前Adcetris®已经在全球超过45个国家销售,其中西雅图基因公司负责美国和加拿大销售,日本武田制药公司负责其他国家的营销。从1972年发现截尾海兔提取物有抗肿瘤活性到开发成药物Adcetris®上市,经过了约40年的研究历程[83-86]。
6 Plitidepsin(Aplidin®)美国伊利诺州立大学Rinehart教授小组于1981年从加勒比海域生息的一种进化较低的原索动物Didemnum solidum体内发现化合物膜海鞘素A和B(didemnin A、B),药理实验显示其具有较强的抗癌活性[87-91]。该类化合物属环状缩酚酸肽类,目前已经发现的膜海鞘素有10种以上。
体内筛选结果显示,膜海鞘素B(didemnin B,26,图 14)具有强烈的抗P388白血病和B16黑色素瘤活性,可诱导HL-60肿瘤细胞的迅速凋亡以及许多转化细胞的凋亡,但对静息的正常外周血单核细胞不起作用。膜海鞘素B于1984年进入Ⅰ期临床实验阶段,是第1个在美国进入临床研究的海洋天然产物[92-93]。进一步药理研究表明,该化合物对L1210白血病细胞的IC50为2 ng/mL。在膜海鞘素B对几种淋巴细胞的免疫功能实验中,观察到其具较强的免疫抑制活性,且抑制活性强于环孢霉素A(ciclosporin A),但因心脏和神经毒性而被放弃。1991年发现地中海生息的一种原索动物Aplidium albicans Milne Edwaards体内中含有dehydrodidemnin B(plitidepsin,27,图 14)[94],该化合物虽然只比膜海鞘素B少2个氢原子,即膜海鞘素B中的末端乳酸酰基被氧化丙酮酸酰基取代,

|
图 14 膜海鞘素B和plitidepsin的结构 Fig.14 Structures of didemnin B and plitidepsin |
但其抗癌活性却比膜海鞘素强6~10倍[95],且毒性较弱。Pharma Mar’s公司将其进行了临床开发[96],商品名Aplidin®。2004年Aplidin®处于Ⅱ期临床试验,被FDA授权用于罕见病多发性骨髓瘤(multiple myeloma,MM)和急性淋巴性白血病的治疗。
7 Carragelose®Carragelose®(28,图 15)是德国Marinomed公司研发的创新型抗病毒鼻腔喷剂,作为非处方药在欧盟上市,用于治疗成人、1岁以上儿童、妊娠及哺乳女性的普通感冒。该药可抑制病毒附着和进入细胞、减少病毒的复制、缓解病毒引起的症状。Carragelose®来源于红藻科可食用红色海藻的提取物卡拉胶(carrageenans),又称为麒麟菜胶、石花菜胶、鹿角菜胶、角叉菜胶,主要是I型卡拉胶(iota-carrageenan),它的化学结构是由六碳半乳糖及脱水半乳糖所组成的多聚糖类硫酸盐[97-98]。

|
图 15 Carragelose®的结构 Fig.15 Structure of Carragelose® |
8 Lovaza®和Omacor®
Lovaza®和Omacor®是一种特别的鱼油脂类调节剂,由葛兰素史克药厂生产,为目前FDA和EMEA批准的唯一饮食辅助药物,用来降低成年患者的三酰甘油水平。作为抗高脂血症的Lovaza®主要成分是高度多不饱和omega-3脂肪酸(poly-unsatarated fatty acid,PUFA)酯:二十碳五烯酸(eicosapentaenoic acid,EPA)乙酯(29,图 16)和二十二碳六烯酸乙酯(30,图 16)。
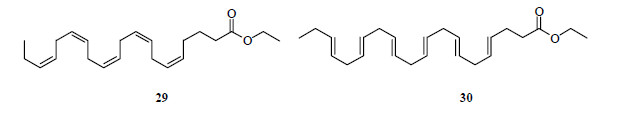
|
图 16 化合物29、30的结构 Fig.16 Structures of compounds 29 and 30 |
Lovaza®和Omacor®不同于一般的非处方食品添加剂,其有严格的特殊制备方法。二者的发现源于流行病学的统计观察,阿拉斯加原著居民的心血管疾病死亡率极低,后来证实和他们饮食中富含高度多不饱和omega-3脂肪酸有密切关系[99-103]。
9 假蕨素A(pseudopterosin A)1983年,美国斯克里普斯海洋研究所的Fenical研究小组在对海洋生物进行生物活性筛选时,从巴哈马海域的一种加勒比海柳珊瑚Pseudopterogorgia elisabethae Bayer中提取了一系列能有效抗炎的化合物假蕨素A~C(pseudopterosin A~C),从化学结构上看类似三环二萜的苷,拥有4个手性中心[104-109],假蕨素A(31)的结构见图 17。
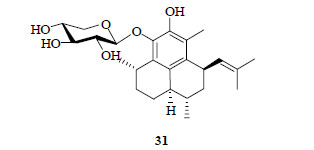
|
图 17 假蕨素A的结构 Fig.17 Structure of pseudopterosin A |
后来,加州大学圣迭戈分校对此类化合物申请了专利。1994—1995年,这种化合物成为整个加州大学财政收入中最赚钱的十大专利之一,为学校带来了68万美元的收入。后来的生物活性研究证明,假蕨素类化合物具有防止皮肤衰老作用[110-114],世界著名化妆品公司雅诗兰黛将其用于系列产品中。早在20世纪90年代假蕨素类的化学衍生物methopterosin(OAS-1000)就曾经作为创伤及接触性皮炎治疗药物进入临床开发阶段[115],可以阻止发炎、肿胀等身体自然的免疫反应,从而加速痊愈过程,有望研制成一种新型清创药物。
10 角鲨胺(squalamine)临床上具有很多能够治疗细菌感染的药物,但有效的抗病毒药物并不多。1993年,美国乔治城大学医学中心Zasloff博士从黑缘刺鲨Centrophorus atromarginatus Garman的肝脏组织中分离得到了具有甾体母核结构的胆固醇类成分角鲨胺(32,图 18)。
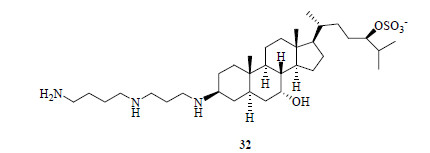
|
图 18 角鲨胺的结构 Fig.18 Structure of squalamine |
药理研究结果显示,角鲨胺具有血管生成抑制作用,并期待用于抗癌药物的研发,后意外发现角鲨胺也具有抗病毒作用[116]。Zasloff博士认为持有正电荷的角鲨胺分子进入细胞后,能够特异性地与带有负电荷的细胞膜内侧像纽扣一样连接,并占有那些病毒感染时依赖性黏贴在细胞内膜上的正电荷蛋白质空间位置,从而降低了细胞对病毒的易感性。角鲨胺在体内外的抗病毒实验中均显示了较好的药效活性,有望用于抑制登革热及肝炎等部分病毒细胞的增殖。同时在实验动物研究中也注意到,角鲨胺对黄热病、马脑炎病毒、巨细胞病毒(cytomegalovirus)也显示一定的药效活性。因此,角鲨胺的抗病毒作用的研发具有一定的理论和社会意义[117-118]。目前全身使用角鲨胺(SqualamaxTM)治疗AMD(age-related macular degeneration)眼的脉络膜新生血管(CNV)正在进行Ⅱ期临床试验。
11 结语浩瀚的海洋不仅提供了千姿百态的生物,更提供了形形色色的天然次生代谢产物,成为新药研发中先导化合物的重要来源。虽然在20世纪80年代,以高通量筛选(high throughput screening,HTS)和组合化学(combinatorial chemistry,CC)为代表的合理药物设计(rational drug design)使大部分药物研发机构一度忽视甚至停止了从天然产物中开发新药的工作,使得天然产物筛选和活性成分的分离几乎成为一门“失传的技术”[119-120]。经历20余年的实践证明,高通量筛选和组合化学并没有在新药研发上带来理想的突破和成果,很多药物研发机构又开始从新重视从天然产物中开发新药的工作[121-124]。2004年以前上市的海洋药物仅有4个,10年后达到了8个,全球海洋药物的产值2016年预计将达到86亿美元[125]。海洋天然产物已经成为新药开发的最重要源泉。
多肽类药物很可能是21世纪重要的预防、诊断、监测和治疗药物,如强效镇痛药Prialt®和海洋肽类抗体药物Adcetris®的上市会极大促进海洋肽类化合物在新药研发方面的研究[126-127]。目前全球多肽药市场已超过200亿美元,慢病治疗领域是多肽药物的核心市场大概能占全球多肽药物市场的75%以上,特别是罕见病、肿瘤和糖尿病将是未来开发的重点领域。2010年11月15日美国FDA批准Halaven®注射液(甲磺酸艾日布林)用于晚期乳腺癌治疗,标志着从复杂天然产物潜在活性的开发到临床应用的艰辛路程达到了高潮。从复杂的大环内酯聚醚halichondrin B到结构更简单、活性更显著、稳定性更好的Halaven®的上市是未来新药开发的一个精彩的典范,必将激发药物研究者向高活性的复杂海洋天然产物进军。
未来海洋生物特别是海洋微生物将是新颖海洋天然产物的宝库,会为新药研发提供源源不断的先导化合物,并为生命科学研究提供新的探索工具[128-133]。
| [1] | Newman D J, Cragg G M. Marine natural products and related compounds in clinical and advanced preclinical Trials[J]. J Nat Prod, 2004, 67 (8) :1216–1238 . |
| [2] | Schumacher M, Kelkel M, Dicato M, et al. Gold from the sea:Marine compounds as inhibitors of the hallmarks of cancer[J]. Biotechnol Adv, 2011, 29 (5) :531–547 . |
| [3] | Gerwick W H, Fenner A M. Drug discovery from marine microbes[J]. Microb Ecol, 2013, 65 (4) :800–806 . |
| [4] | Newman D J, Cragg G M. Natural products from marine invertebrates and microbes as modulators of antitumor targets[J]. Curr Drug Targets, 2006, 7 (2) :279–304 . |
| [5] | Gerwick W H, Moore B S. Lessons from the past and charting the future of marine natural products drug discovery and chemical biology[J]. Chem Biol, 2012, 19 (1) :85–98 . |
| [6] | Jin L M, Quan C S, Hou X Y, et al. Potential pharmacological resources:natural bioactive compounds from marine-derived fungi[J]. Mar Drugs, 2016, 14 (4) :76–91 . |
| [7] | 史清文, 李力更, 霍长虹, 等. 海洋天然产物研究概述[J]. 中草药, 2010,41 (7) :1031–1047. |
| [8] | Bergman W, Feeney R J. Nucleosides of sponges[J]. J Org Chem, 1951, 16 (6) :981–987 . |
| [9] | Bane V, Lehane M, Dikshit M, et al. Tetrodotoxin:Chemistry, toxicity, source, distribution and detection[J]. Toxins, 2014, 6 (2) :693–755 . |
| [10] | Lago J, Rodríguez L P, Blanco L, et al. Tetrodotoxin, an extremely potent marine neurotoxin:distribution, toxicity, origin and therapeutical uses[J]. Mar Drugs, 2015, 13 (10) :6384–6406 . |
| [11] | Mosher H S, Fuhrman F A, Buchwald H D, et al. Tarichatoxin-tetrodotoxin:a potent neurotoxin[J]. Science, 1964, 144 (3622) :1100–1110 . |
| [12] | Weinheimer A J, Spraggins R L. The occurrence of two new prostaglandin derivatives (15-epi-PGA2 and its acetate, methyl ester) in the gorgonian plaxaura homomalla. Chemistry of coelenterates. XV[J]. Tetrahedron Let, 1969, 10 (10) :5185–5188 . |
| [13] | 史清文, 霍长虹, 李力更, 等. 海洋天然产物研究的历史回顾[J]. 中草药, 2009,40 (11) :1687–1695. |
| [14] | Murakami S, akemoto T, Shimizu Z. The effective principle of Digenea simplex Ag. I. Separation of the effective fraction by liquid chromatography[J]. Yakugaku Zasshi, 1953, 73 (9) :1026–1028 . |
| [15] | Bergmann W, Johnson T B. The chemistry of marine animals. I. The sponge Microciona pralifera Z.[J]. Physiol Chem, 1933, 222 (2) :220–226 . |
| [16] | Morimoto H. Stereochemical structures of kainic acid and its isomers[J]. Proc Jpn Acad, 1955, 31 (6) :372–377 . |
| [17] | Ueno Y, Nawa H, Ueyanagi J, et al. Studies on the active compounds of Digenea simplex Ag. and related compounds[J]. J Pharmcol Soc Jpn, 1955, 75 (3) :807–809 . |
| [18] | Bergmann W, Feeney R J. The isolation of a new thymine pentoside from sponges[J]. J Am Chem Soc, 1950, 72 (6) :2809–2810 . |
| [19] | Bergmann W, Feeney R J. The nucleosides of sponges. I[J]. J Org Chem, 1951, 16 (6) :981–987 . |
| [20] | Bergmann W, Burke D C. Spongothymidine and spongouridine[J]. J Org Chem, 1955, 20 (11) :1501–1507 . |
| [21] | Wang W S, Tzeng C H, Chiou T J, et al. "High-dose cytarabine and mitoxantrone as salvage therapy for refractory non-Hodgkin's lymphoma"[J]. Jpn J Clin Oncol, 1997, 27 (3) :154–157 . |
| [22] | Ogbomo H, Michaelis M, Klassert D, et al. "Resistance to cytarabine induces the up-regulation of NKG2D ligands and enhances natural killer cell lysis of leukemic cells"[J]. Neoplasia, 2008, 10 (12) :1402–1410 . |
| [23] | Feist P. A tale from the sea to Ara C[J/OL]. http://www.pfeist.net/ALL/arac/sea2arac1.html. 2005-04-12. |
| [24] | World Health Organization. WHO Model List of Essential Medicines[S]. 2014-04-22. |
| [25] | Pigneux A, Perreau V, Jourdan E, et al. Adding lomustine to idarubicin and cytarabine for induction chemotherapy in older patients with acute myeloid leukemia:the BGMT 95 trial results[J]. Haematologica, 2007, 92 (10) :1327–1334 . |
| [26] | Cimino G, De Rosa S, De Stefano S. Antiviral agents from a gorgonian Eunicella cavolini; one previously found in the sponge Cryptotehya crypta[J]. Experientia, 1984, 40 (2) :339–340 . |
| [27] | Lichter W, Lopez D M, Wellham L L, et al. Ecteinascidia turbinata extracts inhibit DNA synthesis in lymphocytes after mitogenic stimulation by lectins[J]. Proc Soc Exp Biol Med, 1975, 150 (2) :475–478 . |
| [28] | Rinehart K L, Holt T G, Fregeau N L, et al. Ecteinascidins729 743 745 759A 759B and 770:potent antitumor agents from the Caribbean tunicate Ecteinascidia turbinate[J]. J Org Chem, 1990, 55 (15) :4512–4215 . |
| [29] | Wright A E, Forleo D A, Gunawardana G P, et al. Antitumor tetrahydroisoquinoline alkaloids from the colonial ascidian Ecteinascidia turbinate[J]. J Org Chem, 1990, 55 (15) :4508–4512 . |
| [30] | Moore B M, Seaman F C, Wheelhouse R T, et al. Mechanism for the catalytic activation of ecteinascidin 743 and its subsequent alkylation of guanine N2[J]. J Am Chem Soc, 1998, 120 (10) :2490–2491 . |
| [31] | Zewail-Fllte M, Hurley I H. Differential tates of reversibility of ecteinascidin 743-DNA covalent adducts from different sequences lead to migration to favored bonding sites[J]. J Am Chem Soc, 2001, 123 (27) :6485–6495 . |
| [32] | Takebayashi Y, Pourquier P, Zimonjic D B, et al. Anti-proliferative activity of ecteinascidin 743 is dependent upon transcription-coupled nucleotide-excision repair[J]. Nat Med, 2001, 7 (8) :961–966 . |
| [33] | Damia G, Silverstri S, Carrassa L, et al. Unique pattern of ET-743 activity in different cellular systems with defined deficiencies in DNA-repair pathways[J]. Int J Cancer, 2001, 92 (4) :583–588 . |
| [34] | Corey E J, Gin D Y, Kania R S. Enantioselective total synthesis of ecteinascidin 743[J]. J Am Chem Soc, 1996, 118 (38) :9202–9203 . |
| [35] | Mendola D, Naranjo L, Santiago A, et al. The promise of aquaculture for delivering sustainable supplies of new drugs from the sea:examples from in-sea and tank-based invertebrate culture projects from around the world[A]//Proksch P, Müller W E G. Frontiers in Marine Biotechnology[M]. Norwich:Horizon Bioscience, 2006. |
| [36] | Cuevas C, Pérez M, Martín M J, et al. Synthesis of ecteinascidin ET-743 and phthalascidin Pt-650 from cyanosafracin B[J]. Org Lett, 2000, 2 (16) :2545–2548 . |
| [37] | Cuevas C, Francesch A. Development of Yondelis (trabectedin, ET-743). A semisynthetic process solves the supply problem[J]. Nat Prod Rep, 2009, 26 (2) :322–337 . |
| [38] | Ahaidar A, Fernandez D, Perez O, et al. Total syntheses of variolin B and deoxyvariolin B[J]. J Org Chem, 2003, 68 (26) :10020–10029 . |
| [39] | Scotto K W. ET-743:more than an innovative mechanism of action[J]. Anti-Cancer Drugs, 2002, 13 (1) :S3–S6 . |
| [40] | D'Incalci M, Erba E, Damia G, et al. Unique features of the mode of action of ET-743[J]. Oncologist, 2002, 7 (3) :210–216 . |
| [41] | D'Incalci M, Galmarini C M. A Review of Trabectedin (ET-743):A unique mechanism of action[J]. Mol Cancer Ther, 2010, 9 (8) :2157–2163 . |
| [42] | Monk B J, Dalton H, Benjamin I, et al. Trabectedin as a new chemotherapy option in the treatment of relapsed platinum sensitive ovarian cancer[J]. Curr Pharm Des, 2012, 18 (25) :3754–3769 . |
| [43] | Molinski T F, Dalisay D S, Lievens S L, et al. Drug development from marine natural products[J]. Nat Rev Drug Discov, 2009, 8 (1) :69–85 . |
| [44] | Olivera B M E E. Just lecture-Conus venom peptides, receptor and ion channel targets, and drug design:50 million years of neuropharmacology[J]. Mol Biol Cell, 1997, 8 (11) :2101–2109 . |
| [45] | Olivera B M. Conus venom peptides:reflections from the biology of clades and species[J]. Annu Rev Ecol Syst, 2002, 33 (1) :25–47 . |
| [46] | Terlau H, Olivera B M. Conus venoms:A rich source of novel ion channel-targeted peptides[J]. Physiol Rev, 2004, 84 (1) :41–68 . |
| [47] | Olivera B M, Rivier J, Clark C, et al. Diversity of conus neuropeptides[J]. Science, 1990, 249 (4966) :257–263 . |
| [48] | Teichert R W, Memon T, Aman J W, et al. Using constellation pharmacology to define comprehensively a somatosensory neuronal subclass[J]. Proc Natl Acad Sci USA, 2014, 111 (6) :2319–2324 . |
| [49] | Teichert R W, Raghuraman S, Memon T, et al. Characterization of two neuronal subclasses through constellation pharmacology[J]. Proc Natl Acad Sci USA, 2012, 109 (31) :12758–12763 . |
| [50] | Aman J W, Imperial J S, Ueberheide B, et al. Insights into the origins of fish hunting in venomous cone snails from studies of Conus tessulatus[J]. Proc Natl Acad Sci USA, 2015, 112 (16) :5087–5092 . |
| [51] | Essack M, Bajic V B, Archer J A. Conotoxins that confer therapeutic possibilities[J]. Mar Drugs, 2012, 10 (6) :1244–1265 . |
| [52] | Anderson P D, Bokor G. Conotoxins:Potential weapons from the sea[J]. J Bioterr Biodef, 2012, 3 (3) :1–4 . |
| [53] | Lewis R J. Conotoxins:molecular and therapeutic targets[J]. Prog Mol Subcell Biol, 2009, 46 (1) :45–65 . |
| [54] | Olivera B M, Cruz L J. Conotoxins, in retrospect[J]. Toxicon, 2001, 39 (1) :7–14 . |
| [55] | Halai R, Craik D J. Conotoxins:Natural product drug leads[J]. Nat Prod Rep, 2009, 26 (4) :526–536 . |
| [56] | Uemura D, Takahashi K, Yamamoto T, et al. Norhalichondrin A:An antitumor polyether macrolide from a marine sponge Halichondria okadai[J]. J Am Chem Soc, 1985, 107 (15) :4796–4798 . |
| [57] | Hirata Y, Uemura D. Halichondrins-antitumor polyether macrolides from a marine sponge[J]. Pure Appl Chem, 1986, 58 (5) :701–710 . |
| [58] | Tachibana K, Scheuer P J, Tsukitani Y, et al. Okadaic acid, a cytotoxic polyether from two marine sponges of the genus Halichondria[J]. J Am Chem Soc, 1981, 103 (14) :2469–2471 . |
| [59] | Murakami Y, Oshima Y, Yasumoto T. Identification of okadaic acid as a toxic component of amarine dinoflagellate Prorocentrum lima[J]. Nippon Suisan Gakkaishi, 1982, 48 (1) :69–72 . |
| [60] | Yasumota T, Murada M, Oshima Y. Diarrhetic shellfish toxins[J]. Tetrahedron, 1985, 41 (6) :1019–1025 . |
| [61] | Fernández J J, Suárez-Gómez B, Souto M L. Identification of new okadaic acid derivatives from laboratory cultures of Prorocentrum lima[J]. J Nat Prod, 2003, 66 (9) :1294–1296 . |
| [62] | Aicher T D, Buszek K R, Fang F G, et al. Total synthesis of halichondrin B and norhalichondrin B[J]. J Am Chem Soc, 1992, 114 (8) :3162–3164 . |
| [63] | Crane E A, Gademann K. Capturing biological activity in natural product fragments by chemical synthesis[J]. Angew Chem, 2016, 55 (12) :3882–3902 . |
| [64] | Jackson K L, Henderson J A, Phillips A J. The halichondrins and E7389[J]. Chem Rev, 2009, 109 (5) :3044–3079 . |
| [65] | Altmann K H. Microtubule-stabilizing agents:a growing class of important anticancer drugs[J]. Curr Opin Chem Biol, 2001, 5 (4) :424–431 . |
| [66] | Attard G, Greystoke A, Kaye S, et al. Update on tubulin-binding agents[J]. Pathol Biol, 2006, 54 (1) :72–84 . |
| [67] | Towle M J, Salvato K A, Budrow J, et al. In vitro and in vivo anticancer activities of synthetic macrocyclic ketone analogues of halichondrin B[J]. Cancer Res, 2001, 61 (3) :1013–1021 . |
| [68] | Bai R L, Paull K D, Herald C L, et al. Halichondrin B and homohalichondrin B, marine natural products binding in the vinca domain of tubulin. Discovery of tubulin-based mechanism of action by analysis of differential cytotoxicity data[J]. J Biol Chem, 1991, 266 (24) :15882–15889 . |
| [69] | Yu M J, Zheng W, Seletsky B M, et al. Chapter 14-Case history:discovery of eribulin (Halaven) a halichondrin B analogue that prolongs overall survival in patients with metastatic breast cancer[J]. Annu Rep Med Chem, 2011, 46 :227–241 . |
| [70] | Goel S, Mita A C, Mita M, et al. A phase I study of eribulin mesylate (E7389) a mechanistically novel inhibitor of microtubule dynamics in patients with advanced solid malignancies[J]. Clin Cancer Res, 2009, 15 (2) :4207–4212 . |
| [71] | Towle M J, Nomoto K, Asano M, et al. Broad spectrum preclinical antitumor activity of eribulin (Halaven):optimal effectiveness under intermittent dosing conditions[J]. Anticancer Res, 2012, 32 (5) :1611–1619 . |
| [72] | Jones A C, Monroe E A, Eisman E, et al. The unique mechanistic transformations involved in the biosynthesis of modular natural products from marine cyanobacteria[J]. Nat Prod Rep, 2010, 27 (10) :1048–1065 . |
| [73] | Jimeno A. Eribulin:Rediscovering tubulin as an anticancer target[J]. Clin Cancer Res, 2009, 15 (12) :3903–3905 . |
| [74] | Pettit G R, Kamano Y, Fuji Y, et al. Marine animal biosynthetic constituents for cancer chemotherapy[J]. J Nat Prod, 1981, 44 (4) :482–485 . |
| [75] | Pettit G R, Kamano Y, Herald C L, et al. The isolation and structure of a remarkable marine animal antineoplastic constituent:dolastatin 10[J]. J Am Chem Soc, 1987, 109 (22) :6883–6885 . |
| [76] | Pettit G R, Kamano Y, Dufresne C, et al. Isolation and structure of the cytostatic linear depsipeptide dolastatin 15[J]. J Org Chem, 1989, 54 (26) :6005–6006 . |
| [77] | Luesch H, Moore R E, Paul V J, et al. Isolation of dolastatin 10 from the marine cyanobacterium Symploca species VP642 and total stereochemistry and biological evaluation of its analogue symplostatin 1[J]. J Nat Prod, 2001, 64 (7) :907–910 . |
| [78] | Pettit G R. The dolastatins[J]. Fortschr Chem Org Naturst, 1997, 70 (1) :1–79 . |
| [79] | Bai R, Pettit G R, Hamel E. Binding of dolstain 10 to tubulin at a distinct site for peptide antimitotic agents near the exchangeable nucleotide and vinca alkaloid sites[J]. J Biol Chem, 1990, 265 (28) :17141–17149 . |
| [80] | Katz J, Janik J E, Younes A. Brentuximab Vedotin (SGN-35)[J]. Clin Cancer Res, 2011, 17 (20) :6428–6436 . |
| [81] | Madden T, Tran H T, Beck D. Novel marine-derived anticancer agents:a phase I clinical, pharmacological, and pharmacodynamic study of dolastatin 10(NSC 376128) in patients with advanced solid tumors[J]. Clin Cancer Res, 2000, 6 (4) :1293–1301 . |
| [82] | Bai R, Verdier-Pinard P, Gangwar S, et al. Dolastatin 11, a marine depsipeptide, arrests cells at cytokinesis and induces hyperpolymerization of purified actin[J]. Mol Pharmacol, 2001, 59 (3) :462–469 . |
| [83] | De Carvalho S, Rand H J, Lewis A. Coupling of cyclic chemotherapeutic compounds to immune gammaglobulins[J]. Nature, 1994, 202 (4929) :255–258 . |
| [84] | Junutula J R, Junutula J R, Raab H, et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index[J]. Nat Biotechnol, 2008, 26 (8) :925–932 . |
| [85] | Ledford H. Toxic antibodies blitz tumours[J]. Nature, 2011, 476 (7361) :380–381 . |
| [86] | Bauer A, Bronstrup M. Industrial natural product chemistry for drug discovery and development[J]. Nat Prod Rep, 2013, 31 (1) :35–60 . |
| [87] | Crampton S L, Adams E G, Kuentzel S L, et al. Biochemical and cellular effects of didemnins A and B[J]. Cancer Res, 1984, 44 (5) :1796–1801 . |
| [88] | Rinehart K L, Cook Jr J C, Pandey R C. Biologically active peptides and their mass spectra[J]. Pure Appl Chem, 1982, 54 (12) :2409–2424 . |
| [89] | Rinehart K L. Didemnin and its biological properties[A]//Sewald N, Jakubke H D. Peptides, Chemistry and Biology[M]. Leiden:ESCOM, 1988. |
| [90] | Rinehart K L, Kishore V, Bible K C, Sakai R, et al. Didemnins and tunichlorin:Novel natural products from the marine tunicate trididemnum solidum[J]. J Nat Prod, 1988, 51 (1) :1–21 . |
| [91] | Sakai R, Stroh J G, Sullins D W, et al. Seven new didemnins from the marine tunicate trididemnum solidum[J]. J Am Chem Soc, 1995, 117 (13) :3734–3748 . |
| [92] | Rinehart K L, Gloer J B, Hughes R G. Didemnins:Antiviral and antitumor depsipeptides from a caribbean tunicate[J]. Science, 1981, 212 (4497) :933–935 . |
| [93] | Rinehart K L, Gloerjb J B, Carter C J. Structure of dedmnins, antiviral and cytotoxic depsipeptides from Caribbean tunicate[J]. J Am Chem Soc, 1981, 103 (7) :1857–1859 . |
| [94] | Jouin P, Poncet J, Dufour M N, et al. Antineoplastic activity of didemnin congeners:Nordidemnin and modified chain analogues[J]. J Med Chem, 1991, 34 (2) :486–491 . |
| [95] | Lobo C, García-Pozo S G, Castro I N, et al. Effect of dehydrodidemnin B on human colon carcinoma cell lines[J]. Anticancer Res, 1997, 17 (1A) :333–336 . |
| [96] | Simmons T, Andrianasolo E, McPhail K, et al. Marine natural products as anticancer drugs[J]. Mol Cancer Ther, 2005, 4 (2) :333–342 . |
| [97] | Ludwig M, Enzenhofer E, Schneider S, et al. Efficacy of a carrageenan nasal spray in patients with common cold:a randomized controlled trial[J]. Respir Res, 2013, 14 (1) :124–135 . |
| [98] | Eccles R, Meier C, Jawad M, et al. Efficacy and safety of an antiviral iota-carrageenan nasal spray:A randomized, double-blind, placebo-controlled exploratory study in volunteers with early symptoms of the common cold[J]. Respir Res, 2010, 11 (1) :108–118 . |
| [99] | Rupp H. Omacora® (prescription omega-3-acid ethyl esters 90):From severe rhythm disorders to hypertriglyceridemia[J]. Adv Ther, 2009, 26 (7) :675–690 . |
| [100] | Koski R R. Omega-3-acid ethyl esters (lovaza) for severe hypertriglyceridemia[J]. Pharm Ter, 2008, 33 (2) :271–303 . |
| [101] | Guesnet P, Alessandri A J M. Docosahexaenoic acid (DHA) and the developing central nervous system (CNS) implications for dietary recommendations[J]. Biochimie, 2011, 93 (1) :7–12 . |
| [102] | Burdge G C, Jones A E, Wootton S A. Eicosapentaenoic and docosapentaenoic acids are the principal products of α-linolenic acid metabolism in young men[J]. Br J Nutr, 2002, 88 (4) :355–363 . |
| [103] | Calon F, Giselle L. Docosahexaenoic acid protects from dendritic pathology in an Alzheimer's disease mouse model[J]. Neuron, 2004, 43 (5) :633–645 . |
| [104] | Look S A, Fenical W, Matsumoto G K, et al. The pseudopterosins:a new class of antiinflammatory and analgesic diterpene pentosides from the marine sea whip Pseudopterogorgia elisabethae (Octocorallia)[J]. J Org Chem, 1986, 51 (26) :5140–5145 . |
| [105] | Roussis V, Wu Z, Fenical W, et al. New anti-inflammatory pseudopterosins from the marine octocoral Pseudopterogorgia elisabethae[J]. J Org Chem, 1990, 55 (16) :4916–4922 . |
| [106] | Ata A, Kerr R G, Moya C E, et al. Identification of anti-inflammatory diterpenes from the marine gorgonian Pseudopterogorgia elisabethae[J]. Tetrahedron, 2003, 59 (5) :4215–4222 . |
| [107] | Coleman A C, Kerr R G. Radioactivity-guided isolation and characterization of the bicyclic pseudopterosin diterpene cyclase product from Pseudopterogorgia elisabethae[J]. Tetrahedron, 2000, 56 (49) :9569–9574 . |
| [108] | Hoarau C, Day D, Moya C, et al. iso-PsE, a new pseudopterosin[J]. Tetrahedron Lett, 2008, 49 (31) :4604–4606 . |
| [109] | Shin J, Fenical W. Fuscosides A-D:anti-inflammatory diterpenoid glycosides of new structural classes from the caribbean gorgonian Eunicea fusca[J]. J Org Chem, 1991, 56 (9) :3153–3158 . |
| [110] | Look S A, Fenical W, Jacobs R S, et al. The pseudopterosins:anti-inflammatory and analgesic natural products from the sea whip Pseudopterogorgia elisabethae[J]. Proc Natl Acad Sci USA, 1986, 83 (17) :6238–6240 . |
| [111] | Ettouati W, Jacobs R S. Effect of pseudopterosin A on cell division, cell cycle progression, DNA, and protein synthesis in cultured sea urchin embryos[J]. Mol Pharmacol, 1987, 31 (5) :500–505 . |
| [112] | Mayer M S A, Jacobson P B, Fenical W, et al. Pharmacological characterization of the pseudopterosins:novel anti-inflammatory natural products isolated form the Caribbean soft coral, Pseudopterogorgia elisabethae[J]. Pharm Lett, 1998, 62 (26) :401–407 . |
| [113] | Moya C E, Jacobs R S. Pseudopterosin A inhibits phagocytosis and alters intracellular calcium turnover in a pertussis toxin sensitive site in Tetrahymena thermophila[J]. Comp Biochem Physiol Part C Toxicol Pharmacol, 2006, 143 (4) :436–443 . |
| [114] | Haimes H, Glasson S, Harlan P, et al. Pseudopterosin A methyl ether (OAS 1000):a novel non-steroidal anti-inflammatory[J]. Inflamm Res, 1995, 44 (1) :13–17 . |
| [115] | Scherl D S, Afflitto J, Gaffar A. Influence of OAS-1000 on mediators of inflammation[J]. J Clin Periodontol, 1999, 26 (2) :246–251 . |
| [116] | Zasloff M, Adams A P, Beckerman B, et al. Squalamine as a broad-spectrum systemic antiviral agent with therapeutic potential[J]. PNAS, 2011, 108 (38) :15978–15983 . |
| [117] | Moore K S, Wehrli S, Roder H, et al. Squalamine:an aminosterol antibiotic from the shark[J]. Proc Nat Acad Sci USA, 1993, 90 (4) :1354–1358 . |
| [118] | Harrison C. Antiviral drugs:Dogfish shark chemical has broad-spectrum activity[J]. Nat Rev Drug Dis, 2011, 10 (11) :816–819 . |
| [119] | Ortholand J Y, Ganesan A. Natural products and combinatorial chemistry:Back to the future[J]. Curr Opin Chem Biol, 2004, 8 (3) :271–280 . |
| [120] | Beutler J A. Natural products as a foundation for drug discovery[J]. Curr Protoc Pharmacol, 2009 . |
| [121] | Radjasa O K, Vaske Y M, Navarro G, et al. Highlights of marine invertebrate-derived biosynthetic products:Their biomedical potential and possible production by microbial associants[J]. Bioorg Med Chem, 2011, 19 (22) :6658–6674 . |
| [122] | Glaser K B, Mayer A M S. A renaissance in marine pharmacology:From preclinical curiosity to clinical reality[J]. Biochem Pharmacol, 2009, 78 (5) :440–448 . |
| [123] | Koehn F E, Carter G T. The evolving role of natural products in drug discovery[J]. Nat Rev Drug Discov, 2005, 4 (2) :206–220 . |
| [124] | Gerwick W H, Moore B S. Lessons from the past and charting the future of marine natural products drug discovery and chemical biology[J]. Chem Biol, 2012, 19 (1) :85–98 . |
| [125] | Kijjoa A, Sawangwong P. Drugs and cosmetics from the sea[J]. Mar Drugs, 2004, 2 (1) :73–82 . |
| [126] | Olivera B M. Conus peptides:Biodiversity-based discovery and exogenomics[J]. J Biol Chem, 2006, 281 (42) :31173–31177 . |
| [127] | Aneiros A, Garateix A. Bioactive peptides from marine sources:pharmacological properties and isolation procedures[J]. J Chromatogr B, 2004, 803 (1) :41–53 . |
| [128] | Mayer A M, Glaser K B, Cuevas C, et al. The odyssey of marine pharmaceuticals:a current pipeline perspective[J]. Trends Pharmacol Sci, 2010, 31 (6) :255–265 . |
| [129] | Skropeta D, Wei L Q. Recent advances in deep-sea natural products[J]. Nat Prod Rep, 2014, 31 (8) :999–1025 . |
| [130] | Montaser R, Luesch H. Marine natural products:a new wave of drugs?[J]. Future Med Chem, 2011, 3 (12) :1475–1489 . |
| [131] | Gerwick W H, Moore B S. Lessons from the past and charting the future of marine natural products drug discovery and chemical biology[J]. Chem Biol, 2012, 19 (12) :85–98 . |
| [132] | Molinski T F, Dalisay D S, Lievens S L, et al. Drug development from marine natural products[J]. Nat Rev Drug Dis, 2009, 8 (1) :69–85 . |
| [133] | Kijjoa A, Sawangwong P. Drugs and cosmetics from the sea[J]. Mar Drugs, 2004, 2 (1) :73–82 . |
 2016, Vol. 47
2016, Vol. 47


