银屑病是一种常见的顽固型慢性皮肤病,由于其治愈率低、病程长、易于反复发作,严重影响患者身体健康和生活质量,是重点研究和防治的皮肤疾病之一。在天津医科大学总医院临床上多年用于 治疗银屑病并取得良好疗效的凉血化斑汤剂的基础上,利用现代提取制剂技术制成中药复方制剂——凉血化斑颗粒,在初步临床观察获得满意疗效的基础上[1],本研究采用小鼠阴道上皮细胞有丝分裂模型[2]及小鼠尾部鳞片表皮模型[3],初步探讨凉血化斑颗粒的药效及作用机制,并在此基础上进一步观察凉血化斑颗粒治疗银屑病的临床疗效,并对其与组方汤剂的治疗效果及预后情况进行比较分析,旨在确定凉血化斑颗粒治疗银屑病的确切临床疗效。
1 凉血化癍颗粒药理作用研究 1.1 药品与试剂凉血化斑颗粒(含绿原酸0.90 mg/g,天津医科大学总医院制剂,批准文号:津药制字Z20070798,每袋15 g,处方组成:金银花、水牛角、生石膏、白茅根、黄连、生地黄、丹皮、秦艽,批号20111210)。甲氨蝶呤片,上海信谊药厂有限公司生产(批号110308,2.5 mg/片),临用前研磨细用蒸馏水配制。己烯雌酚注射液,天津金耀氨基酸有限公司生产(批号0806021,0.5 mg/mL)。秋水仙碱片,吉林省通化市通化百信药业有限公司生产(批号100903,0.5 mg/片),临用前研磨细用蒸馏水配制。
1.2 动物昆明种小鼠,体质量18~22 g,雌性90只,雄性30只,购自中国人民解放军军事医学科学院卫生环境医学研究所实验动物中心,许可证号SCXK-(军)2009-003。
1.3 仪器光学显微镜Olmpus,倒置荧光显微镜Nikon Eclipse。
1.4 药物剂量设计凉血化斑颗粒人临床日用量为30 g,按60 kg体质量计算,用药量为0.5 g/kg;按动物与人比例折算,小鼠用药剂量为8.8、4.4、2.2 g/kg,中剂量相当于临床等效剂量。凉血化斑颗粒使用前用生理盐水配制。
阳性对照药物选用甲氨蝶呤片,甲氨蝶呤的临床用量为5~10 mg,每周1或2次,折合0.085~0.170 mg/kg,若人用量为10 mg,按体表面积换算,则小鼠的剂量1.5 mg/kg为临床等效剂量。本实验小鼠用量为1.5 mg/kg,给药1周后减量至1 mg/kg,隔日1次。
1.5 凉血化斑颗粒对小鼠阴道上皮细胞有丝分裂的影响参考相关文献方法[4, 5, 6],取体质量18~22 g健康昆明种雌性小鼠60只,按体质量随机分成对照组、模型组、阳性对照(甲氨蝶呤片)组和凉血化斑颗粒高、中、低剂量组。每隔2 d称1次体质量,以便调整剂量。除对照组外,其余各组小鼠于每日8׃00 ip己烯雌酚(0.2 mg/只),1次/d,连续3 d,使小鼠处于动情期;3 d后隔天ip己烯雌酚(0.2 mg/只),至实验第12天为止,对照组ip等量生理盐水。各组小鼠从第4天8׃00起开始给药,对照组与模型组分别ig等量生理盐水,阳性药物和不同剂量的凉血化斑颗粒组按剂量ig给予相应的药物,给药体积为0.15 mL/10 g,1次/d,连续8 d。第12天上午9׃00各组小鼠均ip秋水仙碱2 mg/kg,使细胞有丝分裂周期停滞于有丝分裂中期,便于计数。6 h后脱颈椎处死小鼠,取小鼠阴道组织用10%甲醛溶液固定,逐级脱水,石蜡包埋,切片(制片由天津医科大学组织学教研室完成),HE染色,在光镜下(×200)观察100个小鼠阴道上皮细胞的有丝分裂数,结果以有丝分裂指数(处于有丝分裂中期的细胞数/总细胞数)表示,比较各组小鼠阴道上皮细胞的有丝分裂指数,计算抑制率。
抑制率=(模型组有丝分裂指数-给药组有丝分裂指数)/模型组有丝分裂指数
1.6 凉血化斑颗粒对小鼠尾部鳞片表皮颗粒层形成的影响参考相关文献方法[4, 5, 6],取体质量18~22 g健康昆明种小鼠60只,雌雄各半,按体质量随机分成对照组、阳性对照(甲氨蝶呤片)组和凉血化斑颗粒高、中、低剂量组。对照组小鼠每天ig生理盐水,阳性药物和凉血化斑颗粒高、中、低剂量组分别ig 相应剂量的药物,给药体积为0.15 mL/10 g,1次/d,连续21 d。每隔2 d称1次体质量,以便调整剂量,甲氨蝶呤隔日给药。于第22天脱椎处死小鼠,在距尾根2 cm处取鼠尾表皮,在尽量避免损伤的情况下,切开皮肤,剥离软骨,取一长方形皮片贴附在滤纸上,立即投入10%甲醛溶液固定,逐级脱水,石蜡包埋,切片(制片由天津医科大学组织学教研室完成),HE染色,在光镜下(×400)观察每个小鼠的尾部皮肤角化层、颗粒层、棘细胞层、基底细胞层、真皮层和毛囊等变化。凡鳞片表皮有连续成行的颗粒细胞者,称为有颗粒层形成的鳞片,颗粒细胞为表皮中扁平或菱形细胞所组成,胞浆内充满粗大深嗜碱性、HE染色呈深蓝色透明的角质细胞颗粒,计数鼠尾表皮连续100个鳞片中的有颗粒层形成数(凡2个毛囊口之间的鳞片表皮有排列成行的颗粒层者计为有颗粒层形成的鳞片)[7]。
促进率=(给药组鳞片数-对照组鳞片数)/对照组鳞片数
1.7 统计学方法采用SPSS 19.0统计软件对数据进行分析,计量资料以x±s表示,采用t检验;计数资料以率表示,采用χ2检验。
1.8 结果 1.8.1 对小鼠动情期阴道上皮细胞有丝分裂的影响模型组与对照组比较,小鼠阴道上皮细胞有丝分裂指数有升高趋势;甲氨蝶呤及凉血化斑颗粒高、中、低剂量组的小鼠阴道上皮细胞有丝分裂指数均低于模型组(P<0.05、0.01),表明凉血化斑颗粒具有抑制小鼠阴道上皮细胞有丝分裂的作用。结果见表 1和图 1。
| 表 1 凉血化斑颗粒对小鼠雌激素期阴道上皮细胞有丝分裂的影响 Table 1 Effect of Liangxue Huaban Granule on vaginal epithelium mitosis of mice with estrogen cycle |
 | 图 1 各组小鼠阴道上皮细胞有丝分裂情况Fig.1 Vaginal epithelium cell mitosis of mice in each group |
甲氨蝶呤及凉血化斑颗粒高、中剂量组的小鼠尾部鳞片中有颗粒层形成的鳞片数均显著多于对照组(P<0.05、0.01),表明凉血化斑颗粒高、中剂量可促进小鼠尾部鳞片颗粒层形成。结果见表 2及图 2。
| 表 2 凉血化斑颗粒对小鼠尾部鳞片表皮颗粒细胞形成的影响 Table 2 Effect of Liangxue Huaban Granule on formation of cuticular granular cells on tail caled epidemis of mice |
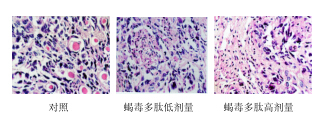 | 图 2 2 各组小鼠尾部鳞片表皮颗粒细胞形成情况Fig.2 Formation of cuticular granular cells on tail scaled epidemis of mice in each group |
100例患者均为本院中医科银屑病门诊患者,按随机数字表法分为两组。其中,治疗组50例,男29例、女21例,年龄14~62岁,平均(39.88±11.50)岁,病程1~35年,平均(5.92±4.76)年;对照组50例,男24例、女26例,年 龄23~68岁,平均(40.13±11.11)岁,病程6个月~25年,平均(5.90±4.38)年,两组性别、年龄、病程差异无显著性(P>0.05),具有可比性。本研究经伦理委员会批准,所有患者均签署知情同意书。
2.2 诊断标准参照《中药新药临床研究指导原则》(试行)制定西医诊断标准和中医征候诊断标准,中医辨证诊断应为属于血热证的患者。
2.3 纳入与排除标准 2.3.1 纳入标准符合“2.2”项诊断标准;年龄14~80岁,性别不限;病程3个月~40年。
2.3.2 排除标准妊娠或哺乳期妇女;对本药过敏或对药物成分过敏者;关节型、脓疱型、红皮病型银屑病;一个月内使用过糖皮质激素、免疫抑制剂、雷公藤、维甲酸类等药物者。
2.4 治疗方法治疗组:患者口服凉血化斑颗粒(天津医科大学总医院制剂),1次1袋(15 g),1日3次。对照组:患者口服凉血化斑组方汤剂,方剂组成:金银花、水牛角、生石膏、白茅根、黄连、生地黄、丹皮、秦艽。1日1剂,水煎(生药211 g,水煎得到200 mL汤剂),分早晚2次口服。两组观察期均为4个月,停药后随访6个月。
2.5 临床疗效判定参考《中药新药临床研究指导原则》标准[7]:根据皮损部位、范围及严重程度于治疗前、治疗2个月后、治疗4个月后分别进行PASI评分,以评价两组疗效。痊愈:皮损全部消退,留色素沉着或色素减退斑,临床症状基本消失,疗效指数≥95%;显效:皮损大部分消退,临床症状明显改善,疗效指数为60%~94%;好转:皮损部分消退,临床症状有所改善,疗效指数为30%~59%;无效:皮损消退不明显,临床症状未见改善,疗效指数<30%。
疗效指数=(治疗前PASI评分-治疗后PASI评分)/治疗前PASI评分
总有效率=(临床痊愈例数+显效例数+好转例数)/本组总病例数
2.6 统计学处理采用SPSS 19.0软件进行统计分析,实验结果以x±s表示,组间分析采用t检验。
2.7 结果 2.7.1 疗效比较治疗组总有疗效为88.00%,对照组总有效率为90.00%,见表 3。
| 表 3 治疗组和对照组疗效对比 Table 3 Comparison on effect between treatment and control groups |
两组治疗前PASI评分比较,差异不具有显著性(P>0.05),具有可比性。治疗2个月后两组PASI评分较治疗前均有所下降,且差异显著(P<0.01),但治疗2个月后两组间差异不具有显著性(P>0.05)。两组治疗4个月后,PASI评分较治疗前和治疗2个月后均有所下降,且差异显著(P<0.01),但治疗4个月后两组间差异不具有显著性(P>0.05)。见表 4。
| 表 4 两组治疗2和4个月后PASI评分比较 (x±s) Table 4 Comparison on PASI between two groups after two months and four months treatment (x±s) |
治疗2个月后,治疗组疗效指数为(34.77±18.24)%,对照组为(33.80±15.60)%,两组疗效指数无显著性差异(P>0.05);治疗4个月后,治疗组疗效指数为(65.45±25.45)%,对照组为(64.85±23.69)%,两组疗效指数无显著性差异(P>0.05)。
2.7.4 预后情况在治疗4个月并停药后,进行了为期6个月的随访观察。在此期间,治疗组有1例痊愈病例复发,在继续用药后病情好转。对照组有2例显效患者病情有所恶化,在继续服用汤剂治疗后病情好转,所有患者在用药观察期及随访期均未发现不良反应。
3 讨论 3.1 药理学研究银屑病是一种常见的,炎性和增生性皮肤疾病,是在遗传缺陷与环境因素(如上呼吸道感染、精神创伤、外伤等)的共同作用下使人体的生化、免疫、神经系统功能失调,调节细胞增生与分化的多种细胞因子表达异常而引起表皮细胞过度增生、角化不全,真皮中毛细血管扩张和增生,临床表现为丘疹和红斑,表面覆盖多层银白色鳞屑[8, 9, 10],直到20世纪70年代,银屑病才被认为是一种无序的角质细胞增殖和分化的疾病,这是基于对临床和表皮细胞增生组织的观察得出的[9]。
迄今为止尽管不断有新的银屑病模型问世,但小鼠阴道上皮细胞有丝分裂模型及小鼠尾部鳞片表皮模型仍是常用的评价药物疗效的实验动物模型[11]。小鼠阴道上皮细胞有丝分裂模型也存在着一定的局限性。由于本实验中小鼠例数相对较少,可能会造成模型组与对照组在数据上没有显著性差异,但从小鼠阴道上皮细胞的有丝分裂的直观形态上还是有显著不同的。同时,通过对药物的观察,其作用无论是从形态学上还是数据分析上都是作用显著的。银屑病表皮的病理生理主要特点包括增生过快和角化不全两个方面[9],雌激素周期中小鼠阴道上皮增生活跃,有丝分裂增多、细胞转换加快,能模拟银屑病表皮增生过快的特点;小鼠尾部鳞片表皮因表皮正常角化缺乏颗粒层形成的过程,故可模拟银屑病分化障碍、角化不全的特点。在发病机制尚未探明,可能涉及多个环节、细胞及因子的情况下,药物如能抑制小鼠阴道上皮有丝分裂和促进鼠尾颗粒层形成,则可能具有抗银屑病作用,这种筛选抗银屑病药物的方法一直为国内外普遍采用[11, 12]。因此,本实验选取小鼠阴道上皮细胞有丝分裂模型及小鼠尾部鳞片表皮模型。甲氨蝶呤具有抑制自身免疫、抑制细胞增殖、促进细胞分化、抗炎等作用,临床上用作治疗银屑病,在本实验中作为阳性对照药。通过观察凉血化斑颗粒对小鼠阴道上皮细胞有丝分裂模型的影响,发现凉血化斑颗粒高剂量组与甲氨蝶呤组抑制小鼠阴道上皮细胞有丝分裂效果相当;表明凉血化斑颗粒对小鼠阴道上皮细胞有丝分裂有抑制作用且有明显的量效关系;提示凉血化斑颗粒对银屑病表皮的增生过快有较强的抑制作用。通过观察凉血化斑颗粒对小鼠尾部鳞片表皮模型的影响,发现凉血化斑颗粒高、中剂量组能够促进小鼠尾部鳞片颗粒层形成,但由于对照组正常值较大,低剂量组得出的增加值无意义,结论有待于进一步深入探究,实验结果初步提示凉血化斑颗粒可以改善银屑病表皮的角化不全。
实验中还观测了各组小鼠体质量的变化,甲氨蝶呤组与凉血化斑颗粒高、中、低3个剂量组及对照组比较,小鼠体质量明显减轻,提示甲氨蝶呤具有较强的毒副作用。在小鼠尾部表皮颗粒细胞形成实验中,由于给药周期较长,给药1周后,甲氨蝶呤组出现了明显的不良反应,主要表现为小鼠体质量增速减缓或降低,且体质量均低于其他各组,小鼠进食量在前1周内持续下降,并且部分小鼠粪便中带脓血,显现出甲氨蝶呤的胃肠道毒性。甲氨蝶呤的给药剂量是按照临床用量折算,符合动物学实验的原则,不在毒理实验范围内。提示临床应谨慎运用免疫抑制剂治疗银屑病及其他疾病,应注意给药剂量,密切观测实验室检测指标。
本研究初步证明凉血化斑颗粒能在一定程度上改善银屑病动物模型的过度增殖和角化不全等病理特征,且凉血化斑颗粒治疗比甲氨蝶呤更安全。
3.2 临床研究根据天津医科大学总医院多年临床治疗皮肤病的中药经验汤剂处方,采用现代化提取制剂技术制成了凉血化斑颗粒,经多年临床应用,观察到此药具有清热解毒、凉血化斑之功效,在临床皮肤病治疗中取得满意疗效[1]。同时,建立了HPLC对其主要成分绿原酸定量检测方法,并作为其质量控制标准,保证了凉血化斑颗粒的成分均一、质量稳定[13]。
本研究以凉血化斑组方汤剂作为对照,观察凉血化斑颗粒治疗银屑病的临床疗效。研究结果表明,凉血化斑颗粒对治疗银屑病具有一定的临床疗效,与凉血化斑组方汤剂比较,在降低PASI评分及疗效指数方面,两组不存在显著性差异。而在服用方法上,颗粒剂则具有更易于携带、服用简便、质量稳定、保存时间长等优点,在一定程度上提高了患者的依从性,更适用于银屑病患者的长期用药。
综上所述,通过药理学动物模型研究及临床观察,均证实凉血化斑颗粒对银屑病具有良好的治疗效果,且更适用于临床应用,具有广阔的市场前景。但凉血化斑颗粒是否对小鼠T淋巴细胞增殖反应具有影响等问题,还需更深入的探讨,以进一步明确凉血化斑颗粒治疗银屑病的作用机制及特点。
| [1] | 康景华, 李正翔, 刘宏祥. 凉血化斑颗粒治疗常见皮肤病500例临床观察 [J]. 中草药, 2007, 38(4): 586-587. |
| [2] | 黄 畋, 林熙然. 石蒜碱对表皮角化及细胞有丝分裂的影响 [J]. 中华皮肤科杂志, 1985, 18(1): 37-39. |
| [3] | 苏秀玲, 韩 锐, 王秀荣. 维胺酸等维甲类衍生物对小鼠银屑病模型的实验治疗 [J]. 中华皮肤科杂志, 1989, 22(6): 400-402. |
| [4] | 邱翔燕, 李洪梅, 李小芹, 等. 银屑平颗粒治疗银屑病的实验研究 [J]. 中药药理与临床, 2009, 25(6): 80-81. |
| [5] | 谭梦晖, 金若敏, 庞惠芳, 等. 复方银屑颗粒治疗小鼠银屑病模型的实验研究 [J]. 上海中医药大学学报, 2008, 22(2): 48-49. |
| [6] | 王学军, 王伟明, 李继昌, 等. 消屑灵软膏对实验性银屑病病理模型影响的实验研究 [J]. 中国中医药科技, 2005, 12(2): 83-85. |
| [7] | 中药新药临床研究指导原则 (试行) [S]. 2002. |
| [8] | 刘瓦利, 何 伟. 银屑病的病因与发病机制 [J]. 中国临床医生, 2009, 37(8): 7-8. |
| [9] | Mabuchi T, Chang T W, Quinter S, et al. Chemokine receptors in the pathogenesis and therapy of psoriasis [J]. J Dermatol Sci, 2012, 65(1): 4-11. |
| [10] | Clark R A, Kupper T S. Misbehaving macrophages in the pathogenesis of psoriasis [J]. J Clin Invest, 2006, 116(8): 2085-2085. |
| [11] | 白彦萍, 王煜明, 杨顶权, 等. 中药祛银颗粒治疗银屑病的机制研究 [J]. 中华中医药杂志, 2007, 22(3): 184-186. |
| [12] | 周 萌, 王建辉. 中医药对银屑病动物模型的实验研究 [J]. 辽宁中医杂志, 2008, 35(2): 316-317. |
| [13] | 任 荣, 李正翔, 李 彬, 等. HPLC法测定凉血化斑颗粒剂中绿原酸的含量 [J]. 中国医院用药评价与分析, 2007, 7(6): 441-443. |
 2015, Vol. 46
2015, Vol. 46

