2. 江苏大学药学院, 江苏 镇江 212013
2. College of Pharmacy, Jiangsu University, Zhenjiang 212013, China
糖尿病属于中医消渴症范畴,消渴之名首见于《黄帝内经》,并有“苦渴数饮”“热中善饥”“善食而瘦”等症状描述。其病因在于“五脏皆柔弱者,善病消瘅”的体质因素和“此肥美之所发也,此人必数食甘美而多肥也。肥者令人内热,甘者令人中满,故其气上逆,转为消渴”的饮食因素以及“怒则气上逆,胸中蓄积,血气逆流,转而为热,热则消肌肤,故为消瘅”的情志因素等共同作用的结果。
现代医学认为糖尿病是一种由于体内胰岛素分泌相对或绝对不足而引起的糖代谢紊乱为主要特征的内分泌代谢性疾病[1]。其特征表现为高血糖和糖尿,同时包括脂肪、蛋白质、水电解质的紊乱,常导致严重并发症,如眼及神经病变、冠心病、脑血管病变等。目前临床上以二甲双胍、磺脲类药物治疗糖尿病,虽有一定的疗效,但均存在疗效低、耐用性低、毒副反应较大等问题,无法从根本上驱除病因及防止并发症的发生。因此,研究开发既能调控血糖又能防治并发症发生的低毒副作用的药物,成为目前糖尿病药物开发的重要方向和热点。而中医药治疗成为糖尿病及其并发症防治的重要途径和手段。
桑叶Mori Folium为桑科(Moraceae)桑属Morus L. 植物桑Morus alba L. 的干燥叶。其性寒、味甘苦,具有疏散风热、清肺润燥、清肝明目的功效,是临床常用中药之一。自古以来,中医就用桑叶治疗消渴证,《本草纲目》记载:桑叶“汁煎代茗,能治消渴”。现代研究表明,桑叶中含有的以1-脱氧野尻霉素(1- deoxynojirimycin,1-DNJ)为代表的生物碱类成分具有显著的调节血糖的作用;桑叶黄酮类、多糖类成分具有一定的调节血糖及防治并发症发生的作用[2]。此外,桑叶中尚含有多种功能性成分,如植物甾醇类、微量元素、维生素、氨基酸等[3, 4]。药理活性评价表明,桑叶具有显著的降血糖、降血压、抗菌和抗病毒等多种生理活性[5, 6, 7],且具有作用温和、持久、毒副作用小等特点,其作用机制表现为多成分、多靶点、多途径、多效应的特色和优势。本文在前期研究基础上[8, 9, 10],通过对近年来国内外学者在糖尿病发病机制的认识、桑叶防治糖尿病的功效成分群及其作用机制等方面进行归纳与分析,以期为桑叶调控血糖及防治并发症的作用机制深入研究提供指引,为桑叶资源的开发利用提供依据和参考。
1 桑叶抗糖尿病的功效成分 1.1 生物碱类桑叶中多羟基生物碱类成分是抗糖尿病的主要活性成分之一。多羟基生物碱及其苷类化合物集中分布于桑属植物的亲水性较强部位,常与氨基酸、甜菜碱等其他化合物共存。根据化合物结构特点,又可分为多羟基哌啶类、多羟基吡咯烷类和多羟基降托品烷类[11]。由于其结构具有与糖类似的多羟基结构,C-2位被还原,故多被看成含氮糖类化合物,其中代表性成分为1-DNJ,尚存在其系列衍生物。目前已从桑叶中分离获得多种生物碱类化合物,如DNJ、N-甲基-1-DNJ(N-Me-DNJ)、2-氧-α-D-吡喃半乳糖苷-1-DNJ、荞麦碱(fagomine)、1,4-二脱氧- 1,4-亚胺基-D-阿拉伯糖醇、1,4-二脱氧-1,4-亚胺基- (2-氧-β-D-吡喃葡萄糖苷)-D-阿拉伯糖醇和1α,2β,3α,4β-四羟基-去甲莨菪烷(去甲莨菪碱)[12, 13, 14, 15]。
1.2 黄酮及其苷类黄酮类物质是桑叶中的另一主要活性成分之一,也是桑叶化学成分中研究最为深入、结构明确的一类化合物。目前已从桑叶中分离出多种黄酮类化合物,包括紫云英苷、槲皮素、芦丁、异槲皮苷、山柰酚等及其相关衍生物[16, 17, 18]。另外,Doi等[19]对桑叶的丁醇提取物进行分离,得到9种化合物,包括2种新的异戊烯黄烷和异戊烯黄烷的糖苷。杨燕等[20]采用硅胶、Sephadex LH-20、RP-C18等色谱方法从桑叶中分离纯化得到3个黄酮类化合物,经核磁共振谱、质谱等分析手段鉴定为去甲木菠萝黄酮(norartocarpetin)、桑皮酮C和6-香叶基芹菜素(6-geranylapigenin)。
1.3 多糖类桑叶多糖是近年来发现的又一类活性成分。路国兵等[21]从桑叶中分离纯化得到具有降血糖活性的均一多糖组分MLPII,并用高效液相色谱分析其主要由甘露糖、鼠李糖、葡萄糖、木糖和阿拉伯糖等5种单糖组成,其摩尔比为8.73∶1.04∶6.53∶2.13∶1.00。欧阳臻等[22]将桑叶经过一系列处理得到MP11、MP12、MP13多糖组分,经糖腈乙酰化处理后进行气相色谱分析得知,MP11由L-鼠李糖、阿拉伯糖、木糖、D-甘露糖、葡萄糖、半乳糖组成,其比例为21∶163∶3∶3∶1∶20;MP12由L-鼠李糖和葡萄糖组成,其比例为3∶1;MP13主要由L-鼠李糖组成。赵明等[23]从桑叶中分离纯化得到多糖PMP11、PMP12,前者主要由鼠李糖、半乳糖醛酸和葡萄糖醛酸组成,其摩尔比为2.27∶1.59∶1;后者由鼠李糖、阿拉伯糖、半乳糖和葡萄糖醛酸组成,其摩尔比为1∶1.56∶1.57∶1.08。
2 桑叶防治糖尿病及其并发症的作用机制 2.1 糖尿病发病机制的认识 2.1.1 传统医学对糖尿病发病机制的认识中医认为,糖尿病的产生系由先天禀赋不足、脏腑柔弱的体质因素,以及后天饮食失调、情志不遂、房劳过度等致病因素共同作用的结果。其是由肺、胃、肾三脏热灼阴亏、水谷转输失常所致的疾病。其基本病机是阴虚燥热、阴虚为本、燥热为标,二者互为因果,燥热甚则阴愈虚,阴愈虚则燥热愈甚[24]。消渴证的病因病机如图 1所示。
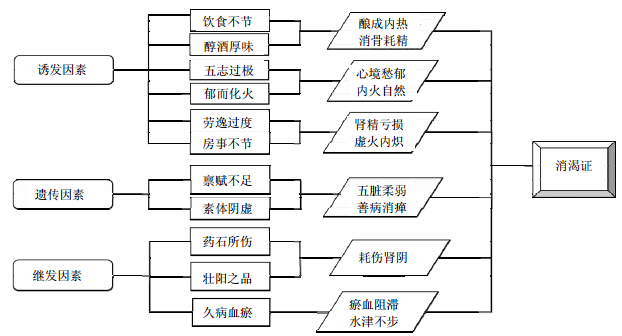 | 图 1 消渴证的病因病机Fig. 1 Pathogenic factor and mechanism of diabetes |
2型糖尿病是由多种因素联合作用而引发的,并非由单一病理生理机制所致。目前认为其发病机制主要是胰岛素抗性和胰岛β细胞功能受损所致,且胰岛β细胞功能受损是2型糖尿病发病的中心环节。造成胰岛β细胞功能受损的病理机制主要为脂毒性和糖毒性[25, 26]。脂毒性是进入胰岛β细胞的游离脂肪酸超过了其对脂肪酸氧化的能力,从而导致过多的脂质在细胞内堆积,从而诱导细胞的凋亡。糖毒性是血糖升高,增加细胞内的糖量,抑制β细胞的分泌,加重和诱发β细胞凋亡,引起高胰岛素血症,使胰岛素受体数及受体后反应过程下调,均可进一步加重胰岛素抵抗,形成恶性循环(图 2)。
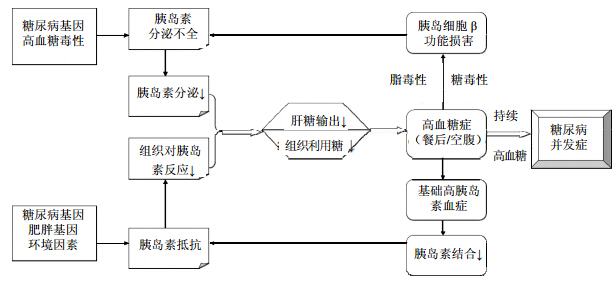 | 图 2 糖尿病的发病机制Fig. 2 Pathogenesis of diabetes |
α-葡萄糖苷酶抑制剂是以延缓肠道碳水化合物吸收而达到治疗糖尿病的,其作用机制为通过竞争性抑制位于小肠上的各种α-葡萄糖苷酶,使淀粉类降解为葡萄糖的速度减慢,从而减缓肠道对葡萄糖的吸收,达到降低餐后高血糖的作用[27]。研究表明,桑叶提取物中生物碱类、黄酮类、多糖类等多效应成分均具有一定的糖苷酶抑制活性,其中生物碱类成分活性最为显著[28, 29]。
1-DNJ是从桑叶、桑枝和桑根中分离获得的多羟基生物碱,是一种极性较大的糖类似物,为强效α-葡萄糖苷酶抑制剂,能够抑制人体内糖分的转化,降低空腹血糖,并能明显抑制餐后血糖急剧上升[30]。
日本学者宫原知江子[31]通过采用自然发病且症状类似成人糖尿病和糖尿病合并症的大鼠进行研究,结果发现1-DNJ能与小肠中麦芽糖酶、蔗糖酶和乳糖酶等α-糖苷酶结合,使二糖不能进一步分解为单糖而被吸收,从而明显地抑制了餐后血糖值急剧升高现象;并发现1-DNJ抑制二糖分解酶活性使血糖水平降低的机制为食物和1-DNJ同时被摄入消化道时,当食物到达小肠后被分解成二糖,由于α-糖苷酶与1-DNJ的亲和力大于α-糖苷酶与二糖的亲和力,因此1-DNJ与α-糖苷酶优先结合,从而阻碍了α-糖苷酶与二糖的结合,降低二糖的分解而直接进入大肠。可见,由于1-DNJ的作用使得进入血液的葡萄糖量降低,从而使血糖值降低[32]。Chen等[33]对含N-糖化合物对STZ诱导的糖尿病小鼠的降血糖机制的研究发现,N-Me-DNJ、GAL-DNJ和fagomine均可显著降低血糖水平,GAL-DNJ的降血糖作用机制与抑制α-糖苷酶的活性密切相关。
2.2.2 促进胰岛素释放陈福君等[34]从桑叶中提取桑叶多糖(TMP)给予四氧嘧啶致糖尿病模型小鼠,结果表明TMP具有明显的降血糖作用,且可提高糖尿病小鼠的耐糖量,增加肝糖原而降低葡萄糖量,以及升高正常大鼠血浆中胰岛素水平。TPM降血糖作用机制与促进胰岛β-细胞分泌胰岛素密切相关。路国兵等[35]探究桑叶多糖(MLPII)对糖尿病模型大鼠肝脏胰岛素抵抗的改善作用,结果表明,桑叶多糖(MLPII)可显著改善糖尿病模型大鼠肝脏糖脂代谢和胰岛素抵抗,其作用机制可能与调节胰岛素的释放和肝脏的氧化应激水平有关。尚有研究报道[36, 37],桑叶多糖可通过提高肝脏超氧化物歧化酶(SOD)活性、降低丙二醛(MDA)水平而提高糖尿病小鼠抗氧化能力,促进胰岛β-细胞修复,从而使胰岛素分泌增加;同时提高肝脏己糖激酶(HK)、肝脏丙酮酸激酶(PK)活性等综合作用,促使血糖进入肝细胞,使肝糖原合成增加,葡萄糖氧化分解加快,从而达到调节糖代谢、降低血糖、改善糖尿病症状的目的。
2.2.3 增强外周组织对葡萄糖的利用骨胳肌、脂肪组织、肝脏细胞是利用葡萄糖的主要外周组织,而胰岛素介导的葡萄糖摄取和利用在2型糖尿病人体内显著受损。研究表明,桑叶黄酮类成分可发挥拟胰岛素样作用,促进外周组织对葡萄糖的利用,降低血糖水平。宫司进之[38]制备了大花紫薇和桑叶提取物的混合物(1∶l),观察了对大鼠血糖值的影响。结果表明大花紫薇和桑叶提取物的混合物对四氧嘧啶致糖尿病模型大鼠的血糖升高具有抑制作用,混合物中的corosol酸和maron A对四氧嘧啶障碍具有细胞保护作用,以及维持某种程度的胰岛素分泌作用。这两种物质通过提高末梢组织的胰岛素利用能力以及促进糖转运而降低血糖水平。
2.2.4 促进胰岛β-细胞的修复李先佳等[39, 40]采用桑叶总黄酮给予链脲佐菌素诱导2型糖尿病模型大鼠,结果表明桑叶总黄酮具有对2型糖尿病大鼠胰岛β-细胞氧化损伤的保护作用,其作用机制与上调抗凋亡基因Bcl-2水平,下调促凋亡基因Bax表达有关,从而缓解胰岛β-细胞凋亡的发生,促进胰岛β细胞修复,保持胰岛β细胞及结构完整,减轻2型糖尿病大鼠胰岛素抵抗和氧化应激状态。且还通过降低胰岛素量,增加受体对胰岛素的敏感性,促进细胞对血糖的吸收并降低血糖,由此降低胰岛β细胞分泌胰岛素的负担,一定程度地保护了胰岛β细胞功能,阻止并发症的发生,从而达到调节糖代谢、降低血糖、改善糖尿病症状的作用。
2.2.5 抑制非酶蛋白糖基化作用糖尿病的慢性持续高血糖状态可导致血液中葡萄糖醛基或酮基与体内蛋白质分子中赖氨酸或羟赖氨酸的ε-氨基非酶结合,即进行非酶糖基化反应。糖基化早期葡萄糖与蛋白质结合,形成可逆的早期糖基化产物,进而发生重排、交联,最终形成不可逆的糖基化终末产物(AGEs)。AGEs过度产生和积累是器官老化和糖尿病慢性并发症发生、发展的重要病理基础。因此抑制蛋白非酶糖基化,对糖尿病及其并发症的防治具有十分重要意义。桑叶中黄酮化合物降血糖的机制与体外蛋白糖基化抑制作用相关,其可能通过清除自由基,增加SOD等抗氧化酶类活性,阻止蛋白糖基化等途径而发挥作用[41]。
2.2.6 调控相关的信号通路罗明琍[42]通过研究证实,氨基末端激酶(JNK)信号通路是参与糖尿病发病机制的重要通路。在糖尿病状态下胰岛β细胞中氧化应激能导致JNK激活,损害核内胰岛素信号通路,从而使胰岛素基因表达水平降低,破坏胰岛素合成。此外,JNK的激活可使胰岛素受体底物IRS-lser307位点磷酸化,导致胰岛素抵抗。而桑叶中的多糖和黄酮类成分对JNK信号通路中JNK、IRS-1、Akt-1、PDX-l mRNA基因的表达调控作用可能是桑叶降低血糖、保护和修复胰岛细胞功能的分子机制,其中通过调控IRS-1可以增加机体对胰岛素的敏感性;通过调控JNK、Akt-1、PDX-1可以增加机体对胰岛细胞胰岛素的合成功能,进而促进胰岛功能的发挥。
腺苷单磷酸活化蛋白激酶(AMPK)在调节机体能量代谢的平衡方面起总开关的作用。在肌肉和肝脏中,AMPK的活化增强了葡萄糖的摄取,调节肝葡萄糖的转化,增强骨骼肌对葡萄糖的摄取和脂肪组织中葡萄糖的利用,改善胰岛素抵抗,从而保证机体糖代谢的稳定[43]。MA等[44, 45]的研究表明,桑叶提取物激活了AMPK及其下游酶AS160的磷酸化,从而促使葡萄糖转运蛋白(GLUT4)的转位,促进骨骼肌组织对葡萄糖的吸收,稳定体内血糖水平。Tsuyoshi等[46]发现1-DNJ和meDNJ可以上调AMPK和脂联素的表达,激活β-氧化系统,改善糖尿病小鼠的胰岛素抵抗。因此,提示1-DNJ可激活AMPK磷酸化,促进GLUT4转位,从而改善胰岛素敏感性。
3 结语与讨论我国拥有丰富的桑叶资源,其防治消渴证的功效临床疗效确切、显著。现代研究表明,桑叶防治糖尿病及其并发症的多效应成分群主要包括:生物碱类、黄酮及其苷类、多糖类等;其经过多途径的作用机制而发挥整体综合作用(图 3),作用途径涉及以下几方面:(1)抑制α-糖苷酶活性;(2)促进胰岛素的分泌;(3)改善胰岛功能;(4)促进外周组织对葡萄糖的利用;(5)增强肝糖原的量。
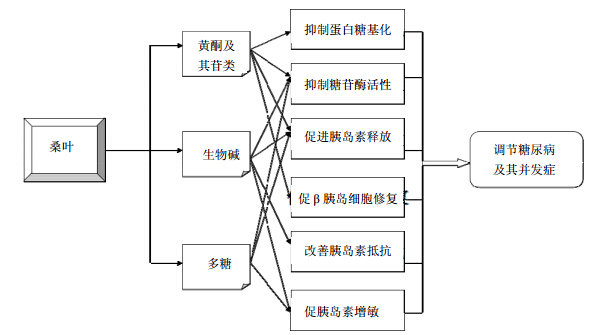 | 图 3 桑叶多效应成分对糖尿病及其并发症的整体调节Fig. 3 Whole regulation of components in Mori Folium with multiple function on diabetes and its complications |
目前,尽管对于糖尿病的研究较为深入,但由于该病证病因的复杂性,导致糖尿病的病理分子机制尚未完全阐明,有待于系统认识和揭示。而代谢组学是系统生物学研究领域中最为活跃的现代方法和技术,其通过研究疾病引起或服药后体内内源性代谢物的变化,直接反映出机体内生物化学过程和状态的变化,探索代谢指纹图谱变化的原因,进而阐明疾病及药物作用的靶点和过程,揭示疾病的发病机制及药物作用机制[47]。2型糖尿病的代谢组学研究不仅有助于人们更系统全面地了解2型糖尿病的发病机制,同时还可辅助临床上对2型糖尿病的诊断及为新药的研发提供作用靶点[48]。
桑叶具有良好的防治糖尿病及其并发症的药理作用,其作用机制是多成分、多途径、多靶标的综合调节作用。因此,运用建立在系统生物学与计算机技术高速发展的基础之上的网络药理学、代谢组学等方法技术,针对其多成分、多途径、多靶点协同作用的特点,利用生物分子网络、疾病、药物的整体关联来预测致病基因、药物靶标,揭示其药效物质基础及其作用机制,从而阐明桑叶多组分如何实现其整合效应及其相互作用的分子机制和整体效应。
| [1] | Hansen K B, Vilsboll T, Knop F K. Incretin mimetics: A novel therapeutic option for patients with type 2 diabetes-a review [J]. Diabetes Metab Syndr Obes: Targets Ther, 2010, 3: 155-163. |
| [2] | 程凤银, 叶盛英. 桑叶抗糖尿病研究概况 [J]. 药学实践杂志, 2005, 23(2): 71-74. |
| [3] | Imran M, Khan H, Shah M, et al. Chemical composition and antioxidant activity of certain Morus species [J]. J Zhejiang Univ Sci B: Biomed Biotechnol, 2010, 11(12): 973-980. |
| [4] | 宿树兰, 段金廒, 欧阳臻, 等. 我国桑属 (Morus L) 药用植物资源化学研究进展 [J]. 中国现代中药, 2012, 14(7): 1-6. |
| [5] | 马丽丽, 邹欣蓉, 刘 琼, 等. 桑树资源在预防和治疗2型糖尿病中的作用 [J]. 中草药, 2014, 45(22): 3337-3342. |
| [6] | 欧阳臻, 李永辉, 宿树兰, 等. 桑叶多糖的含量测定 [J]. 食品科学, 2003, 24(11): 118-120. |
| [7] | Zhang L L, Bai Y L, Shu S L, et al. Simultaneous quantitation of nucleosides, nucleobases, amino acids, and alkaloids in mulberry leaf by ultra high performance liquid chromatography with triple quadrupole tandem mass spectrometry [J]. J Sep Sci, 2014, 37(11): 1265-1275. |
| [8] | 原爱红, 黄 哲, 马 骏, 等. 桑叶黄酮的提取及其降糖作用的研究 [J]. 中草药, 2004, 35(11): 16-18. |
| [9] | 白永亮, 段金廒, 宿树兰, 等. 桑叶干燥过程中黄酮类和生物碱类成分动态变化分析 [J]. 中药材, 2014, 37(7): 1158-1163. |
| [10] | 张丽丽, 白永亮, 宿树兰, 等. 中国药典中桑叶含量测定项下色谱条件的优化 [J]. 药物分析杂志, 2014, 34(4): 717-722. |
| [11] | Asano N, Tomioka E, Kizu H, et al. Sugars with nitrogenin the ring isolated from the leaves of Morus bombycis [J]. Carbohydrate Res, 1994, 253: 235-245. |
| [12] | Asano N, Oseki K, Tomioka E, et al. N-containing sugars from Morus alba and their glucosidase inhibitory activities [J]. Carbohydr Res, 1994, 259(2): 243-255. |
| [13] | Asano N, Yamashita T, Yasuda K, et al. Polyhydroxylated alkaloids isolated from mulberry trees (Morus alba L.) and silkworms (Bombyx mori L.) [J]. J Agric Food Chem, 2001, 49(9): 4208-4213. |
| [14] | Nitra N, Kornkano K, Wiroje K, et al. Quantitative determination of 1-deoxynojirimycin in mulberry leaves using liquid chromatography-tandem mass spectrometry [J]. J Pharm Biomed Anal, 2007, 44(4): 853-858. |
| [15] | Tadashi Y, Huong D, Patcharee T, et al. Simple, selective, and rapid quantification of 1-deoxynojirimycin in mulberry leaf products by high-performance anion- exchange chromatography with pulsed amperometric detection [J]. J Food Sci, 2010, 75(3): 246-250. |
| [16] | 欧阳臻, 陈 钧. 桑叶的化学成分及其药理作用研究进展 [J]. 江苏大学学报, 2003, 24(6): 39-44. |
| [17] | 邱 进, 王晓静, 王元书, 等. 桑叶化学成分的研究 [J]. 中成药, 2008, 30(9): 1-2. |
| [18] | Dugo P, Donato P, Cacciola F, et al. Characterization of the polyphenolic fraction of Morus alba leaves extracts by HPLC coupled to a hybrid IT-TOF MS system [J]. J Sep Sci, 2009, 32(21): 3627-3634. |
| [19] | Doi K, Kojima T, Makino M, et al. Studies on the constituents of the leaves of Morus alba L. [J]. Chem Pharm Bull, 2001, 49(2): 151-153. |
| [20] | 杨 燕, 王洪庆, 陈若芸. 桑叶中的黄酮类化合物 [J]. 药学学报, 2010, 45(1): 77-81. |
| [21] | 路国兵, 任春久, 崔为正, 等. 桑叶多糖MLP II的基本结构及对糖尿病模型大鼠的降血糖作用 [J]. 蚕业科学, 2011, 37(6): 1053-1060. |
| [22] | 欧阳臻, 陈 钧, 李永辉. 桑叶多糖的分离纯化及组成研究 [J]. 食品科学, 2005, 26(3): 181-184. |
| [23] | 赵 明, 常 钰, 王佩香, 等. 桑叶多糖PMP12的分离纯化及结构初步分析 [J]. 江苏大学学报, 2010, 20(2): 153-156. |
| [24] | 朱琳琳. 中医药治疗糖尿病研究进展 [D]. 北京: 北京中医药大学, 2013. |
| [25] | 刘佩文, 余学锋. 从2型糖尿病的发病机制谈糖尿病治疗的新策略 [J]. 医学与哲学, 2008, 29(2): 10-13. |
| [26] | 孙 志, 马 丽, 邱玉芹, 等. 2型糖尿病发病机制及胰岛β细胞功能障碍的研究进展 [J]. 医学综述, 2008, 14(9): 1371-1373. |
| [27] | 刘新颖. 桑叶中α-葡萄糖苷酶抑制物质的提取方法及其提取物对糖尿病小鼠治疗作用的研究 [D]. 重庆: 西南交通大学, 2011. |
| [28] | 薛长勇, 刘英华, 张荣欣, 等. 桑叶黄酮对α-糖苷酶活性的影响 [J]. 中国组织工程研究与临床康复, 2007, 11(21): 4191-4193. |
| [29] | 原爱红, 马 骏, 蒋晓峰, 等. 桑叶中糖苷酶抑制活性组分的筛选 [J]. 中国中药杂志, 2006, 31(3): 223-227. |
| [30] | 魏晓蕊. 桑叶中1-脱氧野尻霉素的提取纯化及其降血糖活性的研究 [D]. 扬州: 扬州大学, 2012. |
| [31] | 宫原知江子. 桑叶对自发性糖尿病大鼠血糖的调控作用 [J]. 国外医学: 中医中药分册, 1999, 21(4): 53. |
| [32] | 饭冢幸澄. 桑叶对二糖酶的抑制作用 [J]. 国外医学: 中医药分册, 2006, 43(3): 54-61. |
| [33] | Chen F, Kimura M, Nakashima N, et al. Potentiating effects on pilocarpine-induced saliva secretion, by extracts and N-containing sugars derived from mulberry leaves, in streptozocin-diabetic mice [J]. Biol Pharm Bull, 1995, 18(12): 1676-80. |
| [34] | 陈福君, 卢 军, 张永煜. 桑的药理研究 (I)-桑叶降血糖有效组分对糖尿病动物糖代谢的影响 [J]. 沈阳药科大学学报, 1996, 13(1): 24-27. |
| [35] | 路国兵, 任春久, 崔为正, 等. 桑叶多糖MLP II对糖尿病模型大鼠肝脏胰岛素抵抗的改善作用 [J]. 蚕业科学, 2012, 38(1): 116-121. |
| [36] | 陈玲玲, 刘 炜, 陈 建, 等. 桑叶黄酮对糖尿病小鼠调节血糖的作用机制研究 [J]. 中国临床药理学杂志, 2010, 26(11): 835-838. |
| [37] | 陈建国, 步文磊, 来伟旗, 等. 桑叶多糖降血糖作用及其机制研究 [J]. 中草药, 2011, 42(3): 515-520. |
| [38] | 宫司进之. 大花紫薇和桑叶提取物对大鼠血糖值的影响 [J]. 国外医学: 中医中药分册, 2000, 22(4): 232. |
| [39] | 李先佳, 任丽平, 于海英, 等. 桑叶总黄酮对2型糖尿病大鼠胰岛β细胞氧化损伤的影响 [J]. 医药导报, 2013, 32(6): 701-704. |
| [40] | 穆晓燕, 李先佳. 桑叶总黄酮对2型糖尿病大鼠胰岛β细胞的影响 [J]. 中国实验方剂学杂志, 2013, 19(11): 213-216. |
| [41] | 俞灵莺. 桑叶总黄酮对糖尿病大鼠降血糖效应的研究 [D]. 杭州: 浙江大学, 2005. |
| [42] | 罗明琍. 桑叶有效部位降血糖作用与JNK信号通路的关系 [D]. 广州: 广州中医药大学, 2013. |
| [43] | 方 飞. 桑叶有效部位改善HepG2胰岛素抵抗及其机制的研究 [D]. 广州: 华南理工大学, 2012. |
| [44] | Ma X, Iwanaka N, Masuda S, et al. Morus alba leaf extract stimulates 5'-AMP-activated protein kinase in isolated rat skeletal muscle [J]. J Ethnopharmacol, 2009, 45(2): 54-59. |
| [45] | Ma X, Egawa T, Kimura H, et al. Berberine-induced activation of 5'-adenosine monophosphate- activated- protein kinase and glucose transport in rat skeletal muscles [J]. Metabolism, 2010, 59(11): 1619-1627. |
| [46] | Tsuyoshi T, Yumiko N, Taro H, et al. Intake of 1-deoxynojirimycin suppresses lipid accumulation through activation of the beta-oxidation system in rat liver [J]. J Agric Food Chem, 2009, 57(22): 11024-11029. |
| [47] | 黄晓晨, 宿树兰, 段金廒, 等. 代谢组学在中医药若干科学问题研究中的应用与思考 [J]. 中草药, 2014, 45(2): 147-153. |
| [48] | 王广基, 郝海平, 阿基业, 等. 代谢组学在中药方剂整体药效作用及机制研究中的应用与展望 [J]. 中国天然药物, 2009, 7(2): 82-89. |
 2015, Vol. 46
2015, Vol. 46


