2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222000
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222000, China
金银花Lonicerae Flos为忍冬科植物忍冬Lonicera japonica Thunb. 的干燥花蕾或初开的花,是我国常用中药,具有清热解毒、凉散风热之功效、常用于热血毒痢、风热感冒、痈肿疔疮、瘟病发热等疾病[1]。金银花中含有大量的有机酸类化合物,主要药理活性有抗菌作用、抗炎、抑制血小板聚集、抗血栓、抗氧化作用等[2, 3]。
异绿原酸A、B和C是二咖啡酰奎宁酸类化合物,是金银花中的有效活性成分,是一类由奎宁酸与数目不等的咖啡酸通过酯化反应缩合而成的有机酸类天然成分,广泛存在于植物界中[4]。近20年来国内外学者就二咖啡酰奎宁酸类的植物化学和药理进行了深入研究,发现其具有一些重要生物活性,极具临床应用价值。主要的药理活性有抗氧化、抑制氧酶、抗动脉粥样硬化、抗动脉粥样硬化、抗血小板活性物质、调血脂、抗炎、抗病毒、抑制组胺释放、抗纤维化、抑制平滑肌收缩等作用[4]。研究发现异绿原酸A和异绿原酸C可以抑制白细胞迁移和炎症过程超氧阴离子的产生,具有良好的体外抗炎作用。Kimura等[5]发现异绿原酸A、B、C抑制人外周血多形核白细胞中钙离子A23187诱导的白三烯B4产生,并且异绿原酸B能促进前列腺素E2的形成,呈现较好的抗炎活性;Iwai等[6]对绿咖啡豆中的7个咖啡酰奎宁酸类化合物抗氧化活性测试结果显示异绿原酸C的活性最好。另外研究发现异绿原酸A不仅抑制HIV-1整合酶,并且能抑制HIV-1在组织中的复制,选择治疗指数大于100[7]。Oh等[8]研究表明异绿原酸A和异绿原酸C对血管紧张素转换酶的抑制活性分别为596、534 μmol/L,提示咖啡酰奎宁酸类化合物可能是降压的有效成分。周志娥等[9]在对大肠杆菌的抑菌机制实验中发现绿原酸类物质在较短时间内破坏大肠杆菌细胞壁、细胞膜的结构,增加细胞的通透性,致使细胞电解质、酶及DNA、RNA外泄,1-N-苯萘胺(NPN)渗透进入细胞壁,从而影响细胞结构的稳定性,使细胞死亡,而异绿原酸A在抑菌效果及对细胞壁、细胞膜的作用程度都强于绿原酸。
异绿原酸A、B和C互为同分异构体,药理活性较好,但是制备高纯度单体的难度较大,这就制约了其药理药效的深入研究,故需要一种快速、简便、高效的制备方法对其进行分离纯化。中低压制备色谱技术即闪式制备色谱技术,其最大特点是分离速度快,可制备毫克级至百克级的样品。可使用正相填料和反相填料,具有比常压柱色谱分辨率高,分离速度快的特点;具有比高效制备液相制备量大、时间短、工作效率高、节约生产成本的优点。随着天然产物分离纯化技术的发展,中低压制备色谱技术越来越受到广泛的应用[10]。
本实验采用大孔树脂对金银花70%乙醇提取物进行初步分离并富集,利用中低压制备色谱技术从中分离制备出高质量分数的咖啡酰奎宁酸类化合物,经ESI-MS、13C-NMR和1H-NMR对其进行结构鉴定。本方法实现了经济、快速、有效分离异绿原酸A、B和C的目的,为金银花的进一步开发应用提供了参考数据。
1 仪器与材料Agilent 1260高效液相色谱仪,美国Agilent公司,配自动进样器、四元泵、MWD检测器;Reveleris中低压制备色谱仪,美国GRACE公司,配四元泵、UV、ELSD检测器;Bruker AV-400型核磁共振光谱仪,瑞士Bruker公司;Agilent 1290-6538液质联用仪,美国Agilent公司;AE240电子分析天平,瑞士Mettler公司。
金银花药材于2013年11月购自安徽亳州药材市场(产地:山东),经南京中医药大学吴启南教授鉴定为忍冬科植物忍冬Lonicera japonica Thunb. 的干燥花;异绿原酸A(批号A0025,质量分数>98%)、异绿原酸B(批号071130,质量分数>98%)、异绿原酸C(批号MUST-09041001,质量分数>98%)对照品购自成都曼斯特生物科技有限公司;HP20型大孔树脂,河北沧州宝恩吸附材料科技有限公司;HPD-200A型大孔吸附树脂,郑州勤实科技有限公司;D-101、HP100型大孔吸附树脂,天津海光化工有限公司;YMC-C18,粒径50 μm,日本YMC公司;甲醇、乙腈,色谱纯,瑞典Oceanpak公司;甲酸,分析纯,南京化学试剂有限公司;95%乙醇,食用级,连云港长和酒业有限公司;双蒸水,自制。
2 方法与结果 2.1 异绿原酸A、B、C定量测定 2.1.1 混合对照品溶液制备[11]异绿原酸A、B和C在药材中的质量分数分别为0.32%、0.17%、0.63%,故取异绿原酸A、B和C对照品各4.80、2.56、9.45 mg,置于20 mL量瓶中,加入甲醇溶解并稀释至刻度,摇匀,配制成质量浓度分别为240.00、128.00、472.50 µg/mL的混合对照溶液。
2.1.2 供试品溶液制备[11]称取“2.3.3”项下异绿原酸粗品20.00 mg置于20 mL量瓶中,加入甲醇溶解并稀释至刻度,摇匀,配制成供试品溶液。
2.1.3 检测波长选择取“2.1.1”项下对照品溶液在紫外分光光度计190~600 nm进行全波长扫描,结果显示在240、280、326 nm处均有较大吸收;取“2.1.2”项下供试品溶液在紫外分光光度计190~600 nm进行全波长扫描,以对照品扫描图作为对照,结果显示供试品与对照品的图谱基本一致,而两者都在326 nm处的吸光度值最大,与文献中检测异绿原酸所选波长基本一致[12],故以326 nm作为对照品检测和分离的波长。
2.1.4 色谱条件色谱柱为Acuity C18(250 mm×4.6 mm,5 μm),流动相乙腈-0.5%甲酸水溶液,体积流量1.0 mL/min。梯度洗脱条件:0~30 min,25%~60%乙腈;30~45 min,60%~100%乙腈;进样体积10 μL,柱温30 ℃,检测波长326 nm。
2.2 提取工艺取金银花10.0 kg,用10倍量70%乙醇回流提取2 h,滤渣加8倍量70%乙醇回流提取1 h,合并提取液,滤过,滤液减压浓缩至相对密度1.05(25 ℃)。搅拌加入乙醇至体积分数为80%,静置过夜(12 h),滤过,滤液减压浓缩至无醇味,加水稀释至1∶1,静置过夜(12 h),滤过,弃去不溶物,即得金银花提取液,备用。异绿原酸A、B和C的转移率为92.6%。
2.3 纯化工艺 2.3.1 树脂型号筛选[13]由于“2.2”项下制备的滤液含大量极性杂质成分,需要用树脂工艺纯化。考察D-101、HPD200A、HP100、HP-20 4种经预处理的大孔树脂对样品中异绿原酸A、B和C的吸附、解吸附效果。平行取“2.2”项下金银花提取液4份,每份100 mL,分别加入到已处理好的含40 g D-101、HPD200A、HP100、HP-20大孔吸附树脂中(径高比为1∶8),吸附,水洗,水液减压浓缩,甲醇定容至100 mL;适量60%乙醇洗脱,合并洗脱液,浓缩至无醇味,甲醇定容至100 mL。
取上样液和洗脱液,分别采用“2.1”项方法测定,计算比吸附量、比洗脱量和解吸率,见表 1。结果表明D-101为最佳应用树脂。
| 表 1 不同树脂的考察 Table 1 Investigation of different macroporous resins |
比吸附量=(上样液质量浓度×上样液体积-过柱液质量浓度×过柱液体积-水洗液质量浓度×水洗液体积)/树脂质量
比洗脱量=乙醇洗脱液的质量浓度×乙醇洗脱液体积/树脂质量
解吸率=洗脱量/吸附量
2.3.2 洗脱剂的选择按照优选的D-101树脂平行取5份,进行样品吸附后,先用水洗至无色后,分别用15%、25%、30%、45%、60%乙醇溶液进行洗脱,HPLC跟踪检测,计算洗脱率,结果分别为0、48.1%、88.5%、98.8%、98.8%。流出液减压浓缩并干燥,测定异绿原酸A、B和C的总量,结果分别为0、5.4%、8.2%、23.6%、2.6%。可知,15%乙醇洗脱未见目标产物(主要为绿原酸);25%、30%乙醇洗脱液有部分洗脱下来,但是洗脱不完全;60%乙醇洗脱可将异绿原酸A、B和C几乎完全洗脱下来,但同时洗脱下的杂质也增多,综合成本考虑,确定采用45%乙醇洗脱异绿原酸A、B和C,洗脱体积与树脂质量比为4∶1。
2.3.3 树脂柱色谱(1)树脂预处理:选用D-101型大孔树脂用5%氢氧化钠溶液4 BV浸泡24 h,加4 BV水洗至中性,加5%盐酸溶液4 BV浸泡6 h,水洗至中性,加95%乙醇浸泡12 h后洗脱,至流出乙醇液与水混合不产生白色浑浊为止,用足量水洗至无醇味,备用。
(2)吸附洗脱:取预处理好的D-101型大孔树脂柱(600 mm×80 mm),精密量取“2.2”项下的提取液上柱,吸附完成后先用水洗除去黏液质等杂质,再用15%乙醇洗脱4 BV,最后用45%乙醇洗脱4 BV,收集45%乙醇洗脱液,减压浓缩,真空干燥,研碎,得异绿原酸粗品165 g(异绿原酸A、B和C的质量分数分别为15.7%、8.3%、30.9%),备用。
2.4 中低压制备色谱条件的优化 2.4.1 柱填料的选择选择反相硅胶(YMC-C18,50 μm)和硅胶为填料进行色谱分离,结果表明利用反相硅胶可避免正相硅胶死吸附大、样品损失多的问题,且预试验证明,采用反相硅胶为填料,异绿原酸的分离度较好,故选择YMC-C18为分离填料。
2.4.2 洗脱剂的选择分别以甲醇-水、甲醇-0.5%甲酸水溶液、乙腈-水、乙腈-0.5%甲酸水溶液系统及相同系统下不同配比为洗脱剂进行分离,最终确定以乙腈-0.5%甲酸水溶液(32∶68)为洗脱系统,此系统条件各色谱峰分离度较好,能使异绿原酸A、B和C得到有效分离,故选择乙腈-0.5%甲酸水溶液系统为洗脱剂。
2.4.3 体积流量选择分别以10、20、30 mL/min的体积流量进行洗脱,发现以10 mL/min洗脱时样品保留时间较长,而以30 mL/min洗脱时的保留时间和20 mL/min的保留时间相差不大,综合试剂成本和分离效率考虑,选择20 mL/min进行洗脱。
2.5 异绿原酸A、B和C的制备将乙腈溶液作为A相,0.5%甲酸水溶液为B相,将2个灌注管路分别放入A相和B相中,然后进入洗脱程序表按照优选的溶剂体系比例进行设定(A相32%,B相68%),时间30 min,体积流量20 mL/min,再进入紫外检测器的选择系统,设定波长为326 nm。将自制C18填料色谱柱(400 mm×80 mm,50 μm)安装好,取“2.3.3”项下异绿原酸粗品30.0 g,用适量甲醇溶解,分次进样,按上述条件洗脱,并收集保留时间为10.8~12.5、14.2~16.8和18.5~22.0 min的组分,减压浓缩收集液,冷冻干燥,并计算收率(收率=制备得到的目标成分量/粗品中目标成分量)得异绿原酸A(峰2)白色粉末4.08 g(收率为86.6%)、异绿原酸B(峰1)白色粉末2.03 g(收率为81.5%)和异绿原酸C(峰3)白色粉末8.17 g(收率为88.1%)。色谱图见图 1。
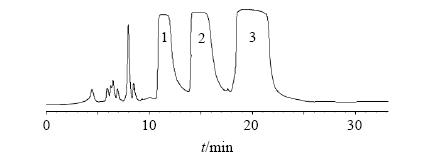 | 图 1 异绿原酸A、B和C的制备HPLC图Fig. 1 Pre-HPLC ofisochlorogenic acids A,B,and C |
利用HPLC法测定自制异绿原酸A、B和C的质量分数。按“2.1”项下色谱方法测定,用面积归一化法计算,确定异绿原酸A、B和C的质量分数分别为98.7%、99.2%和97.6%。
异绿原酸A、B和C(互为同分异构体)样品经ESI-MS分析,m/z: 515.123 9 [M-H]-,计算相对分子质量均为516,峰a、b、c分别为异绿原酸A、B和C。色谱图见图 2。
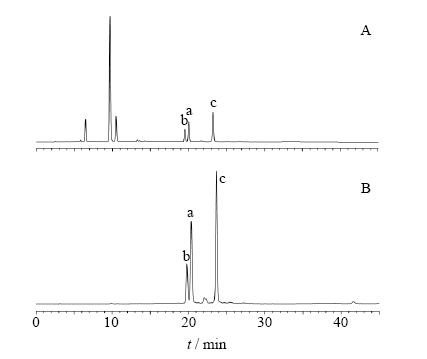 | a-异绿原酸A b-异绿原酸B c-异绿原酸Ca-isochlorogenic acid A b-isochlorogenic acid B c-isochlorogenicacid C图 2 金银花提取液 (A) 和45%乙醇洗脱部位 (B) 的HPLC图Fig. 2 HPLC of extracts from Lonicera Flos (A) and 45% ethanol elution (B) |
白色粉末(甲醇),ESI-MS m/z: 515 [M-H]-。1H-NMR (400 MHz,CD3OD) δ: 2.13~2.34 (4H,m,H-2,6),3.98 (1H,dd,J = 3.4,7.6 Hz,H-4),5.39 (1H,ddd,J = 4.5,8.2,10.8 Hz,H-5),5.43 (1H,m,H-3),6.26 (1H,d,J = 16.0 Hz,H-8′),6.33 (1H,d,J = 16.0 Hz,H-8″),6.77 (1H,d,J = 8.2 Hz,H-5′),6.78 (1H,d,J = 8.2 Hz,H-5″),6.96 (1H,dd,J =2.0,8.2 Hz,H-6′),6.97 (1H,dd,J = 2.0,8.0 Hz,H-6″),7.06 (1H,d,J = 2.0 Hz,H-2′),7.07 (1H,d,J = 2.0 Hz,H-2″),7.56 (1H,d,J = 16.0 Hz,H-7′),7.60 (1H,d,J = 16.0 Hz,H-7″);13C-NMR (100 MHz,CD3OD) δ: 36.3 (C-2),37.5 (C-6),70.6 (C-4),72.4 (C-3),72.8 (C-5),74.8 (C-1),115.4 (C-8″),115.6 (C-8′),115.8 (C-2′,2″),116.7 (C-5′,5″),123.1 (C-6′,6″),127.9 (C-1′,1″),146.8 (C-3′,3″),147.4 (C-7′),147.6 (C-7″),149.8 (C-4′,4″),168.5 (C-9′),168.9 (C-9″),175.8 (COOH)。以上数据与文献报道基本一致[14],故鉴定化合物为3,5-O-二咖啡酰奎宁酸(异绿原酸A)。
2.7.2 异绿原酸B白色粉末(甲醇),ESI-MS m/z: 515 [M-H]-。δ: 1H-NMR (400 MHz,CD3OD) δ: 2.15~2.30 (4H,m,H-2,6),4.39 (1H,m,H-5),5.13 (1H,dd,J = 3.1,9.0 Hz,H-4),5.63 (1H,m,H-3),6.17 (1H,d,J = 16.0 Hz,H-8′),6.27 (1H,d,J = 16.0 Hz,H-8″),6.74 (1H,d,J = 8.2 Hz,H-5′),6.76 (1H,d,J = 8.2 Hz,H-5″),6.90 (1H,dd,J = 2.0,8.2 Hz,H-6′),6.91 (1H,dd,J = 2.0,8.0 Hz,H-6″),7.01 (1H,d,J = 2.0 Hz,H-2′),7.02 (1H,d,J = 2.0 Hz,H-2″),7.53 (1H,d,J = 16.0 Hz,H-7′),7.58 (1H,d,J = 16.0 Hz,H-7″);13C-NMR (100 MHz,CD3OD) δ: 38.4 (C-6),39.4 (C-2),68.9 (C-3),69.4 (C-5),75.8 (C-4),76.1 (C-1),114.7 (C-8′),114.8 (C-8″),115.2 (C-2′,2″),116.5 (C-5′,5″),123.1 (C-6′,6″),127.7 (C-1′,1″),146.8 (C-3′,3″),147.6 (C-7′),147.9 (C-7″),149.7 (C-4′,4″),168.2 (C-9′),168.6 (C-9″),176.8 (COOH)。以上数据与文献报道基本一致[15],故鉴定化合物为3,4-O-二咖啡酰奎宁酸(异绿原酸B)。
2.7.3 异绿原酸C淡黄色粉末(甲醇),ESI-MS m/z: 515 [M-H]-。1H-NMR (400 MHz,CD3OD) δ: 1.94~2.34 (2H,m,J = 6.4 Hz,H-2),4.35 (1H,m,J = 3.2 Hz,H-3),5.02 (1H,dd,J = 3.2,8.2 Hz,H-4),5.63 (1H,ddd,J = 4.5,8.2,10.8 Hz,H-5),1.94~2.34 (H,m,J = 4.6,10.8 Hz,H-6),7.02 (1H,d,J = 2.0 Hz,H-2′),6.74 (1H,d,J = 8.0 Hz,H-5′),6.88 (1H,dd,J = 2.0,8.0 Hz,H-6′),7.53 (1H,d,J = 15.9 Hz,H-7′),6.24 (1H,d,J = 15.9 Hz,H-8′),7.04 (1H,d,J = 2.0 Hz,H-2″),6.76 (1H,d,J = 8.0 Hz,H-5″),6.89 (1H,dd,J = 2.0,8.0 Hz,H-6″),7.59 (1H,d,J = 15.9 Hz,H-7″),6.28 (1H,d,J = 15.9 Hz,H-8″)。13C-NMR (100 MHz,CD3OD) δ: 38.6 (C-2),39.5 (C-6),69.4 (C-3),69.5 (C-5),75.9 (C-4),76.2 (C-1),114.8 (C-8″),114.9 (C-8′),115.4 (C-2′,2″),116.7 (C-5′,5″),123.1 (C-6′,6″),127.6 (C-1′,1″),146.8 (C-3′,3″),147.8 (C-7′),147.9 (C-7″),149.8 (C-4′,4″),168.5 (C-9′),168.9 (C-9″),175.8 (COOH)。以上数据与文献报道基本一致[16],故鉴定化合物为4,5-O-二咖啡酰奎宁酸(异绿原酸C)。
3 讨论咖啡酰奎宁酸类化合物在植物中分布广泛,并且具有多种药理活性,其中二咖啡酰奎宁酸类对心血管和血液系统、免疫系统以及消化和呼吸系统有很好的应用前景[4]。本实验通过大孔树脂富集目标化合物,利用中低压制备色谱技术制备同时得到高纯度的异绿原酸A、B和C,质量分数分别为98.7%、99.2%和97.6%,可作为常规分析检测、新药研究以及进一步综合控制金银花药材质量用的对照品,也可用于药理药效的筛选。
本研究建立了一种高质量分数异绿原酸A、B和C的分离方法,具有经济、简单、快速等优点,同时转移率较高,使目标产物总量达到54.9%,满足中药5类新药中有效部位的量应高于50%的规定,为金银花以有效部位为基础的单方及复方制剂的进一步研究和开发提供参考。
| [1] | 国家中医药管理局《中华本草》编委会. 中华本草 (第7卷) [M]. 上海: 上海科学技术出版社, 1999. |
| [2] | 汤喜兰, 刘建勋, 李 磊. 中药有机酸类成分的药理作用及在心血管疾病的应用 [J]. 中国实验方剂学杂志, 2012, 18(5): 243-246. |
| [3] | 陈 奇, 邓雁如, 夏 娜. 金银花多酚类物质的纯化研究 [J]. 药物评价研究, 2012, 35(3): 185-189. |
| [4] | 李祖晟, 朱志安. 二咖啡酰奎宁酸药理实验研究进展 [J]. 医药综述, 2004, 10(4): 249-250. |
| [5] | Kimura Y, Okuda H, Okuda T, et al. Studies on the activities of tannins and related compounds, X. Effects of caffeetannins and related compounds on arachidonate metabolism in human polymorphonuclear leukocytes [J]. J Nat Prod, 1987, 50(3): 392-399. |
| [6] | Iwai K, Kishimoto N, Kakin Y, et al. In vitro antioxidative effects and tyrosinase inhibitory activities of seven hydroxycinnamoyl derivatives in green coffe beans [J]. J Agric Food Chem, 2004, 52(15): 4893-4898. |
| [7] | Robinson W E, Reinecke M G, Abdel-Malek S, et al. Inhibitors of HIV-1 replication that inhibit HIV intergrase [J]. Proc Natl Acad Sci USA, 1996, 93(13): 6323-6331. |
| [8] | Oh H, Kang D G, Lee S, et al. Angiotensin converting enzyme inhibitors from Cuscuta japonica Chosy [J]. J Ethnopharm, 2002, 83(12): 105-108. |
| [9] | 周志娥, 罗秋水, 熊建华, 等. 绿原酸、异绿原酸A对大肠杆菌的抑菌机制 [J]. 食品科技, 2014, 39(3): 228-231. |
| [10] | Raman G, Cho M, Brodbelt J S, et al. Isolation and purification of closely related Citrus limonoid glucosides by flash chromatography [J]. Phytochem Anal, 2005, 16(3): 155-160. |
| [11] | 李 淼, 王永香, 孟 谨, 等. HPLC法测定金银花中新绿原酸等8中成分的量 [J]. 中草药, 2014, 45(7): 1006-1010. |
| [12] | 朱粉霞, 贾晓斌, 李秀峰, 等. UPLC法同时测定胆木注射液中原儿茶酸、新绿原酸、绿原酸和隐绿原酸 [J]. 中草药, 2013, 44(5): 571-573. |
| [13] | 张 桥, 沈 娟, 赵祎武, 等. 凌霄花中洋丁香苷的制备 [J]. 中草药, 2011, 42(12): 2465-2467. |
| [14] | Zhu X F, Zhang H X, Lo R. Phenolic compounds from the leaf extract artichoke (Cynara scolymus L.) and their antimicrobial activities [J]. J Agric Food Chem, 2004, 52(24): 7272-7278. |
| [15] | 汤 丹, 李会军, 钱正明, 等. 黄褐毛忍冬花蕾咖啡酰奎宁酸类成分研究 [J]. 中国药学杂志, 2007, 42(20): 1537-1539. |
| [16] | Zhu X F, Zhang H X, Lo R. Three di-O-caffeoylquinic acid derivatives from the heads of Cynara scolymus L. [J]. Nat Prod Res, 2009, 23(6): 527-532. |
 2015, Vol. 46
2015, Vol. 46


