2. 中国中医科学院中药资源中心, 道地药材国家重点实验室培育基地, 北京 100700
2. State Key Laboratory Breeding Base of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
《中国药典》2010年版[1]记载厚朴来源于木兰科植物厚朴Magnolia officinalis Rehd. et Wils. 或凹叶厚朴M. officinalis Rehd. et Wils. var. biloba Rehd. et Wils. 的干燥干皮、根皮及枝皮。厚朴分布于全国地区多个省区,不同产区的厚朴品质不一,以川朴(主产鄂、川)品质最优、温朴(主产闽、浙)次之[2]。厚朴的主要成分为厚朴酚等酚类、挥发油及生物碱,其挥发油中含有多种有效成分且被分离鉴别出来[3]。厚朴挥发油具有镇静和驱风健胃作用,其中以桉叶油醇以及其异构体的量最高,占挥发油总量的40%~50%[4],属于萜类化合物。
萜类化合物的生物合成途径主要有2条,一条途径是位于胞质中的甲羟戊酸途径(MVA pathway)[5];另一条途径是位于质体中的甲基-D-赤藓醇-4-磷酸途径(MEP pathway)[6, 7]。在MEP途径中,1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)为第一个限速酶,是单萜和双萜类芳香物质、类胡萝卜素(四萜)、VE和叶绿素等重要物质合成的关键调控位点。前人研究发现过度表达DXS基因,拟南芥植株中类胡萝卜素、VE、ABA和GAs等萜类物质量显著上升[8],证明了DXS基因在通过MEP 途径提供前体的萜类的生物合成中起着重要作用。目前银杏[9]、黄花蒿[10]、穿心莲[11]和丹参[12]等药用植物中的DXS基因均有报道。本研究通过厚朴转录组数据首次得到厚朴DXS1、DXS2基因序列,通过生物信息学分析对其结构进行分析,采用实时荧光定量PCR比较了2种基因在厚朴与凹叶厚朴中的表达差异,并通过GC-MS测定了厚朴与凹叶厚朴中挥发性成分的量,为揭示厚朴DXS基因调控萜类次生代谢产物的生物合成机制提供可靠的理论基础。
1 材料与方法 1.1 仪器与材料Trace 1310 TSQ 8000气相质谱仪(美国Thermo ScientificTM公司);β-石竹烯(质量分数≥98%)、β-氧化石竹烯(质量分数≥95%)和β-桉叶油醇(质量分数≥98%)对照品均购自美国Acros Organics公司;其余试剂均为分析纯。
供试材料来源于安徽省安庆潜山县,经中国中医科学院中药资源中心金艳助理研究员鉴定为木兰科植物厚朴Magnolia officinalis Rehd. et Wils. 或凹叶厚朴M. officinalis Rehd. et Wils. var. biloba Rehd. et Wils.。
1.2 基因数据获取厚朴1-脱氧-D-木酮糖-5-磷酸合酶(l-deoxy-D-xylulose-5-phosphate synthase,DXS)基因序列来源于厚朴转录组数据(本实验室保存),经冗余序列去除、序列组装,功能注释后分类。实验中其他物种的氨基酸序列均来自于GenBank数据库。
1.3 分析方法使用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找开放阅读框(ORF)。利用在线工具Protparam(http://www.expasy.ch/tools/protparam.html)预测基因编码蛋白的相对分子质量、氨基酸数目、等电点、不稳定系数、脂肪指数、亲水性/疏水性和编码区全长等理化性质;采用CDD(http://www.ncbi.mlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白质结构域分析;采用CFSSP(http://www.biogem.org/tool/chou-fasman/)进行蛋白质二级结构分析;利用Swiss Model(http://swissmodel.expasy.org/)程序,根据基因氨基酸序列进行建模,预测蛋白质的三级结构。用DNAMAN软件对序列进行多重比对,用ClustalW软件与其他植物的氨基酸序列进行比较,用MEGA 6.06软件构建Neighbor-joining系统进化树,bootstrap 重复次数为1 000次。
1.4 RNA提取和cDNA合成采用Trizol法从厚朴和凹叶厚朴叶中提取总RNA,琼脂糖凝胶电泳确定RNA完整性。ND2000测定总RNA的A260和A280值,选择A260/A280为1.8~2.0的总RNA进行反转录。用所提取的总RNA经TaKaRa反转录试剂盒(TaKaRa Prime ScriptTM 1st trand cDNA Synthesis Kit)反转录成cDNA。其过程为:总RNA模板1 μL(约200 ng),dNTP 1 μL,Radom 6 Mers 2 μL,RNase free H2O 至10 μL,离心,置于PCR仪上,65 ℃、5 min,之后冰上急冷。然后加入如下反应液:5×Primer Script Buffer 4 μL,RNase Inhibitor 0.5 μL,PrimeScript RTase 1 μL,RNase free H2O 4.5 μL。PCR条件为30 ℃、10 min,42 ℃、60 min,70 ℃、15 min,4 ℃维持,然后直接用于实时荧光PCR扩增或−20 ℃保存备用。
1.5 Real-time PCR从转录组中数据中获取厚朴内参照β-actin和DXS1、DXS2的核苷酸序列,利用PrimerPremier 5.0设计实时荧光定量引物,扩增产物长度在100~250 bp,送由生工生物工程(上海)公司合成,引物序列见表 1。反应体系:5 μL 2×SYBR green,0.2 μL ROX Reference Dye,0.2 μL 引物F,0.2 μL 引物R,1.0 μL cDNA,3.4 μL H2O。PCR反应条件为95 ℃、30 s;95 ℃、5 s,60 ℃、34 s,40个扩增循环;dissociation stage。在罗氏LightCycler® 480荧光定量PCR仪上进行荧光定量,结束后分析熔解曲线。各基因表达量以内参基因β-actin作为标准进行相对定量,每个反应重复3此,相对定量方法采用2−ΔΔCt法分析结果。
| 表 1 Real-time PCR引物序列 Table 1 Real-time PCR primers |
采用TraceGOLDTM TG-5MS气相色谱柱(30 m×0.25 mm,0.25 μm;Thermo ScientificTM,美国),程序升温(初始温度80 ℃,保持2 min;以10 ℃/min升温至100 ℃,保持2 min;再以10 ℃/min升温至250 ℃,保持16 min)。载气为氦气,体积流量0.7 mL/min;进样量1 μL,分流比18.5∶1,进样口温度250 ℃。
质谱条件:离子源为EI;电离电压:70 ev;离子源温度250 ℃;溶剂延迟时间3 min;质谱范围m/z 40~400;扫描周期0.3 scan/s。
1.6.2 挥发性成分测定分别精密称取各对照品适量,置于10 mL棕色量瓶中,加正己烷溶解并稀释至刻度,作为混合对照品储备液。取上述混合对照品溶液,稀释成系列质量浓度,按“1.6.1”项下条件测定,以对照品质量浓度为横坐标(X),对照品峰面积为纵坐标(Y),绘制标准工作曲线,以对照品峰面积为纵坐标(Y),得到回归方程分别为β-石竹烯Y=1.54×106 X -2.06×107,r=0.999 5,线性范围100.0~800.0 μg/mL;β-氧化石竹烯Y=1.05×106 X+5.62×106,r=0.999 7,线性范围100.0~800.0 μg/mL;β-桉叶油醇Y=2.06×106 X-6.50×107,r=0.999 2,线性范围100.0~800.0 μg/mL。
取干燥的样品粉末100 g,精密称定,加蒸馏水1 000 mL,浸泡4 h,按《中国药典》2010年版一部附录XD挥发油测定法甲法[1]提取挥发油。精密吸取经无水硫酸钠干燥的样品挥发油0.20 mL置10 mL棕色量瓶中,以正己烷稀释至刻度,摇匀,即得供试品溶液。按“1.6.1”项下条件进行GC-MS分析,以外标法计算各挥发性成分量。
2 结果与分析 2.1 蛋白质理化性质和结构域分析从厚朴转录组数据中获得MoDXS 2条。ORF Finder预测表明MoDXS1基因全长为2 031 bp,MoDXS2基因全长为2 160 bp。Protparam蛋白理化特性预测,结果表明MoDXS1基因编码氨基酸为677 aa,蛋白相对分子质量为72 790,理论等电点(PI)为7.15,脂肪指数87.75;MoDXS2编码氨基酸为720 aa,蛋白相对分子质量为78 060,PI为6.15,脂肪指数91.57。MoDXS1、MoDXS2均为不稳定的亲水蛋白。
利用NCBI的Conserved domains在线工具分析MoDXS1和MoDXS2蛋白的功能结构域。结果表明MoDXS1和MoDXS2都为多结构域蛋白,其结构域分属于TPP酶家族、PYR-TPP酶家族以及转酮醇酶-C家族,并包括2个TPP结合基序、PYR/PP接触面和二聚体接触面等功能结构(图 1)。
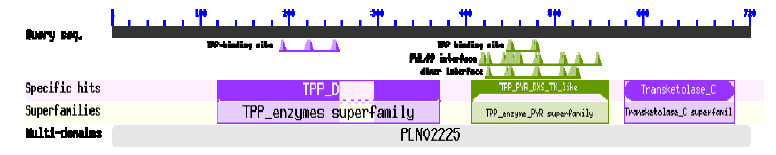 | 图 1 蛋白功能结构域分析Fig.1 Conserved domains analysis of deduced proteins |
根据厚朴MoDXS1、MoDXS2基因的氨基酸序列,利用CFSSP在线生物学工具预测多肽链中氨基酸序列的二级结构(图 2)。结果显示,MoDXS1的α-螺旋在多肽链中共有442个(65.3%),β-转角为252个(37.2%),延伸链共计87个(12.9%);MoDXS2的α-螺旋在多肽链中共有503个(69.9%),β-转角共计445个(61.8%),延伸链共计88个(12.2%)。
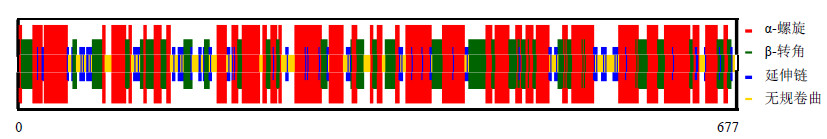 | 图 2 氨基酸结构中二级结构预测Fig.2 Predicted secondary structure of deduced proteins |
使用ExPASy在线服务器的SWISS-MODEL Homology Modeling对MoDXS1、MoDXS2、MoGCPE和MoLYTB蛋白进行同源建模,得到了蛋白的三维空间模型,如图 3所示。ExPAsy structure assessment程序评测推导,MoDXS1蛋白模型2o1s.1.A得分为0.86,蛋白序列的相似性为50.09%;MoDXS2蛋白模型2o1s.1.A得分为0.83,蛋白序列的相似性为43.19%。
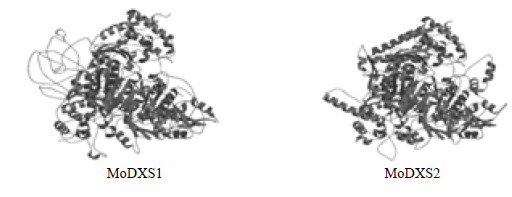 | 图 3 蛋白三级结构预测Fig.3 Predicted tertiary structure of deduced proteins |
用DNAMAN软件对MoDXS蛋白家族和拟南芥Arabidopsis thaliana(NP_193291.1)、烟草Nicotiana tabacum(CBA12009.1)、丹参Salvia miltiorrhiza(ACF21004.1)的氨基酸序列进行多序列对比,不同物种DXS编码序列的结果如图 4所示。分析表明MoDXS1与MoDXS2氨基酸序列均包含植物DXS蛋白典型的TPP结合基序、嘧啶结合基序和转酮醇酶C末端基序等3个保守基序,与其他3种植物烟草、丹参和拟南芥DXS家族具有很高的同源性。结果表明25个DXS活性位点中出现14个不完全保守的氨基酸位点,5种同源DXS序列多重比对后相同的氨基酸位点有346个,MoDXS1与MoDXS2之间相同的位点有383个。
 |
Nt-烟草 Sm-丹参 At-拟南芥 Nt-Nicotiana tabacum Sm-Salvia miltiorrhiza At-Arabidopsis thaliana 图 4 MoDXS氨基酸序列与同源序列的多重比对Fig.4 Multiple alignment of putative amino acids sequence of MoDXS with those of cloned DXS involved in other plants |
将MoDXS1、MoDXS2与GenBank中的其他植物的同源蛋白进行比对,在软件MEGA 6.06平台上采用相邻连接法构建进化树,进行聚类关系分析。结果如图 5,从进化树中可以得知MoDXS1在进化树中与黄花蒿Artemisia annua L. 亲缘关系最近,可信度达38%,其次与唇形科的丹参Salvia miltiorrhiza Bunge、穿心莲Andrographis paniculata (Burm. f.) Nees亲缘关系最近,与其他被子植物聚为一个大的分支,但MoDXS2单独聚为一支。
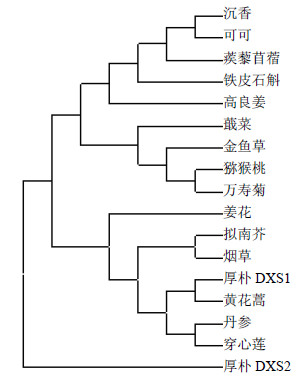 | 图 5 氨基酸序列的系统进化树分析Fig.5 Phylogenetic analysis of amino acid sequences |
采用Real-time PCR分别分析了厚朴和凹叶厚朴叶中DXS1、DXS2基因的表达差异情况。结果显示,DXS1和DXS2在厚朴与凹叶厚朴叶中均有明显表达,其中DXS1在厚朴和凹叶厚朴中表达差异不明显,但表达量均低于DXS2;而DXS2在凹叶厚朴中的表达量要明显高于厚朴。结果见图 6。
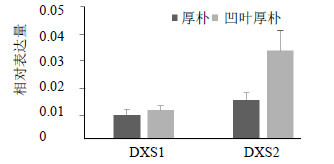 | 图 6 厚朴和凹叶厚朴中DXS1和DXS2的表达水平比较Fig.6 Expression levels of DXS1 and DXS2 between M. officinalis and M. officinalis var. biloba |
β-石竹烯、β-氧化石竹烯和β-桉叶油醇为厚朴叶和皮中的重要挥发性成分,占其总挥发油的50%以上[4, 13],故选择其作为指标性成分,对采自安徽潜山的厚朴、凹叶厚朴叶和皮进行测定,结果见表 2。从表 2中可以看出,在厚朴与凹叶厚朴的叶中,均是β-石竹烯>β-氧化石竹烯>β-桉叶油醇;在厚朴与凹叶厚朴的皮中,均是β-石竹烯>β-桉叶油醇>β-氧化石竹烯,且β-石竹烯量明显高于其他2种成分。此外,3种指标性成分在凹叶厚朴皮或叶中的量均高于厚朴。
| 表 2 厚朴及凹叶厚朴中挥发性成分的测定 (n = 3) Table 2 Determination of volatile components in M. officinalis and M. officinalis var. biloba (n = 3) |
厚朴为重要的药、食两用经济树种,药用成分挥发油类多以倍半萜类为主,如桉叶油醇、聚伞花素等。本研究首次对厚朴萜类合成MEP途径中的DXS基因家族进行了生物信息学和基因表达水平分析。ORF Finder 预测表明MoDXS1和MoDXS2基因均为全长;蛋白结构域分析显示MoDXS1、MoDXS2与其他植物的DXS基因有很高的同源性;利用同源建模法对厚朴的DXS基因进行分析,预测了其整体空间结构;同源序列对比显示MoDXS家族中的MoDXS1、MoDXS2与拟南芥、烟草和丹参的DXS蛋白具有较高的同源性;系统进化树聚类分析显示MoDXS1与其他被子植物亲缘关系较近,但MoDXS2单独聚为一支。
本研究通过实时荧光定量PCR对厚朴与凹叶厚朴中的DXS基因进行了表达差异分析,其中DXS1基因在二者之间无显著差异,表达量均很低,但是DXS2基因在凹叶厚朴中的表达量要明显高于厚朴。在荧光定量的基础上,通过GC-MS对厚朴与凹叶厚朴皮和叶中的3种挥发性成分进行测定,结果表明凹叶厚朴的皮和叶中β-石竹烯、β-氧化石竹烯和β-桉叶油醇量均高于厚朴,这正好与DXS2基因在凹叶厚朴中的表达量要明显高于厚朴结果相吻合。一般认为萜类成分差异与萜类合成途径关键酶的表达是有直接关系的,因此厚朴和凹叶厚朴DXS2基因表达的差异可能会影响到其萜类成分前体IPP的合成,进而影响萜类成分的生成。目前很多植物中均发现DXS的编码是由一个多基因家族组成,Walter等[14]从疾黎苜宿分离鉴定了DXS的3个cDNA序列,这3个cDNA序列种的其中2个构建的原核表达产物具有DXS活性。拟南芥基因组[15, 16]测出有3个DXS基因,但实验证明只有1个DXS蛋白有功能。因此对于厚朴和凹叶厚朴中DXS1和DXS2基因表达差异原因以及功能验证,有待于进一步深入研究。
植物功能基因的发掘和鉴定可以为基因育种、植物产量、品质和抗性改良开拓出广阔的前景。本研究结果显示了厚朴萜类物质生物合成MEP途径DXS基因结构和表达的多样性,为深入探究DXS在厚朴萜类合成中所发挥的功能提供了一定参考。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 郁重彦. 厚朴药材品质差异评价及遗传稳定性研究[D]. 临安: 浙江林学院, 2007. |
| [3] | 何小珍, 蒋军辉, 徐小娜, 等. GC-MS联用技术分析厚朴挥发油化学成分[J]. 应用化工, 2012, 41(2): 352-357. |
| [4] | 李玲玲. 厚朴挥发油化学成分研究[J]. 中草药, 2001, 32(8): 686-687. |
| [5] | Chappell J. Biochemistry and molecular biology of the isoprenoid biosynthetic pathway in plants[J]. Annu Rev Plant Biol, 1995, 46(1): 521-547. |
| [6] | Banerjee A, Sharkey T D. Methylerythritol 4-phosphate (MEP) pathway metabolic regulation[J]. Nat Prod Rep, 2014, 31(8): 1043-1055. |
| [7] | 高 伟. 丹参酮类化合物生物合成相关酶基因克隆及功能研究[D]. 北京: 中国中医科学院, 2008. |
| [8] | Juan M E, Araceli C, Andreas R, et al. 1-Deoxy-D-xylulose-5-phosphate synthase, a limiting enzyme for plastidic isoprenoid biosynthesis in plants[J]. J Biol Chem, 2001, 276: 22901-22909. |
| [9] | Gong Y, Liao Z, Guo B, et al. Molecular cloning and expression profile analysis of Ginkgo biloba DXS gene encoding 1-deoxy-D-xylulose 5-phosphate synthase, the first committed enzyme of the 2-C-methyl-D-erythritol 4-phosphate pathway[J]. Planta Med, 2006, 72(4): 329-335. |
| [10] | Arsenault P R, Vail D R, Wobbe K K, et al. Effect of sugars on artemisinin production in Artemisia annua L. : transcription and metabolite measurements[J]. Molecules, 2010, 15(4): 2302-2318. |
| [11] | Yang D, Ma P, Liang X, et al. PEG and ABA trigger methyl jasmonate accumulation to induce the MEP pathway and increase tanshinone production in Salvia miltiorrhiza hairy roots[J]. Physiol Plant, 2012, 146(2): 173-183. |
| [12] | Sharma S N, Jha Z, Sinha R K, et al. Jasmonate-induced biosynthesis of andrographolide in Andrographis paniculata[J]. Physiol Plantarum, 2015, 153(2): 221-229. |
| [13] | 李星彩. 厚朴叶挥发油化学成分分析及其抗菌活性研究[J]. 食品科技, 2013, 16: 271-275. |
| [14] | Walter M H, Hans J, Strack D. Two distantly related genes encoding 1-deoxy-d-xylulose 5-phosphate synthases: differential regulation in shoots and apocarotenoid-accumulating mycorrhizal roots[J]. The Plant J, 2002, 31(3): 243-254. |
| [15] | Estévez J M, Cantero A, Romero C, et al. Analysis of the expression of CLA1, a gene that encodes the 1-deoxyxylulose 5-phosphate synthase of the 2-C-methyl-D-erythritol-4-phosphate pathway in Arabidopsis[J]. Plant Physiol, 2000, 124(1): 95-104. |
| [16] | Rodŕıguez-Concepción M, Boronat A. Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids. A metabolic milestone achieved through genomics[J]. Plant Physiol, 2002, 130(3): 1079-1089. |
 2015, Vol. 46
2015, Vol. 46


