2. 平湖市食品药品检测中心, 浙江 嘉兴 314200
2. Pinghu Center for Food and Drug Testing, Jiaxing 314200, China
丹参Salviae Miltiorrhizae Radix et Rhizoma为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge. 的干燥根及根茎,是一种传统的中药,所含有的主要药效成分是脂溶性成分丹参酮,主要包括丹参酮I、丹参酮IIA和隐丹参酮3种,这些丹参酮具有抗肿瘤、抗菌消炎和抗氧化作用,对心血管系统和神经系统有较强的药理活性。丹参中成分非常复杂,其药效成分丹参酮的利用通常需要一个复杂的分离 过程。首先是提取过程,所采用的提取方法主要有传统的溶剂萃取、微波辅助萃取[1]、超声波辅助萃取[2]和超临界流体萃取[3]等;其次是纯化过程,去除一些干扰杂质以达到药用标准所要求的纯度。通常所采用的纯化方法有大孔吸附树脂法[4]、高速逆流色谱法[5]和柱色谱法[6]等。
磁分离技术指以超顺磁性颗粒作为吸附剂,在外加磁场作用下,实现复杂混合液中目标分子高效分离的技术。其突出优点是能高选择性地快速分离复杂混合物,近年来已引起人们的广泛关注。少量报道[7, 8]表明,该技术对复杂中药的药效成分表现出较好的纯化效果。基于磁场对磁性颗粒的高识别性分离,提出将药效成分的磁性吸附剂纯化过程耦合到其提取过程中,使提取和纯化过程1步同时进行,以简化分离工序、提高分离效率。为了验证该法的可行性,以超顺磁性聚羟乙基丙烯酸甲酯(PHEMA)微球为模型吸附剂,丹参中3种丹参酮为分离对象,首先对制备出的超顺磁性微球进行了表征,进一步考察了其对丹参酮的吸附性能,然后从分离纯度和提取率2方面考察了1步提取和纯化的分离效率。
1 仪器与材料扫描隧道电子显微镜(SEM)、JSM-6700F,JEOL,日本;振动样品磁强计(VSM),Model 4 HF VSM,ADE Technologies,美国;Agilent1100高效液相色谱仪。
甲基丙烯酸羟乙酯(HEMA)分析纯,购自Alfa Aesar公司;二甲基丙烯酸乙二醇酯(EGDMA),分析纯,购自Aldrich公司;偶氮二异丁腈(AIBN)、聚乙烯吡咯烷酮(PVP-K30,40 000)、聚乙二醇(PEG)6000、六水合氯化铁(FeCl3•6H2O)、四水合氯化亚铁(FeCl2•4H2O)、氨水(NH3•H2O,25%),均为分析纯,购自上海西陇化工有限公司;丹参酮I(质量分数为98%)、丹参酮IIA(质量分数为98%)和隐丹参酮(质量分数为97%)对照品购自天津麦迪瑞康有限公司。
丹参饮片购自同仁堂药店,经吉林省中医药科学研究院牛志多研究员鉴定为丹参Salvia miltiorrhiza Bge. 的干燥根茎,使用前被磨成粉末。
2 方法与结果 2.1 磁性PHEMA微球的制备磁性PHEMA微球的制备参照文献方法[9],略有修改,合成过程: 首先通过共沉淀法合成PEG修饰的超顺磁性Fe3O4纳米颗粒,11.8 g FeCl3•6H2O和4.30 g FeCl2•4H2O溶于200 mL去离子水中形成混合溶液,通氮气去氧,当溶液被加热到80 ℃时,在剧烈搅拌下快速添加25 mL 25% NH3•H2O于溶液中。大约2 min后,在Fe3O4颗粒上包覆PEG,添加50 mL PEG 6000水溶液(15 g PEG溶于50 mL去离子水中配制)。2 h后停止反应,通过磁倾析用去离子水洗涤2次以去除游离的PEG,备用。
磁性PHEMA微球以HEMA为聚合单体,AIBN为引发剂,PVP-K30为稳定剂和EGDMA为交联剂在乙醇水溶液中通过分散聚合法制备,聚合过程在一个配备搅拌桨的250 mL三口烧瓶中进行,具体如下: 2.5 g PVP溶于乙醇水混合溶剂中(乙醇80 mL,水9 mL),加入2 g PEG 6000-Fe3O4颗粒,超声20 min以充分分散在溶液中。随后依次加入单体相物质: 20 mL HEMA、1 mL EGDMA和300 mg AIBN同上述溶液混合均匀。混合液通氮去氧30 min,然后密封三口烧瓶,聚合反应在70 ℃连续搅拌下反应24 h。所获得的磁性PHEMA微球混合溶液用热的乙醇和水交替洗涤数次,干燥备用。
2.2 所制备超顺磁性微球的表征通过分散聚合法所制备的PHEMA磁性微球的形貌通过SEM进行了表征,如图 1所示,所制备的磁性微球呈球形,经粒径统计得到其平均粒径为1.2 μm。磁性微球的超顺磁性能通过振动样品磁强计进行表征,其磁滞回线如图 2所示,磁性微球的比饱和磁化强度为4.94 emu/g,无剩磁,结果表明这些磁性微球具有超顺磁性和较强的磁响应性。
 | 图 1 磁性微球的SEM图Fig.1 SEM pictures of magnetic microspheres |
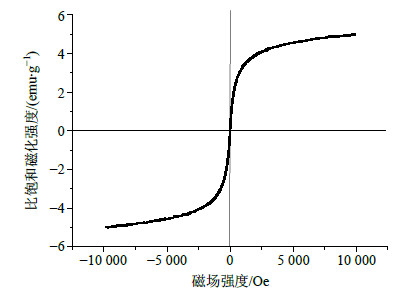 | 图 2 磁性PHEMA微球的磁滞曲线Fig.2 Magnetic hysteresis loops of magnetic microspheres |
色谱柱为Zorbax-ODS(150 mm×4.6 mm,5 μm),流动相为甲醇-四氢呋喃-水-醋酸(16∶37.5∶45.5∶1,体积比),体积流量为1 mL/min,紫外检测器波长设置为254 nm[1]。分别精密称取丹参酮IIA、丹参酮I和隐丹参酮对照品适量,加无水乙醇溶液配制成质量浓度均为100 μg/mL的对照品混合溶液,分别精密吸取该对照品溶液0.4、1.0、3.0、6.0、10 mL置10 mL量瓶中,用无水乙醇稀释至刻度,摇匀,即得系列对照品混合溶液。分别吸取10 μL按上述色谱条件进行分析,记录峰面积,以对照品的质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,并进行回归计算,得3中丹参酮的回归方程、相关系数和线性范围分别为丹参酮IIA Y=3 516 X+3.722,r2=0.999,4~100 μg/mL;丹参酮I Y=6 960 X+24.72,r2=0.999,4~100 μg/mL;隐丹参酮Y=3 848 X-10.83,r2=0.999,4~100 μg/mL。样品的定量测定过程如下: 取少量待测样品液,经微孔滤膜滤过后,精密量取质量浓度在上述标准曲线线性范围内的样品10 μL,对样品进行HPLC分析,记录3种丹参酮的峰面积,将峰面积各自代入其线性方程即可求得样品中3种丹参酮的质量浓度。
2.4 磁性PHEMA微球对丹参酮的吸附性能为了获得磁性微球对丹参酮的吸附性能,以丹参酮IIA为代表,考察了该吸附剂对丹参酮的吸附容量和吸附速率。吸附容量测定方法如下: 取20 mg磁性微球加入5 mL含不同质量浓度丹参酮IIA的无水乙醇溶液中,于摇床中室温振荡吸附1 h,溶液经磁分离后,上清液用液相色谱分析。磁性微球对丹参酮IIA的饱和吸附曲线如图 3所示,从图中可以看出磁性微球对丹参酮IIA的吸附容量随其质量浓度的增加而增加,当到达一定高质量浓度时吸附容量几乎不变,此时的饱和吸附容量约为4.51 mg/g,结果表明磁性微球能成功用于吸附丹参酮。
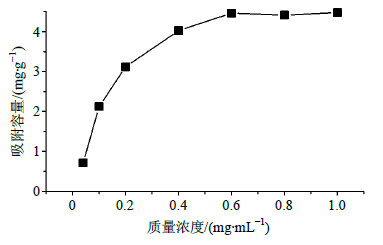 | 图 3 磁性PHEMA微球对丹参酮IIA的饱和吸附量曲线 Fig.3 Saturated adsorption curve of tanshinone IIA on magnetic microspheres |
吸附动力学测定如下: 将40 mg磁性微球加入20 mL含0.1 mg/mL丹参酮IIA的乙醇溶液中,于摇床中室温振荡吸附,每隔一定时间在外加磁场作用下取上清液进行浓度测定。其吸附动力学曲线如图 4所示,结果表明,磁性微球对丹参酮有着较快的吸附速率,在20 min内可以达到吸附平衡。
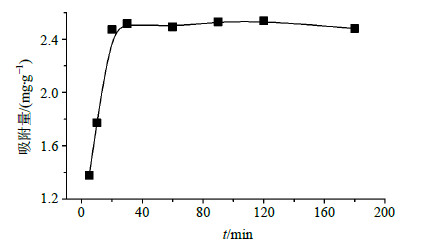 | 图 4 磁性PHEMA微球吸附丹参酮IIA的动力学曲线Fig.4 Adsorption kinetic curve of tanshinone IIA on magnetic microspheres |
磁性吸附剂1步提取纯化丹参粉末中丹参酮主要步骤如下: 将适量磁性微球和1 g丹参粉末加入含10 mL无水乙醇溶剂带塞玻璃瓶中,在恒温振荡器中于室温、200 r/min转速下1步提取纯化1 h,磁性微球与丹参粉末和无水乙醇的分离则通过一填充有条形磁铁的试管经磁分离实现,剩余溶液经滤过去掉丹参粉末得滤液,磁性微球于10 mL甲醇-乙酸(9∶1,体积比)在超声作用下脱附10 min,滤液和脱附液经液相色谱分析,计算得到丹参酮提取率(提取率=提取出的某种丹参酮质量/丹参粉末质量)。
2.5.1 磁性PHEMA微球用量的确定通过添加不同量的磁性PHEMA微球到含1 g丹参粉末的10 mL乙醇样品溶液中,于室温、250 r/min下振荡1 h,考察磁性微球用量对1步提取纯化过程丹参酮提取率的影响,结果如图 5所示,3种丹参酮的提取率随吸附剂用量的增加而增加,当用量达200 mg时3种丹参酮的提取率基本上保持不变,故微球的用量选择为200 mg。
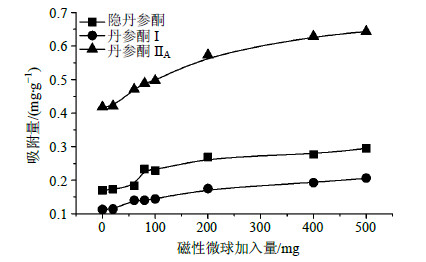 | 图 5 磁性微球加入量对3种丹参酮提取率的影响Fig.5 Effect of mass of magnetic microspheres on extraction yields of three tanshinones |
为了考察磁性微球1步提取纯化法对丹参酮的分离效率,从提取效率和分离时间2方面与溶剂萃取提取和磁性微球纯化2步法进行了对比。
比较提取效率,采用溶剂萃取丹参酮(1 g丹参粉末加入10 mL无水乙醇溶液中于室温、250 r/min下振荡)需要5 h才能达到萃取平衡,而添加200 mg磁性微球的1步法只需0.5 h即可达提取平衡,各自的提取率如表 1所示。显然,1步法对3种丹参酮的提取率均明显高于溶剂萃取法,表明1步法的提取效率显著高于溶剂萃取。磁性微球的加入对丹参酮溶剂萃取过程的强化作用可以从平衡分配的角度进行解释: 对于单纯溶剂萃取,丹参酮在丹参粉末基质和萃取溶液二者间进行平衡分配,而磁性微球加入后,丹参酮则在丹参粉末基质、萃取溶液和磁性微球三者间进行平衡分配,新增的平衡(磁性微球和萃取溶液间的平衡)势必会持续降低萃取溶液中丹参酮的量,使萃取平衡朝增加丹参酮提取率的方向移动,从而强化了溶剂萃取过程的提取效率。
| 表 1 溶剂萃取与磁性微球1步提取纯化方法对丹参酮提取效率的对比 Table 1Comparison on extraction efficiency of one-step separation method and solvent extraction method |
比较分离时间,2步法所需时间为5.5 h,即溶剂萃取时间(5.0 h)与磁性微球纯化时间(0.5 h)之和,而磁性微球1步法所需时间仅为磁性微球的纯化时间约0.5 h(因提取纯化过程同时进行),显然在分离时间上,1步法显著短于2步法。
2.5.3 纯化效果为了进一步考察磁性PHEMA微球1步提取纯化法对丹参酮的纯化效果,对比了单纯溶剂萃取和磁性微球1步提取纯化法(磁性微球脱附液)所获得丹参酮料液的HPLC图,如图 6所示,从二者谱图所含杂质峰的多少可以明显看出,磁性微球1步法有着良好的纯化效果,结果也表明磁性微球在丹参粉末基质存在的条件下对3种丹参酮仍表现出良好的纯化作用,这更进一步证明了所提出的磁性微球1步提取纯化法是可行的。
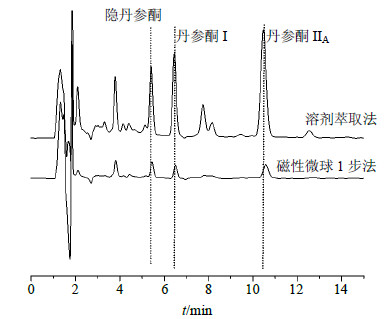 | 图 6 磁性微球1步法和溶剂萃取法的HPLC图对比Fig.6 Comparison on HPLC obtained by one-step method and solvent extraction method |
采用分散聚合法成功制备出平均粒径为1.2 μm的超顺磁性PHEMA微球,该微球对丹参酮有4.51 mg/g的饱和吸附容量和较快的吸附速率。
通过将超顺磁性吸附剂纯化过程耦合到提取过程,这种1步提取纯化法不仅使提取过程提取效率显著增加,对3种丹参酮的提取率从5 h的0.179%、0.093%、0.452%分别提高到0.5 h的0.279%、0.176%、0.575%,分离工序少,而且纯化效果好,分离时间也从5.5 h缩短为0.5 h,这些结果表明所提出的1步提取纯化法是高效的,在中药中有效成分的高效分离有着较好的应用前景。
| [1] | Pan X J, Niu G G, Liu H Z. Microwave-assisted extraction of tanshinones from Salvia miltiorrhiza Bunge with analysis by high-performance liquid chromatography [J]. J Chromatogr A, 2001, 922(1/2): 371-375. |
| [2] | Wu K, Zhang Q, Liu Q, et al. Ionic liquid surfactant-mediated ultrasonic-assisted extraction coupled to HPLC: Application to analysis of tanshinones in Salvia miltiorrhiza Bunge [J]. J Sep Sci, 2009, 32(23/24): 4220-4226. |
| [3] | Wang L, Song Y, Cheng Y, et al. Orthogonal array design for the optimization of supercritical fluid extraction of tanshinones from Danshen [J]. J Sep Sci, 2008, 31(2): 321-328. |
| [4] | 姜喜成, 秦培勇, 谭天伟. 大孔树脂对丹参酮IIA的静态吸附研究 [J]. 北京化工大学学报: 自然科学版, 2009, 36(3): 79-82. |
| [5] | Tian G, Zhang T, Zhang Y, et al. Separation of tanshinones from Salvia miltiorrhiza Bunge by multidimensional counter-current chromatography [J]. J Chromatogr A, 2002, 945(1/2): 281-285. |
| [6] | 姜喜成. 微波辅助提取中药有效成分及丹参酮的分离纯化 [D]. 北京: 北京化工大学, 2009. |
| [7] | Guo B Z, Ji S L, Zhang F F, et al. Preparation of C18-functionalized Fe3O4@SiO2 core-shell magnetic nanoparticles for extraction and determination of phthalic acid esters in Chinese herb preparations [J]. J Pharm Biomed Anal, 2014, 100: 365-368. |
| [8] | Zhang B, Xing J, Lang Y, et al. Synthesis of amino-silane modified magnetic silica adsorbents and application for adsorption of flavonoids from Glycyrrhiza uralensis Fisch [J]. Sci Chin Ser B-Chem, 2008, 51(2): 145-151. |
| [9] | Horák D, Benedyk N. Magnetic poly (glycidyl methacrylate) microspheres prepared by dispersion polymerization in the presence of electrostatically stabilized ferrofluids [J]. J Polym Sci Pol Chem, 2004, 42(22): 5827-5837. |
 2015, Vol. 46
2015, Vol. 46


