前胡Peucedani Radix为伞形科(Umbellifecrae)前胡属Peucedanum L. 植物白花前胡Peucedanum praeruptorum Dunn的干燥根及根茎,始载于《名医别录》,具有疏风散热、降气化痰等作用[1]。香豆素为其主要成分,现代药理研究香豆素类具有保护心血管、抗氧化、抗肿瘤等多种药理作用[2, 3],同时也具有疗效稳定、温和持久、副作用小、多靶点调节等优势。近年来有文献报道[4],以香豆素为母环合成的3-溴-4,7-二甲基-6-磺酰脲香豆素能显著降低小鼠血糖,然而进一步探讨香豆素类化合物是否对2型糖尿病具有治疗作用,却未见报道。本研究采用UPLC/Q-TOF-MS技术,鉴定出前胡提取物中的6种香豆素类成分,并探讨了前胡香豆素类提取物对2型糖尿病合并高血脂大鼠的治疗作用。
1 实验材料 1.1 仪器与设备Waters AcquityTM超高效液相色谱仪(美国Waters公司),包括二元高压泵、在线脱气机、柱温箱、自动进器样装置;Xevo G2 QTOF质谱仪(美国Waters公司),MassLynx 4.1数据处理工作站(美国Waters公司随机附带);XP26微量电子天平(瑞士Mettler Toledo公司);S30H-D78224超声波清洗仪(德国Elma Sonic公司)。AU-2700全自动生化分析仪(日本Olympus公司);L0106RB00347血糖仪(美国LifeScan公司);HL-5 L/50 MPa-IICWQ超临界流体萃取仪(华黎泵业有限公司)。
1.2 材料与试剂前胡香豆素类提取物由本实验室自制(经峰面积归一化法测得,总香豆素相对质量分数为98.1%),前胡原药材采自安徽省宁国市云梯乡,经安徽中医药大学刘守金教授鉴定为伞形科植物白花前胡Peucedanum praeruptorum Dunn的干燥根及根茎;对照品白花前胡甲素(批号111711-200602)、白花前胡乙素(批号111904-201203)购自中国食品药品检定研究院,质量分数均大于98.8%;链脲佐菌素(STZ,美国Sigma公司,批号20131009490);消渴丸(广州中一药业有限公司,批号J00387)。乙腈、甲醇、甲酸均为质谱纯(德国Merck公司),水为蒸馏水(香港屈臣氏公司)。血糖试纸(美国LifeScan公司,批号3060193009)。
1.3 动物SPF级SD雄性大鼠,体质量(200±20)g,由南京安立默科技有限公司提供,合格证号SCXK(皖)2013-002号。大鼠在恒温(24±2)℃、光照周期12 h/12 h环境中分笼饲养,适应性饲养1周。
2 方法与结果 2.1 化学成分鉴定 2.1.1 混合对照品溶液的制备分别精密称取对照品白花前胡甲素和白花前胡乙素适量,加甲醇制成质量浓度分别为0.031、0.024 mg/mL的混合对照品溶液。经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.1.2 前胡香豆素类提取物及供试品溶液的制备称取适量前胡药材粗粉,在萃取压力35 MPa、萃取温度60 ℃、萃取时间60 min、夹带剂乙醇比例15%、CO2体积流量20 mg/min的条件下进行萃取,萃取物加入石油醚(60~90 ℃)适量混匀,5 ℃以下冷藏72 h,待结晶完全析出后,弃去上层石油醚,再重复加入适量石油醚(60~90 ℃)反复重结晶2次,最后一次弃去上层石油醚后滤过,用少量石油醚(30~60 ℃)洗至滤液无色,室温挥干,即得前胡超临界CO2流体提取物粉末。精密称定0.102 mg前胡香豆素类提取物粉末,置于10 mL量瓶,加甲醇超声溶解,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.1.3 色谱条件色谱柱为Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),洗脱梯度:0~8 min,30%~60% B;8~15 min,60% B;15~20 min,60%~85% B。柱温30 ℃,进样量2 μL,体积流量0.25 mL/min。
2.1.4 质谱条件采用电喷雾正离子电离模式(ESI+),毛细管电压3.0 kV,锥孔电压30 V,离子源温度120 ℃,脱溶剂气温度450 ℃,脱溶剂气流量800 L/h。采用MSE模式进行数据采集,采集时间24 min,扫描间隔0.5 s,碰撞低能量6 V,碰撞高能量10~30 V,质量扫描范围m/z 100~1 000,碰撞气为高纯氩气,雾化气为高纯氮气,LockMass采用亮氨酸脑啡肽(Leueine Enkephalin)进行质量数实时校准。
2.1.5 前胡香豆素类提取物分析参照上述条件,取前胡香豆素类提取物样品2 μL进样,样品的总离子流图(TIC图)见图 1。在正离子模式下,前胡香豆素类提取物中的6个组分均有良好的响应。由一级质谱图得到各成分的准分子离子,均为 [M+Na]+峰,质量数分别为369.094 7、409.126 5、409.125 8、411.142 0、449.157 2、451.173 2,质量偏差(×10−6)分别为−0.8、0.5、−1.2、0、−0.8、0.2。
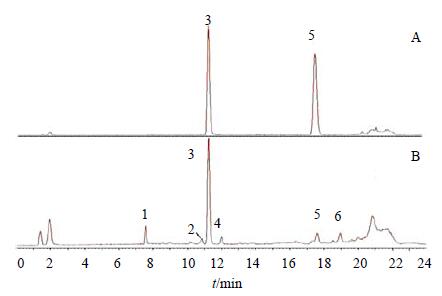 |
3-白花前胡甲素 5-白花前胡乙素 3-praeruptorin A 5-praeruptorin B 图 1 混合对照品 (A) 和供试品 (B) 的总离子流图 Fig.1 TIC of mixed reference solution (A) and tested solution (B) |
本研究对白花前胡甲素及白花前胡乙素对照品的裂解方式进行了探讨,见图 2、3。发现两者都存在m/z 227的碎片峰,根据化学结构式可以确定其为香豆素类化合物的母核。由前胡香豆素类提取物中的一级质谱图可知,6种成分均存在m/z 227的碎片峰,且文献资料[5]显示白花前胡主要成分为角型吡喃香豆素类(邪蒿内酯型香豆素),其3′、4′位脱取代基的母核质量数恰好为m/z 227,因而推测前胡香豆素类提取物的主要成分为角型吡喃香豆素。由于这些化合物的母核结构相同,因而很难对其进行准确地定性区分。在大量文献及对照品的基础上,初步鉴定了6个化合物,分别是qianhucoumarin D(1)、peucedanocoumarin II(2)、白花前胡甲素(3)、peucedanocoumarinI(4)、白花前胡乙素(5)、praeuptorin E(6),化学结构式见图 4。
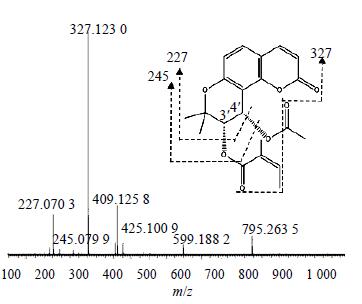 | 图 2 白花前胡甲素的一级质谱图 Fig.2 MS spectrum of praceruptorin A |
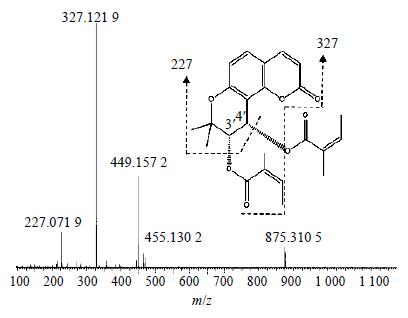 | 图 3 白花前胡乙素的一级质谱图 Fig.3 MS spectrum of praceruptorin B |
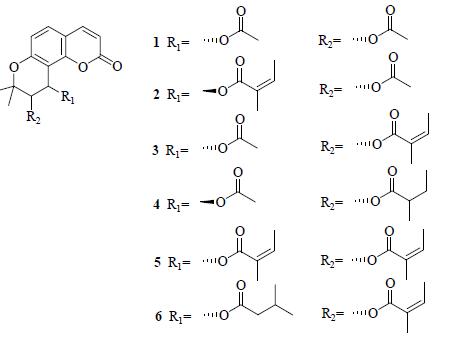 | 图 4 前胡香豆素类的化学结构 Fig.4 Chemical structures of total coumarins of Peucedani Radix |
色谱峰1:分子式为C18H18O7,m/z: 369.094 7 [M+Na]+、309.073 6 [M-CH3COOH+Na]+、287.091 7 [M+H-CH3COOH]+、245.080 9 [基峰,M+H-CH3COO-CH3CO]+、227.070 5 [M+H-CH3COO-CH3COO]+,以上数据与文献报道的qianhucoumarin D数据基本一致[6]。
色谱峰2:分子式为C21H22O7,m/z: 432.200 3 [M+HCOOH]+、409.126 5 [M+Na]+、327.137 9 [M+H-CH3COOH]+、287.091 2 [M+H-CH3CH= C(CH3) COOH]+、245.081 2 [基峰,M+H-CH3COO-CH3CH=C(CH3)CO]+、227.070 6 [M+H-CH3COOH- CH3CH=C(CH3)COOH]+,以上数据与文献中peucedanocoumarin II的数据基本一致[7]。
色谱峰3:分子式为C21H22O7,m/z: 425.100 9 [M+K]+、409.125 8 [M+Na]+、327.123 0 [基峰,M+H-CH3COOH]+、245.1 [M+H-CH3COO-CH3CH=C(CH3)CO]+、227.070 3 [M+H-CH3COOH-CH3CH=C(CH3)COOH]+,由图 1可见,此峰与白花前胡甲素对照品的保留时间、质谱信息相一致,且与文献中白花前胡甲素的数据基本一致[8],所以确定此峰为白花前胡甲素,碎片图见图 2。
色谱峰4:分子式为C21H24O7,m/z: 411.142 0 [M+Na]+、329.139 1 [M+H-CH3COOH]+、245.081 3 [基峰,M+H-CH3COO-CH3CH2CH(CH3)CO]+、227.070 4 [M+H-CH3COOH-CH3CH2CH(CH3) COOH]+,以上数据与文献报道的peucedanocoumarin I数据基本一致[9]。
色谱峰5:分子式为C24H26O7,m/z: 472.256 4 [M+HCOOH]+、465.130 2 [M+K]+、449.157 2 [M+Na]+、327.121 9 [基峰,M+H-CH3CH=C(CH3) COOH]+、227.071 9 [M+H-CH3CH=C(CH3) COOH-CH3CH=C(CH3)COOH]+,由图 1可见,此峰与白花前胡乙素对照品的保留时间相同,质谱信息一致,且与文献中白花前胡乙素的数据基本一致[8],所以确定此峰为白花前胡乙素,碎片图见图 3。
色谱峰6:分子式为C24H28O7,m/z: 474.262 7 [M+HCOOH]+、467.148 3 [M+K]+、451.173 2 [M+Na]+、327.122 8 [基峰,M+H-CH3CH(CH3) CH2COOH]+、245.081 8 [M+H-CH3CH(CH3) CH2COO-CH3CH=C(CH3)CO]+、227.069 4 [M+H-CH3CH(CH3)CH2COOH-CH3CH=C(CH3) COOH]+,以上数据与文献报道的praeuptorin E数据基本一致[10]。
2.1.6 前胡香豆素类提取物质谱分析从以上数据中可以总结出前胡总香豆素以下裂解规律:(1)前胡香豆素类提取物中各成分在正离子模式下均有较好的响应。(2)前胡香豆素类提取物在正离子模式下,均出现了 [M+K]+、[M+Na]+的特征峰(如白花前胡甲素出现m/z 409.125 8、425.100 9的峰)。(3)前胡总香豆素类3′、4′位取代基仅有2种断裂方式,一是烷氧键断裂,二是酰氧键断裂。(4)角型吡喃香豆素的4′位取代基较3′位容易断裂。(5)当3′位取代基上存在共轭体系时,先断裂4′位,形成脱4′位取代基峰。
2.2 对2型糖尿病大鼠的初步药效学研究 2.2.1 2型糖尿病大鼠模型的建立取100只健康雄性大鼠,根据体质量随机抽取15只为对照组,用普通饲料喂养,其余大鼠用高脂饲料(72%普通饲料+20%猪油+8%蔗糖)连续喂养4周后,禁食不禁水16 h,对照组大鼠ip pH 4.2的柠檬酸-柠檬酸钠缓冲液,对照组以外的大鼠按30 mg/kg的剂量ip STZ(临用前用pH 4.2的柠檬酸-柠檬酸钠缓冲液制成1%的溶液),72 h后,眼内眦静脉取血,测空腹血糖(FBG),FBG值≥11.1 mmol/L即造模成功[11, 12, 13]。
2.2.2 动物分组、给药与指标检测选取75只造模成功的大鼠,根据体质量与造模情况将大鼠随机分成5组,每组15只。其中模型组,ig同等体积的0.5%羧甲基纤维素钠溶液;消渴丸组,给药剂量为0.030 g/(kg∙d);前胡香豆素提取物又分为低、中、高剂量 [0.015、0.030、0.060 g/(kg∙d)] 组。同时对照组ig同体积的0.5%羧甲基纤维素钠溶液。上述药物均用0.5%羧甲基纤维素钠溶液配制成一定浓度的混悬液,给药量为1 mL/100 g,每日1次,连续4周。
给药4周后,大鼠禁食6 h,眼静脉取血后乌拉坦(0.15 g/kg)左下ip麻醉,腹主动脉取全血置于真空采血管中,静置30 min,离心(3 500 r/min),取上清液,比色法测大鼠血清糖化血红蛋白(GHB)量,其他指标用全自动生化仪进行检测。另取出大鼠肝、脾、肾脏称质量,并计算脏器指数(脏器指数=脏器质量/体质量)。
2.2.3 前胡香豆素类提取物对大鼠FBG及GHB量的影响由表 1结果可知,2型糖尿病大鼠血清FBG和GHB量会显著升高,与对照组比较差异非常显著(P<0.01),给药后,消渴丸及前胡香豆素类提取物高、中、低剂量组血清FBG较给药前均有明显降低(P<0.05、0.01),且与模型组相比也明显降低(P<0.05、0.01);消渴丸及前胡香豆素类提取物高、中剂量组血清GHB较模型组低(P<0.05、0.01)。结果表明,前胡香豆素类提取物能降低2型糖尿病大鼠血清FBG和GHB水平,且呈一定的量效关系。
| 表 1 前胡香豆素提取物对2型糖尿病大鼠FBG及GHB的影响 Table 1 Effect of total coumarins from Peucedani Radixon FBG and GHB in T2DM rats |
由表 2的结果可知,2型糖尿病大鼠血清TC、TG、LDL-C显著升高,而HDL-C水平显著降低,与对照组比较差异显著(P<0.01)。消渴丸组和前胡香豆素类提取物高、中剂量组大鼠血清TC、TG、LDL-C的水平较模型组相比明显降低,HDL-C水平则明显升高,差异显著(P<0.05、0.01)。表明前胡香豆素类提取物能降低糖尿病大鼠血清TC、TG、LDL-C及增加血清HDL-C的量,且呈一定的量效关系。
| 表 2 前胡香豆素类提取物对2型糖尿病大鼠血清TC、TG、HDL-C及LDL-C的影响 Table 2 Effect of total coumarins from Peucedani Radixon TC, TG, HDL-C, and LDL-C in T2DM rats |
由表 3的结果可知,2型糖尿病大鼠的脏器指数均较对照组大鼠高,差异非常显著(P<0.01)。消渴丸组大鼠的各脏器指数均较模型组明显降低,差异显著(P<0.05)。前胡香豆素提取物高剂量组大鼠仅肝脏指数较模型组显著降低(P<0.05),脾脏、肾脏指数与模型组无显著差异。前胡香豆素提取物中、低剂量组大鼠的各脏器指数与模型组均无显著差异。表明高剂量的前胡香豆素类提取物可能会降低2型糖尿病大鼠的肝脏指数。
| 表 3 前胡香豆素类提取物对2型糖尿病大鼠脏器指数的影响 Table 3 Effect of total coumarins from Peucedani Radixon viscera indexes in T2DM rats |
本实验对前胡超临界提取物进行了析出与重结晶,得到了较为纯净的前胡香豆素类提取物,超临界萃取法与传统提取分离技术相比,其对香豆素类成分的提取效率较高,能较好地将香豆素类成分与其他化合物进行分离[14]。基于前期对前胡中香豆素提取工艺的研究,发现以白花前胡甲素的提取率作为指标,超临界流体萃取法对白花前胡甲素的提取率为94.2%,纯化后白花前胡甲素的质量分数达40.8%[15]。运用UPLC/Q-TOF-MS法对前胡超临界提取物的化学成分进行定性分析,能得到较LC/MS更为准确的碎片相对分子质量,实验依据质谱所得的离子碎片信息,初步推断出了这6个色谱峰相应的化学结构。另对前胡香豆素类的质谱规律进行了简单的探讨,发现其断裂方式及离子碎片峰的相对丰度与香豆素母核上的3′取代基有很大关系,具体的裂解规律有待进一步探讨。
2型糖尿病模型的大鼠由于胰岛β细胞受损,胰岛素分泌不足,机体对葡萄糖的利用率降低,肝糖原输出增多,血清脂肪酸转运及移除的TG量减少,脂肪合成被抑制,导致糖和脂质代谢紊乱,且后期会出现体质量下降,各脏器不同程度的肿大,导致脏器指数较正常值高[16]。本实验在2型糖尿病大鼠模型的基础上评价了前胡总香豆素提取物的药理作用,采用高脂饲料联合低剂量的STZ诱发大鼠产生2型糖尿病,由于高脂可以引起机体的胰岛素抵抗,所以以此方法造成的2型糖尿病模型较温和更接近人类2型糖尿病的表征,而前胡总香豆素提取物能显著改善2型糖尿病大鼠的症状,升高HDL-C的量,降低LDL-C、TC及TG的量,调节血脂,降低机体由高脂导致的胰岛素抵抗,同时降低FBG及GHB量,抑制葡萄糖与血红蛋白结合,增加血糖的利用率。综上所述,前胡总香豆素对于2型糖尿病具有较好的降糖调脂作用。本实验为前胡总香豆素的质量控制及新型药理作用的开发提供理论依据。
| [1] | 陶弘景. 名医别录 [M]. 北京: 中国中医药出版社, 1986. |
| [2] | Xu Z, Wang X B, Dai Y, et al. (±)-Praeruptorin A enantiomers exert distinct relaxant effects on isolate rat aorta rings dependent on endothelium and nitric oxide sumthesis [J]. Chem-Biol Interact, 2010, 186(2): 239-246. |
| [3] | 徐 倩, 徐国兵. 香豆素类化合物代谢研究进展 [J]. 中国实验方剂学杂志, 2015, 21(3): 222-225. |
| [4] | 韩 莹, 屠树滋, 周卫芬, 等. 香豆素磺酰脲类化合物的合成及其降血糖活性研究 [J]. 中国药科大学学报, 2002, 33(2): 93-97. |
| [5] | 张 村, 李 丽, 耿立冬, 等. 白花前胡质量标准研究 [J]. 中国中药杂志, 2005, 30(3): 177-179. |
| [6] | Zhu G Y, Chen G Y, Li Q Y, et al. HPLC/MS/MS method for chemical profiling of Radix Peucedani (Baihua Quianhu) [J]. Chin J Nat Med, 2004, 2(5): 304-308. |
| [7] | Song Y L, Jing W H, Yan R, et al. Metabolic characterization of (±)-praeruptorin A in vitro and in vivo by high performance liquid chromatography coupled with hybrid triple quadrupole-linearion trap mass spectrometry and time-of-flight mass spectrometry [J]. J Pharm Biomed Anal, 2014, 90c(1): 98-110. |
| [8] | Liang T G, Yue W Y, Li Q S, et al. Chemopreventive effects of Peucedanum praeruptorum DUNN and its major constituents on SGC7901 gastric cancer cells [J]. Molecules, 2010, 15(11): 8060-8071. |
| [9] | Hou Z G, Xu D R, Shun Y, et al. An application of high-speed counter-current chromatography coupled with electrospray ionization mass spectrometry for separation and online identification of coumarins from Peucedanum praeruptorum Dunn [J]. J Chromatogr B, 2009, 877(24): 2571-2578. |
| [10] | Lv H W, Luo J G, Wang X B, et al. Application of UPLC-quadrupole-TOF-MS coupled with recycling preparative HPLC in isolation and preparation of coumarin isomer with similar polarity from Peucedanum praeruptorum [J]. Chromatographia, 2013, 76(3): 141-148. |
| [11] | Wang J J, Zhao R, Liang J C, et al. The antidiabetic and hepatoprotective effects of magnolol on diabetic rats induced by high-fat diet and streptozotocin [J]. Acta Pharm Sin, 2014, 49(4): 476-481. |
| [12] | Chen H Y, Wang J H, Geng M, et al. Protective effect of extract of Apocynum venetum on kidneys of streptozotocin-induced diabetic rats [J]. Acta Pharm Sin, 2010, 45(1): 26-30. |
| [13] | Li Y M, Fan X M, Wang Y M, et al. Therapeutic effects of Gegen Qinlian decoction and its mechanism of action on type 2 diabetic rats [J]. Acta Pharm Sin, 2013, 48(9): 1415-1421. |
| [14] | 徐国兵, 张亚中, 韩玲玲, 等. 前胡超临界提取物及挥发油的GC-MS分析 [J]. 中成药, 2010, 32(6): 988-991. |
| [15] | 张亚中, 徐国兵, 班永生, 等. 前胡中香豆素的提取工艺研究 [J]. 时珍国医国药, 2010, 21(12): 3189-3190. |
| [16] | 李敏州, 高彦彬, 马鸣飞, 等. 糖尿病肾病发病机制研究进展 [J]. 中国实验方剂学杂志, 2012, 18(22): 344-349. |
 2015, Vol. 46
2015, Vol. 46


