蒲公英为菊科植物蒲公英Taraxacum mongolicum Hand. -Mazz.、碱地蒲公英Taraxacum sinicum Kitag. 或同属数种植物的干燥全草。其性味苦、甘、寒,归肝胃经,具有清热解毒、消肿散结、利尿通淋的功效,用于治疗疔疮肿毒、乳痈、目赤、肺痈、肠痈、湿热黄疸和热淋涩痛等症[1]。研究表明,蒲公英的活性成分是以咖啡酸和绿原酸为主的有机酸类物质,故近代植物化学与定量测定方面的研究主要针对的是绿原酸和咖啡酸[2, 3, 4]。菊苣酸为有机酸类物质,是咖啡酸的衍生物,具有抗菌、抗病毒、提高免疫力、抗炎、抗氧化、清除自由基的作用[5, 6, 7],已被欧美国家作为免疫增强剂而广泛使用。但目前仅在松果菊、紫锥菊和菊苣等植物中有菊苣酸的报道[8, 9, 10],未发现从蒲公英中提取纯化菊苣酸和检测菊苣酸的研究,《中国药典》2015年版中蒲公英药材亦未有菊苣酸的测定。本实验首次运用HPLC法同时测定了蒲公英中菊苣酸、咖啡酸和绿原酸的量,建立的蒲公英中菊苣酸、咖啡酸和绿原酸测定方法简便易行,可用于蒲公英中此3种有机酸成分的测定,亦可为蒲公英药材及其制剂的质量控制提供依据。
1 仪器与试药 1.1 仪器Agilent 1260型高效液相色谱仪系统(美国Agilent 公司),包括四元梯度泵、真空在线脱气机、自动进样器、柱温箱、VWD检测器和Agilent色谱工作站;KQ3200E型超声波清洗器(昆山超声波仪器有限公司);Sartorius BP211D型电子分析天平(上海卓君电子有限公司)。
1.2 试药菊苣酸对照品(批号111752-200902)、咖啡酸对照品(批号110885-200102)、绿原酸对照品(批号110753-200413)购自中国食品药品检定研究院;蒲公英饮片购自河南(批号20150510)、湖北(批号20150516)、内蒙古(批号20150602)、甘肃(批号20150518)、山西(批号20150511),经笔者鉴定均为菊科植物蒲公英Taraxacum mongolicum Hand. -Mazz. 的干燥全草;乙腈(国药集团化学试剂有限公司)为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果 2.1 混合对照品溶液的配制分别精密称取菊苣酸、咖啡酸与绿原酸对照品2.40、0.92、1.40 mg,于10 mL量瓶中,用80%甲醇溶解,定容至刻度并混匀,即得混合对照品储备液;另精密吸取混合对照品储备液1 mL于10 mL量瓶中,用80%甲醇溶解并定容至刻度,配制成每含菊苣酸、咖啡酸与绿原酸分别为24.0、9.2、14.0 μg/mL的混合对照品溶液。
2.2 供试品溶液的制备取蒲公英饮片适量,粉碎,过三号筛。取本品粉末约0.5 g,精密称定,置50 mL量瓶中,加入80%甲醇适量,超声40 min,取出,放冷至室温,定容至刻度,混匀,滤过,取续滤液,过0.45 μm微孔滤膜,即得。
2.3 色谱条件色谱柱为Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm);流动相A为乙腈,流动相B为0.1%磷酸水溶液,梯度洗脱,0~15 min,9%~12% A;15~16 min,12%~18% A;16~30 min,18%~20% A;30~42 min,20%~50% A;42~55 min,50% A;体积流量为1.0 mL/min;检测波长为325 nm;柱温为40 ℃;进样量10 μL。
2.4 专属性试验及系统适用性试验在“2.3”项色谱条件下,混合对照品与供试品溶液中3种有机酸类成分达到基线分离,色谱图见图 1。菊苣酸、咖啡酸、绿原酸各色谱峰与相邻色谱峰的分离度均大于1.5,理论塔板数按菊苣酸峰计算均大于3 000。
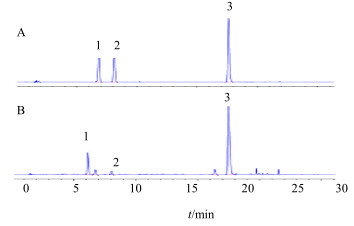 | 1-绿原酸 2-咖啡酸 3-菊苣酸 1-chlorogenic acid 2-caffeic acid 3-cichoric acid 图 1 混合对照品溶液 (A) 和供试品溶液 (B) 的HPLC图Fig.1 HPLC of standard solution (A) and sample solution (B) |
精密吸取混合对照品溶液0.1、0.2、0.5、2.0、10 mL,分别置10 mL量瓶中,加入80%甲醇稀释并定容至刻度,在上述色谱条件下,分别进样10 μL进行测定,记录峰面积。以峰面积(Y)为纵坐标,对照品质量浓度为横坐标(X),进行线性回归,得出3个化合物的回归方程及相关系数,见表 1。
| 表 1 菊苣酸、咖啡酸、绿原酸的回归方程、相关系数及线性范围 Table 1 Regression equations, correlation coefficients, and linear ranges of three organic acids |
精密吸取混合对照品溶液,其中含有菊苣酸24.0 μg/mL、咖啡酸9.2 μg/mL、绿原酸14.0 μg/mL,连续进样6次测定分析,记录峰面积。结果显示菊苣酸、咖啡酸、绿原酸峰面积的RSD分别为0.45%、0.59%、1.07%,表明仪器精密度良好。
2.7 稳定性试验取同一供试品溶液(批号20150518),分别于室温下放置0、2、4、6、8、12 h进行进样分析,记录峰面积。结果显示不同时间菊苣酸、咖啡酸、绿原酸峰面积的RSD分别为0.73%、1.26%、1.61%。表明供试品溶液在室温条件下12 h内稳定。
2.8 重复性试验取同一饮片粉末(批号20150518),共6份,按“2.2”项下方法制备成供试品溶液,分别进样10 μL进行测定,记录峰面积并计算样品中菊苣酸、咖啡酸、绿原酸的量。结果显示菊苣酸、咖啡酸、绿原酸平均质量分数分别为0.194%、0.026%、0.017%,RSD分别为1.43%、1.87%、2.13%,表明本法重复性良好。
2.9 加样回收率试验取蒲公英饮片粉末(批号20150518)约0.25 g,精密称定6份,分别置于50 mL量瓶中,分别精密加入混合对照品溶液5.0 mL(含绿原酸、咖啡酸、菊苣酸质量浓度分别为402、56、36 μg/mL),再按“2.2”项下制备成供试品溶液,进样测定,记录峰面积,计算加样回收率,绿原酸、咖啡酸、菊苣酸的加样回收率分别为101.67%、99.88%、100.07%,RSD值分别为1.15%、1.53%、0.52%。
2.10 样品测定取不同产地的蒲公英饮片,粉碎,过三号筛。取各粉末约0.5 g,精密称定,按“2.2”项下制备成供试品溶液,分别进样10 μL进行测定,记录峰面积并计算样品中菊苣酸、咖啡酸、绿原酸的质量分数,结果见表 2。从结果可知,山西产蒲公英中菊苣酸的质量分数最高,其次是河南。含咖啡酸较多的是湖北产的蒲公英。另外,山西和河南产的蒲公英中,绿原酸质量分数较高。
| 表 2 蒲公英中菊苣酸、咖啡酸、绿原酸量 Table 2 Contents of three organic acids in Taraxaci Herba |
本实验对供试品溶液的制备方法进行了筛选,分别为(1)不同提取方式(回流和超声)对实验结果的影响,结果显示超声提取效率明显优于回流提取;(2)不同提取溶剂(20%、50%、80%甲醇和纯甲醇)的提取效率,结果表明80%甲醇提取效率最高;(3)不同超声时间(30、40、50、60 min)对测定结果的影响,结果显示超声时间40 min时3种有机酸的量均较高。因此最终选择80%甲醇作为提取溶剂,超声提取40 min制备供试品溶液。
本实验对有机酸的色谱条件进行优选,结果为(1)全波长扫描发现3种有机酸在325 nm处均有较强吸收;(2)考察不同色谱柱 [Phenomenex Luna C18(250 mm×4.6 mm,5 μm)、Phenomenex Gemini C18(250 mm×4.6 mm,5 μm)和Kromasil 100-5C18(250 mm×4.6 mm,5 μm)] 的分离度、峰形及柱效,结果显示以Phenomenex Luna C18为最佳;(3)考察不同溶剂流动相系统,包括甲醇(乙腈)-水、甲醇(乙腈)-0.1%磷酸水溶液及其不同比例配比等,结果表明乙腈-0.1%磷酸水溶液梯度洗脱系统作为流动相时,供试品分离度和峰形最佳;(4)考察不同柱温(30、35、40 ℃)下的图谱,结果表明40 ℃下分离度最好。最终优选出本实验中最佳色谱条件为色谱柱为Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm)、流动相为乙腈-0.1%磷酸水溶液、梯度洗脱、体积流量为1.0 mL/min、检测波长为325 nm、柱温为40 ℃。
本研究结果表明,5个产地蒲公英饮片中均含有菊苣酸、咖啡酸和绿原酸,其中以菊苣酸量最高,但不同产地蒲公英中菊苣酸量差异较大,可能与其生长环境和期限以及采收季节的不同有关。本研究首次建立了同时测定蒲公英药材中菊苣酸、咖啡酸和绿原酸的分析方法,此方法简便易行,结果可靠、稳定,可用于蒲公英中此3种有机酸成分的测定,亦可为蒲公英药材及其制剂的质量控制提供依据。
| [1] | 中国药典 [S]. 一部. 2015. |
| [2] | 李红梅, 张 榕, 常东胜. 高效液相色谱法测定蒲公英提取物中绿原酸含量 [J]. 药物分析杂志, 2009, 29(7): 1230-1233. |
| [3] | 刘 燕, 彭章明, 粟 珊, 等. HPLC同时测定宜宾产蒲公英中的咖啡酸和绿原酸 [J]. 华西药学杂志, 2010, 25(2): 198-200. |
| [4] | 李喜凤, 师绘敏, 陈随清. HPLC同时测定蒲公英中咖啡酸和绿原酸的含量 [J]. 中成药, 2008, 30(10): 1553-1556. |
| [5] | Robinson W. L-chicoric acid, an inhibitor of HIV integrase, improves on the in vitro anti-HIV effect of zidovudine and a protease inhibitor (AGl350) [J]. Antiviral Res, 1998, 9(2): 101-106. |
| [6] | 闫晓慧, 谈 锋. 3种松果菊属植物的鉴别、活性成分及生物技术研究进展 [J]. 中草药, 2006, 37(2): 300-304. |
| [7] | King P J, Robinson W E. Resistance to the anti-human immunodeficiency virus typel (HIV-1) compound, L-chicoric acid results from a single mutation at amimo acid 140 of integrase [J]. J Virol, 1998, 72: 8420-8426. |
| [8] | 李 晶, 聂 斌, 武 力, 等. 引种紫锥菊中菊苣酸的定性定量分析 [J]. 药物分析杂志, 2011, 31(9): 1804-1809. |
| [9] | 钟英杰, 李 亮, 徐福亮. 紫锥菊中菊苣酸的提取工艺和含量测定 [J]. 中国实验方剂学杂志, 2010, 16(4): 1-4. |
| [10] | 华 春, 李建玲, 周 峰, 等. 菊苣中菊苣酸提取工艺优化 [J]. 食品科学, 2011, 32(20): 126-129. |
 2015, Vol. 46
2015, Vol. 46

