2. 南京中医药大学药学院, 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210023
2. Jiangsu Provincial TCM Engineering Technology Research Center of High Efficient Drug Delivery System, School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
黄酮碳苷(C-glycosyl flavonoids)是指糖基以C-C键直接连接在黄酮母体上的一类化合物。目前发现的黄酮碳苷类结构中,糖基主要连接在A环的C-6和/或C-8位。近来也有文献报道了一些糖基连接在C环C-3位和B环C-4′位的碳苷结构。根据结构的不同,黄酮碳苷主要分为2种类型:单糖碳苷黄酮和双糖碳苷黄酮,此外还存在着O-糖基-C-糖基黄酮(O-glycosyl-C-glycosyl flavonoids)以及O-乙酰化-C-糖基黄酮(O-acylated-C-glycosyl flavonoids)的结构类型[1]。黄酮碳苷中苷元部分主要有黄酮、黄烷酮、黄酮醇、二氢查耳酮和双黄酮等。黄酮碳苷与黄酮氧苷不同,不易发生水解,具有广泛的药理活性,主要表现为抗氧化、抗炎、抑制血糖增高、抗溃疡、中枢神经保护等功效。因此,近来黄酮碳苷受到越来越广泛的关注[2, 3, 4]。
黄芩Scutellaria baicalensis Georgi是临床上常用的一种清热燥湿、泻火解毒的传统中药,酚类化合物是其发挥药效的主要活性成分。现代质谱分析方法的快速发展使得能够广泛地表征黄芩多种组分的可能结构。Liu等[4]利用离子阱质谱鉴定了黄芩中32个黄酮类结构;Wang等[5]通过高丰度成分剔除的方法筛选出黄芩中117个低丰度的黄酮结构。这些基于质谱的广谱分析取得了很大的成果,从黄芩中筛选出了一部分具有明显效应的黄酮成分,却忽视了黄芩中碳苷黄酮的筛选和结构鉴别。本实验采用UPLC/LTQ- Orbitrap-MS高分辨率质谱仪,表征黄芩中的黄酮碳苷类成分,并通过比较MS2、MS3和MS4的碎片离子丰度对其中的同分异构体进行区分。该研究为其他中药成分中的碳苷结构解析提供参考依据。
1 仪器与材料超高效液相U3000(美国戴安公司)-质谱联用仪LTQ-Orbitrap XL质谱仪(美国Thermo公司);实验室超纯水机(Millipore Direct-Q3,美国Merck Millipore化工技术有限公司);Eppendorf Centrifuge 5417R离心机(德国Eppendorf公司);EYELA OSB2100真空旋转蒸发仪(东京理化器械株式会社);BT25S电子天平(赛多利斯科学仪器有限公司)。乙腈(色谱纯,Merck公司);水为自制纯净水(Millipore Direct-Q3制备);甲酸(色谱纯,DIKMA公司,美国)其他试剂均为分析纯。
黄芩药材购自铜陵禾田中药饮片股份有限公司(批号20130916),经南京中医药大学药学院中药鉴定教研室刘圣金博士鉴定为唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根。
2 方法 2.1 色谱条件色谱柱为Thermo BDS Hypersil C18反相色谱柱(100 mm×2.1 mm,2.3 μm);流动相由A(0.1%甲酸水溶液)和B(0.1%甲酸乙腈溶液)组成;梯度洗脱程序:0~3 min,10% B;3~40 min,10%~50% B;40~44 min,50%~80% B;44~46 min,10% B。柱温35 ℃;进样体积5 μL;体积流量0.25 mL/min。
2.2 质谱条件喷雾电压为3.5 kV;加热毛细管温度为300 ℃;雾化温度为350 ℃;鞘气为275 kPa;辅助气为104 kPa。进样前利用标准溶液对Orbitrap质量分析器的质量数进行校准。样品首先通过Orbitrap分析器进行全扫描分析,质量范围设定为m/z 200~800,分辨率设为30 000;MS2、MS3和MS4质谱的触发方式为动态数据依赖分析模式(data-dependent acquisition mode),选取上一级最高峰进行碰撞诱导碎裂解离(collision induced dissociation,CID)碎片扫描,碰撞能量设定为30%,以离子阱打拿极检测。
2.3 药材提取及测定取黄芩约10.0 g,精密称定,加70%乙醇100 mL,加热回流3 h,放冷,滤过,滤液置烧杯中,用少量70%乙醇分次洗涤容器和残渣,洗液滤置同烧杯中。滤液置于真空旋转蒸发仪中浓缩,浓缩液置10 mL量瓶中,用少量水分次洗涤容器和残渣,洗液置同一量瓶中,加水至刻度,摇匀。吸取供试样品200 μL,20 000 r/min离心10 min,转移上清溶液至进样瓶中,取5 μL注入UPLC/LTQ-Orbitrap仪器,测定。
3 结果与分析为了能够更全面地筛选出黄芩中的黄酮碳苷类成分,本实验在正、负离子模式2种检测条件下进行化合物筛选和结构表征。文献报道[6, 7, 8],黄酮碳苷与黄酮氧苷不同,在CID条件下,糖残基内部发生裂解(图 1),连续丢失2或3个水分子形成特征性 [M±H-18]+/−、[M±H-36]+/−和 [M±H-54]+/−等碎片。这些特征碎片离子可以作为诊断离子与黄酮氧苷进行区别。通过诊断离子扫描(图 2),本实验在黄芩中共检测到19个黄酮碳苷,其中有2个单糖碳苷、11个双糖碳苷、1个氧苷-碳苷黄酮、4个黄烷酮碳苷(C-glycosyl flavanones)、1个二氢查耳酮碳苷。相应的碎片信息见表 1。
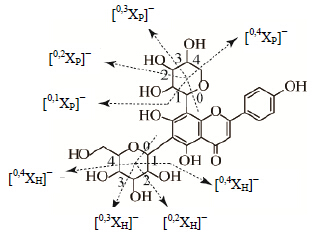 |
下标P表示戊糖基碎裂,G表示葡萄糖基碎裂,H表示己糖基碎裂,D表示脱氧己糖碎裂,下同 subscript of P stand for pentosyl, G for glycosyl, H for hexosyl, and D for deoxy-hexosyl, same as below 图 1 芹菜素6-C-葡萄糖-8-C-阿拉伯糖苷的碎裂途径 Fig.1 Fragmentation pattern of apigenin-6-C-glucosyl- 8-C-arabinoside |
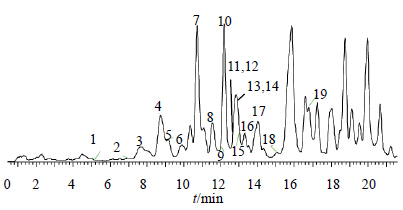 |
图 2 黄芩中的黄酮碳苷类成分的总离子流图 Fig.2 TIC of C-glycosyl flavonoids from S. baicalensis |
| 表 1 UPLC/LTQ-Orbitrap检测黄芩中碳苷黄酮的碎片信息 Table 1 Fragmetation information of C-glycosyl flavonoids in extract by UPLC/LTQ-Orbitrap |
16和19号峰在正离子扫描模式下均产生m/z 417.118 4(C21H21O9)的加质子峰。MS2谱图中产生较高丰度的碎片离子m/z 321.2([0,4XG-H2O]+)、297.3([0,2XG]+)、279.3([0,2XG-H2O]+)和267.2([0,1XG]+),由己糖碎裂产生。由此推断苷元结构可能与葡萄糖相连,根据质荷比所推测的分子式,其苷元部分为白杨素。化合物16和19的结构可能为白杨素葡萄糖碳苷。文献报道[8, 9],通过比对同分异构体的碎片丰度可以区分C-6和C-8葡萄糖碳苷,如牡荆黄素(vitexin,apigenin-8-C-glucoside)和异牡荆黄素(isovitexin,apigenin-6-C-glucoside)以及荭草苷(orientin,lutelin-8-C-glucoside)和异荭草苷(isoorientin,lutelin-6-C-glucoside)。表 2给出了化合物16和19在正负离子下产生MS2碎片离子的丰度。结果表明,化合物19在负离子模式下产生m/z 397.4([M-H-H2O]−,相对丰度2.1%)和m/z 325.1([0,3XG]−,相对丰度19.4%),而16号峰没有扫描到m/z397.4。这些信息提示化合物19为白杨素6-C-葡萄糖苷。相应的,推测化合物16为白杨素8-C-葡萄糖苷。这些结果与Ferreres等[6]和Li等[8]的报道一致。正离子模式下产生的碎片信息与文献报道存在一些差别。Cuyckens等[9]报道8-C-葡萄糖苷会产生 [M+H-120]+的基峰。而在本研究结果中,2个化合物都产生 [M+H-18]+的基峰。它们区别主要在MS2中产生的m/z 363.0([M+H-3H2O]+)、351.2([2,3XG-2H2O]+)、321.3([0,4XG-2H2O]+)和297.2([0,2XG]+)。这4个碎片离子在6-C-葡萄糖苷中都具有较高的丰度,而在8-C-葡萄糖苷中丰度则相对较低。
| 表 2 6-C-葡萄糖黄酮和8-C-葡萄糖黄酮在MS2中碎片离子的相对丰度 Table 2 Relative abundances of fragments obtained from 6-C-glucosylflavonoid and 8-C-glucosyl flavonoid in MS2 |
根据精确质量数所预测的分子式,本研究共推测出11个双糖取代的黄酮碳苷,其中10个为6-C-糖基-8-C-糖基结构,1个为O-糖基-C-糖基结构。
3.2.1 6-C-糖基-8-C-糖基黄酮的结构鉴定在负离子模式下,2号和3号峰在高分辨质谱中产生相同的去质子峰m/z 563.137 0(C26H27O14)。表 3给出了这2个化合物在CID中的MS2碎片离子丰度。结果显示,2号色谱峰产生了m/z 473.2([M-H-90]−)的基峰,而3号色谱峰产生了m/z 443.2([M-H-120]−)的基峰。文献报道[8],CID更容易使得C-6位的糖基碎裂。由此推测2号峰为芹菜素6-C-阿拉伯糖-8-C-葡萄糖苷,形成的 [M-H-90]− 来源于C-6位阿拉伯糖0-2键的断裂([0,2XP]−)。3号色谱峰为芹菜素6-C-葡萄糖-8-C-阿拉伯糖苷,形成的 [M-H-120]− 来源于C-6位葡萄糖0-2键的裂解([0,2XG]−,如图 1所示)。这与文献报道的结果相一致。除此之外,这2个化合物所产生碎片离子m/z 403.2([M-H-60]−)的相对丰度也存在差异,2号峰的相对丰度为71.1%,3号峰丰度为12.5%[7]。在正离子模式下,2个化合物的区别主要在 [M+H-H2O]+、[M+H-2H2O]+、[M+H-3H2O]+和 [M+H-138]+,2号峰形成的这4个碎片离子丰度均>70%,而3号峰的丰度都<30%。所有这些碎片离子的特征丰度都能够用于区别6-C-葡萄糖-8-C-戊糖苷和6-C-戊糖- 8-C-葡萄糖苷的黄酮碳苷结构。
| 表 3 6-C-戊糖-8-C-葡萄糖黄酮和6-C-葡萄糖-8-C-戊糖黄酮在MS2中碎片离子的相对丰度 Table 3 Relative abundances of fragments obtained from 6-C-pentosyl-8-C-glucosyl flavonoids and 6-C-glucosyl-8-C-pentosyl flavonoids in MS2 |
根据上述的分析,推测7号和8号峰为白杨素6-C-戊糖-8-C-葡萄糖苷;10号和12号峰为白杨素6-C-葡萄糖-8-C-戊糖苷;11号峰为刺槐黄素6-C-戊糖-8-C-葡萄糖苷,17号峰为刺槐黄素6-C-葡萄糖- 8-C-戊糖苷(表 3)。
15和18号峰在高分辨质谱中都产生m/z 561.161 8(C27H29O13)去质子峰,比7、8、10和12号峰所对应的结构多1个甲基基团,由此推测15和18号峰的结构中可能存在脱氧己糖。15号峰的MS2谱图中形成m/z 487.3([M-H-74]−,相对丰度56.8%)和m/z 457.3([M-H-104]−,相对丰度100%)。这2个特征性的碎片分别来源于脱氧己糖0-3键和0-2键的断裂。由此推测,15号峰可能为6-C-脱氧己糖碳苷。18号峰的MS2中产生m/z 471.3([M-H-90]−,相对丰度42.0%)和m/z 441.3([M-H-120]−,相对丰度100%)。由此推测18号峰为6-C-葡萄糖碳苷。综合以上信息,15号峰为白杨素6-C-脱氧己糖-8-C葡萄糖碳苷,18号峰为白杨素8-C-脱氧己糖-6-C-葡萄糖碳苷(表 4)。
| 表 4 6-C-脱氧己糖-8-C-葡萄糖苷和6-C-葡萄糖-8-C-脱氧己糖苷在MS2中碎片离子的相对丰度 Table 4 Relative abundances of fragments obtained from 6-C-glucosyl-8-C-deoxy-hexosyl flavonoid and 6-C-deoxy- hexosyl-8-C-glucosyl flavonoid in MS2 |
5号色谱峰在高分辨质谱中产生m/z 577.152 4(C27H29O14)的去质子峰。所预测的分子式比15和18号峰多1个羟基。MS2和MS3中,去质子峰产生连续的120中性丢失。由此推测,5号峰可能为双葡萄糖碳苷。MS2图中产生的较高丰度的m/z 337.2([0,2XG] [0,2XG]−)和367.1([0,2XG] [0,3XG]−)提示5号峰为白杨素6,8-C-二葡萄糖苷。
3.2.2 O-糖基-C-糖基黄酮的结构鉴定14号峰在高分辨质谱中产生了m/z 579.167 9(C27H30O14)的质子化色谱峰。MS2图中特征性的脱葡萄糖碎片离子m/z 417.2([M+H-162]+)以及 [M+H-18]+、[M+H-36]+、[M+H-54]+、[M+H-66]+、[M+H-120]+和 [M+H-150]+提示结构中同时存在C-葡萄糖和O-葡萄糖,并且O-葡萄糖基团连接在苷元的羟基上,而非C-葡萄糖的羟基上。MS3中产生的碎片离子 [M+H-162-18]+、[M+H-162-36]+、[M+H-162-54]+、[M+H-162-66]+、[M+H-162-120]+和 [M+H-162-150]+进一步确证了C-葡萄糖-O-葡萄糖的结构。由于MS3谱图碎片离子丰度与白杨素6-C-葡萄糖苷一致,因此推测14号峰为白杨素7-O-葡萄糖-6-C-葡萄糖苷。
3.3 黄烷酮碳苷的结构鉴定及同分异构体的区分理论上,黄烷酮碳苷的不饱和度比相应的黄酮碳苷大1。通过分析不饱和度,在监测到的19个黄酮碳苷中共发现有4个黄烷酮碳苷结构,其中有2个为双糖黄烷酮碳苷。9号峰产生了m/z 435.128 8(C21H23O10)的质子峰,MS2图中存在的 [M+H-18]+、[M+H-36]+、[M+H-54]+、[M+H-66]+、[M+H-120]+和 [M+H-138]+,提示该化合物为单糖黄烷酮碳苷。在负离子模式下,MS2和MS3都产生了m/z 167.0。这个碎片离子来源于黄烷酮苷元C环中1-4键的断裂(图 3)。因此,推测9号峰为柚皮素C-葡萄糖苷。产生的m/z 167.0则作为特征碎片诊断黄烷酮碳苷。
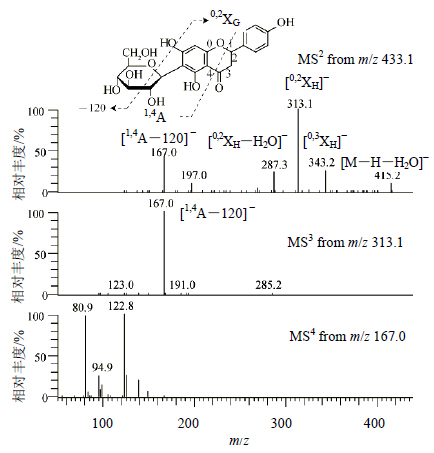 |
图 3 9号峰MS2、MS3和MS4的质谱图 Fig.3 MS2, MS3, and MS4 spectra of peak 9 |
相类似的,1号峰产生较高丰度的 [M-H-120]−([0,2XG]−)、[M-H-90-120]−([0,2XG] [0,3XG]−)和 [M-H-120-120]−([0,2XG] [0,2XG]−),提示结构中存在C-二葡萄糖取代。实验中观察到在MS3中存在m/z 209.0([1,4A-120-120]−)、m/z 239.1([1,4A-120-90]−)和m/z 329.2([1,4A-120]−),进一步证实了双葡萄糖碳苷的结构。因此,1号峰被鉴定为柚皮素-6,8-C-二葡萄糖苷。
4号和6号色谱峰产生了m/z 565.153 0(C26H29O14)的去质子峰。MS2中产生高丰度的m/z [M-H-90]−([0,3XG]−/[0,2XP]−)、[M-H-120]−([0,2XG]−/[0,1XP]−)、[M-H-150]−([(0,3XG) (0,3XP)]−/ [0,1XG]−)、[M-H-90-90]−([(0,3XG) (0,2XP)]−)、[M-H-120-90]−([(0,2XG)(0,2XP)]−)、[1,4A-90-120]−(m/z 209.1)、[1,4A-90-90]−(m/z 239.2)和 [1,4A-150]−(m/z 269.2),提示该化合物可能为葡萄糖和戊糖取代的双糖黄烷酮碳苷。Viktoria等[10]指出8-C-己糖同分异构体出峰时间比相应的6-C-己糖同分异构体出峰早。因此,推测4号峰为柚皮素6-C-戊糖-8-C-葡萄糖苷,6号峰为柚皮素6-C-葡萄糖- 8-C-戊糖苷。
3.4 二氢查耳酮碳苷的结构鉴定13号峰在高分辨质谱中产生m/z 581.184 1(C27H33O14)的去质子峰。根据分子式,推测其结构中含有双糖取代。根据不饱和度,推测26号色谱峰的苷元为二氢查尔酮。MS2中碎片离子m/z 461.2([0,2XG]−)、m/z 299.2([0,2XG-162]−)以及MS3中的m/z 166.9([A-120-162]−)提示O-葡萄糖-C-葡萄糖苷。由此,推测13号峰为2′,4′-二羟基二氢查耳酮-3′-C-葡萄糖-6′-O-葡萄糖苷(图 4)。
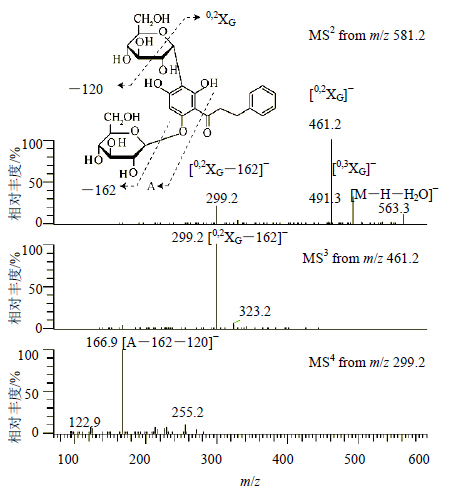 |
图 4 13号峰MS2、MS3和MS4的质谱图 Fig.4 MS2, MS3, and MS4 spectra of peak 13 |
黄酮碳苷作为黄酮家族的一个类型具有广泛的药理活性,受到研究者越来越多的关注。黄酮碳苷在质谱中特殊的碎裂规律使得能够将其与氧苷和黄酮苷元区分开。本研究通过建立高通量的UPLC/LTQ-Orbitrap-MS的方法,成功地筛选出黄芩中19个黄酮碳苷的结构,包括2个单糖黄酮碳苷、11个双糖黄酮碳苷、1个氧苷-碳苷黄酮、4个黄烷酮碳苷和1个二氢查耳酮碳苷。另外,本研究通过比对MS2、MS3和MS4谱图中碎片离子的丰度对其中的同分异构体进行区分。本实验的研究结果能够为复杂中药体系中其他黄酮类结构的表征分析提供参考。
| [1] | Hsieh P W, Chang F R, Lee K H, et al. A new anti-HIV alkaloid, drymaritin, and a new C-glycoside flavonoid, diandraflavone, from Drymaria diandra[J]. J Nat Prod, 2004, 67(7): 1175-1177. |
| [2] | Talhi O, Silva S A M. Advances in C-glycosyl-flavonoid research[J]. Curr Org Chem, 2012, 16(7): 859-896. |
| [3] | 龚金炎, 吴晓琴, 张 英. 酮碳苷及其活性研究进展[J]. 解放军药学学报, 2005, 21(2): 135-138. |
| [4] | Liu G Z, Ma J Y, Chen Y Z, et al. Investigation of flavonoid profile of Scutellaria bacalensis Georgi by high performance liquid chromatography with diode array detection and electrospray ion trap mass spectrometry[J]. J Chromatogr A, 2009, 1216(23): 4809-4814. |
| [5] | Wang H L, Cao J, Xu S Q, et al. Depletion of high-abundance flavonoids by metal complexation and identification of low-abundance flavonoids in Scutellaria baicalensis Georgi[J]. J Chromatogr A, 2013, 1315(8): 107-117. |
| [6] | Ferreres F, Silva B M, Andrade P B, et al. Approach to the study of C-glycosyl flavones by ion trap HPLC-PAD-ESI/MS/MS: application to seeds of quince (Cydonia oblonga)[J]. Phytochem Anal, 2003, 14(6): 352-359. |
| [7] | Guo X F, Yue Y D, Tang F, et al. A comparison of C-glycosidic flavonoid isomers by electrospray ionization quadrupole time-of-flight tandem mass spectrometry in negative and positive ion mode[J]. Int J Mass Spectrom, 2013, 333(1): 59-66. |
| [8] | Li Q M, van den Heuvel H, Delorenzo O, et al. Mass spectral characterization of C-glycosidic flavonoids isolated from a medicinal plant (Passiflora incarnata)[J]. J Chromatogr B, 1991, 562(1/2): 435-446. |
| [9] | Cuyckens F, Claeys M. Mass spectrometry in the structural analysis of flavonoids[J]. J Mass Spectrom, 2004, 39(1): 1-15. |
| [10] | Vukics V, Ringer T, Kery A, et al. Analysis of heartsease (Viola tricolor L.) flavonoid glycosides by micro-liquid chromatography coupled to multistage mass spectrometry[J]. J Chromatogr A, 2008, 1206(1): 11-20. |
 2015, Vol. 46
2015, Vol. 46


