2. 北华大学林学院, 吉林 吉林 132013
2. Colleg of Forestry, Beihua University, Jilin 132013, China
植物内生细菌与表生细菌相比,由于其定殖在植物内部,不会受到外界不良环境的干扰,处于更有利的生态环境中[1]。有益的内生细菌能够促进植物的生长、提高植物抵抗病虫害能力[2]。内生细菌与宿主植物共同进化,形成了互惠互利的相互关系。研究二者关系的核心问题在于揭示出内生细菌对植物体侵染定殖的规律。
本课题组已从健康五味子Schisandra chinensis (Turcz.) Baill中分离出大量内生细菌,通过对植物病原真菌的抑菌作用及室内防病实验,筛选出具有拮抗活性的内生细菌[3],JYg07是其中一株拮抗活性较强的菌株。本研究主要目的在于明确JYg07对五味子的侵染方式及其在五味子植物体内定殖的规律,为阐明内生细菌与五味子植株的相互作用机制,为今后有益内生菌的推广应用提供有效的理论依据及数据参考,从而推动高效生防菌剂的开发与应用。
1 材料 1.1 供试植物五味子植株由吉林农业科技学院左家药植园提供,经吉林农业大学高洁教授鉴定为木兰科植物五味子Schisandra chinensis (Turcz.) Baill。
1.2 供试菌种内生细菌Bacillus thuringiensis(JYg07)由北华大学林木病理实验室分离得到。五味子茎基腐病菌Fusarium oxysporum Schlecht由吉林农业科技学院范文忠教授提供。
1.3 抗生素以95%乙醇配制成质量浓度为10 mg/mL的利福平(批号H22022062,吉林隆泰制药集团有限责任公司)母液。以蒸馏水配制成质量浓度为100 mg/mL的链霉素母液。
1.4 供试培养基培养内生细菌采用牛肉膏蛋白胨培养基(NA),培养病原菌用马铃薯蔗糖培养基(PDA),液体培养采用为不加入琼脂的NA培养基(NB)。
上述培养基均在0.1 MPa、121 ℃的条件下灭菌30 min,检查无菌后使用。
2 方法 2.1 内生拮抗菌JYg07的抗药性突变体筛选将JYg07菌株在NA平板上进行活化,待长出菌落后,挑取菌落接种于NB培养液中,在28 ℃、180 r/min的振荡培养箱中培养至对数生长期,加入链霉素母液,使链霉素在培养液中的质量浓度为10 μg/mL,继续在同样的条件下振荡培养,过夜后,取适量菌液涂布在含有相同浓度链霉素的平板上,如有菌落长出,则从培养液中取出1 mL转移至含有20 μg/mL链霉素的NB培养液中,继续振荡培养,等到培养液出现浑浊,再取1 mL培养液转入含有40 μg/mL链霉素的NB培养液中,继续重复上述实验过程,直至链霉素浓度达到100 μg/mL,即获得了抗100 μg/mL链霉素的变异菌株。
将具有链霉素抗性的菌株继续进行菌株对利福平抗药性的筛选。实验方法同上,逐步筛选,利福平的最终质量浓度300 μg/mL,最终筛选出抗100 μg/mL链霉素、300 μg/mL利福平的JYg07双抗突变体菌株(标记菌株),命名为JYg07SR。
2.2 JYg07SR的稳定性检测为保证JYg07SR的抗药性稳定,将JYg07SR在含有相应浓度2种抗生素的NA培养基平板上划线培养,待长出菌落后,挑选与原来菌株相同的菌落纯化。纯化后的菌株置于4 ℃下保存7 d后,接种在不含抗生素的NA培养基平板上培养,至菌落长出,再将次菌落接种到含2种相应质量浓度抗生素的NA平板上培养,观察菌株的生长情况,重复3次,若菌株能稳定生长,就证明其抗药性稳定。将生长的菌株划线纯化后保存。
2.3 JYg07SR的抑菌作用测定将五味子茎基腐病菌F. oxysporum斜面保存菌种转移至PDA培养基平板中,28 ℃培养72 h后,在与中央等距离的3个点上分别接种JYg07自然菌株、标记菌株、回收菌株(标记菌株入侵植物体后,回收得到),重复3次实验,以不接种待测内生细菌为对照,观察抑菌性。
2.4 抗生素标记菌株JYg07SR在五味子体内的定殖和消长动态 2.4.1 标记菌株JYg07SR菌悬液的制备将保存于4 ℃的双抗药性菌株JYg07SR接种到含链霉素(100 μg/mL)和利福平(300 μg/mL)的NB培养液中,在28 ℃、180 r/min条件下振荡培养24 h,将培养液离心(3 000 r/min,10 min),弃去上清液保留沉淀,加入无菌水,将沉淀稀释,然后通过平板菌落计数法测定菌液的浓度(达到1×108 cfu/mL),备用。
2.4.2 内生拮抗菌JYg07 SR的入侵途径细菌进入植物的方式主要是通过自然孔口和伤口,为测定内生细菌进入五味子植株的途径,采用灌根接种法、喷雾接种法、注射接种法和刺伤叶片接种法4种方法接种标记菌株JYg07SR,每处理设3次重复,每重复10钵,每钵1株五味子,以无菌水为对照。
(1)灌根接种法:取10 mL浓度为1×108 cfu/mL的JYg07SR培养液浇灌在五味子根部。
(2)喷雾接种法:将浓度为1×108 cfu/mL的JYg07SR培养液加入喷雾器中,对五味子叶面进行喷雾直至叶面滴水,然后保湿24 h。
(3)注射接种法:用无菌注射器吸取浓度为1×108 cfu/mL的JYg07SR培养液,然后注射到五味子茎部,0.5 mL/株。
(4)刺伤叶片接种法:用灭菌的接种针将五味子叶片刺伤,以无菌脱脂蘸取浓度为1×108 cfu/mL的JYg07SR培养液反复多次涂抹叶片,然后套袋保湿24 h。
2.4.3 双抗标记菌株JYg07SR的分离回收在接种15 d时进行取样(供试五味子的根、茎、叶),将不同接种方式取得的五味子根、茎、叶经表面消毒后加入无菌水中,经充分研磨后静置10 min,取上清液涂布于含有链霉素(100 μg/mL)和利福平(300 μg/mL)的NA平板上,以涂布不加抗生素的NA平板为对照,28 ℃培养3~5 d,长出菌落后计数,每个处理重复3次取平均值,并进行菌落形态、染色观察及抑菌性测定,以确保回收的菌株就是接种的双抗标记菌株。
2.4.4 标记菌株在根际土壤中的消长动态观察在灌根接种法,分别于1、3、6、9、12、15、20、25、30 d对根际土壤取样,按“2.4.3”项中方法回收标记菌株JYg07SR,测定菌株在根际土壤中的定殖情况。
2.4.5 以不同浓度标记菌株培养液接种的定殖动态观察将标记菌株JYg07SR菌悬液分别稀释10、100、1 000倍,以20 mL原液、稀释液分别浇灌在五味子根部,每处理重复3次,每重复10钵,每30天对供试五味子取样,回收标记菌株JYg07SR,测定不同菌液浓度下JYg07SR在五味子植株内的定殖动态情况。
2.4.6 不同接种方法下标记菌株的定殖动态观察根据“2.4.3”项方法,在接种1、3、6、9、12、15、20、25、30 d 时对五味子根、茎和叶取样,测定出不同接种方法下JYg07SR在五味子植株内的定殖动态情况。
3 结果与分析 3.1 标记菌株的稳定性通过对获得的双抗突变菌株JYg07SR培养性状、革兰氏染色,标记菌株与自然菌株一致(图 1)。JYg07SR在不含抗生素的NA培养基上多次传代后,仍可以在含有链霉素(100 μg/mL)和利福平(300 μg/mL)的NA培养基上正常生长,这样就可以证实筛选出来的双抗标记菌株JYg07SR是可以稳定遗传和生长的,可用于其在五味子体内定殖动态的检测。
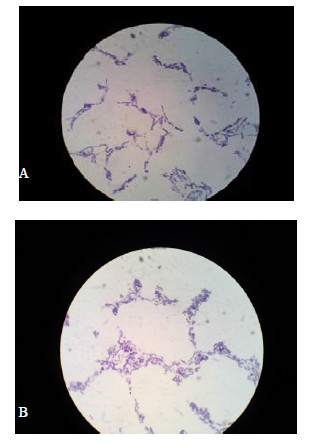 | 图 1 在显微镜下观察到的JYg07自然菌株 (A) 和标记菌株 (B)Fig.1 Electron micrographs of natural (A) and marked (B) strains of JYg07 |
整个回收标记菌的过程中,在对照处理的平板上均未分离到任何菌株,且回收的菌株在形态上与原始自然菌株一致。同时自然菌株、标记菌株和回收菌株的平板抑菌实验表明(图 2),标记菌株、回收菌株具有与原始自然菌株对五味子茎基腐病菌F. oxysporum相似的抑菌活性,差异不明显。这样进一步证明利用抗生素标记的菌株进行定殖研究,结果可靠。
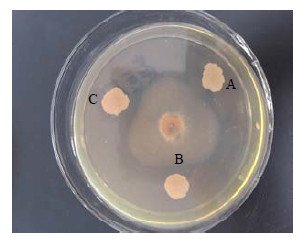 |
A-自然菌株 B-标记菌株 C-回收菌株 A-natural strain B-marked strain C-redemptory strain 图 2 JYg07自然、标记与回收菌株的菌落形态和抑菌作用 Fig.2 Colonial morphology and inhibitory effect of natural, marked, and redemptory strains of JYg07 |
利用4种接种方法将标记菌株接种到五味子体内,15 d时,从接种的五味子根、茎、叶中均回收到标记菌株,而对照(未接种标记菌株的五味子)则没有标记菌株。因此可以判断出菌株JYg07SR可以通过自然孔口和伤口2种途径入侵到五味子体内,并且可以从入侵部位向其他组织传导(表 1)。
| 表 1 标记菌在不同入侵途径下的回收情况 Table 1 Recovery of marked strains in different invasion pathways |
不同的接种方式在根、茎、叶中回收的菌量有差异。灌根接种后,根中回收的菌量最多7.43×103 cfu/g;用喷雾接种法,叶片中回收的菌量最多,5.32×103 cfu/g;用注射接种法,茎中回收的菌量最多,10.27×103 cfu/g;而刺伤叶片接种法,叶片中回收的菌量最多,9.67×103 cfu/g。由此可见,JYg07SR在五味子植株内的分布受接种方式的影响较大。
3.4 标记菌株JYg07SR在根际土壤中的定殖灌根接种实验中,将标记菌JYg07SR培养液浇灌于五味子植株根部,按设定时间分离土壤中标记菌,结果表明,在根际土壤中可以分离到标记菌,而对照土壤中未分离到,说明JYg07SR可以在土壤中长时间存活。
JYg07SR菌株均能够较好地在五味子根际土壤中定殖,随着接种时间的延长,菌量有一定的波动,呈平缓减少趋势。接种l d后,在根际土壤中的初始菌量较大,为3.8×107 cfu/g。由图 3可知,接种3 d后,菌量开始出现大幅度下降,由107量级下降到了105个量级,3~12 d菌量趋于平稳,随后菌量逐渐减少,到30 d,仍有一定量的标记菌存在。说明JYg07SR菌株能够在土壤中长期存活。
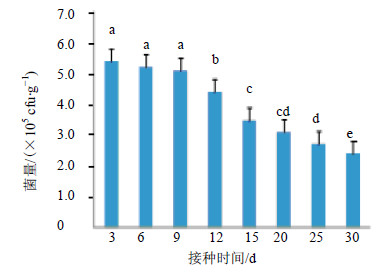 |
不同字母表示差异显著 P<0.05 Different small letters are significantly different at 0.05 level P < 0.05 图 3 灌根接种JYg07SR在五味子根际土壤中的定殖 Fig.3 Colonization of irrigation and inoculation strains JYg07SR in rhizosphere soil of S. chinensis |
利用灌根接种法测试了不同浓度菌液下,JYg07SR菌株在五味子根、茎、叶中的定殖动态变化,结果表明(图 4),菌液稀释倍数对菌株定殖有影响,菌液稀释倍数小,在各组织不同时间里回收到的菌量也相对较多,差异显著。接种12 d后4个稀释倍数回收的菌量均高于第1天,说明4个稀释倍数的菌液都能在五味子植株内定殖并传导。JYg07SR菌株原液和稀释10倍菌液接种第9天在根中定殖数量达到最大,稀释100、1000倍的菌液接种第12天定殖数量达到最大,然后逐渐下降。
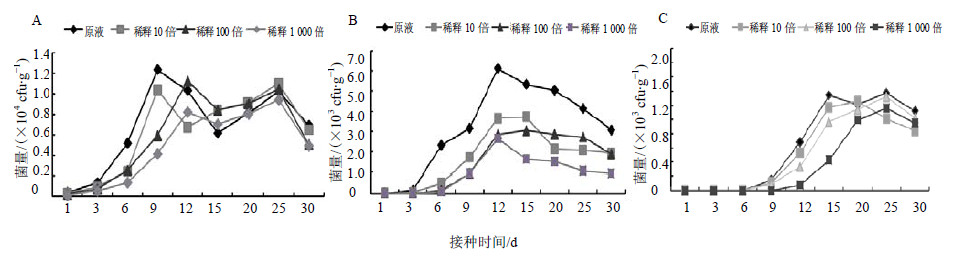 | 图 4 不同接种稀释倍数下标记菌JYg07SR在五味子根 (A)、茎 (B) 和叶 (C) 的定殖动态 Fig.4 Colonization dynamics of marked strains cultured by different inoculation dilution multiple in plants of S. chinensis |
因此,菌液浓度对标记菌定殖的影响主要是定殖高峰出现时间的影响,菌液浓度高,定殖高峰会提前,菌液浓度低,则会推迟定殖高峰的到来。此次实验结果根中定殖数量远远大于茎、叶中的定殖数量,可能与接种方式有关,灌根接种会使标记菌最先侵入根部,然后向上传导。
3.6 不同接种条件下JYg07SR菌株在五味子体内的定殖 3.6.1 灌根接种通过灌根接种,在五味子根、茎、叶组织中均可以回收到JYg07SR菌株,并且根中回收到的菌株数量高于茎、叶中的菌株数量(图 5)。在接种后第9天,根内菌量为1.224×104 cfu/g,达到最高点;茎内菌量在第12天达到最高点6.12×103 cfu/g,叶中菌量在第15天最多,为1.34×103 cfu/g。30 d时,根中的菌量远高于茎和叶中的菌量。
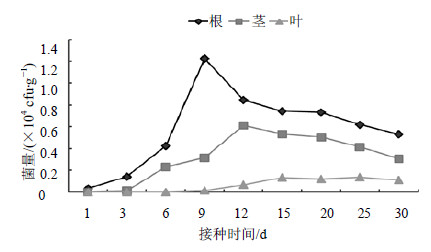 | 图 5 灌根接种法JYg07SR在五味子内的定殖动态Fig.5 Colonization dynamics of strains JYg07SR cultured by irrigation and inoculation method in plants of S. chinensis |
将JYg07SR菌株喷雾接种到五味子植株上,1 d后均未检测到定殖菌株,从第3天开始最先在叶片中回收到标记菌,然后是茎,最后是根,说明标记菌能够从叶片入侵,向其他组织扩展(图 6)。
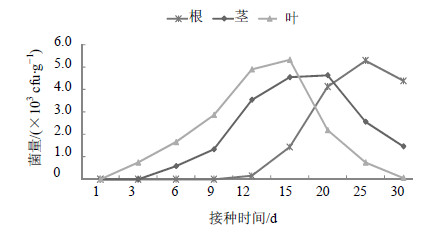 | 图 6 喷雾接种法JYg07SR在五味子内的定殖动态Fig.6 Colonization dynamics of strains JYg07SR by spraying leaves in plants of S. chinensis |
JYg07SR菌株接种第3天在叶中回收到,第6天在茎中回收到,第12天在根中回收到,并且出现定殖高峰的时间上也同样,叶出现高峰的时间(15 d)要比根(25 d)和茎(20 d)要早,根和叶中菌量高峰值相近分别为5.29×103和5.32×103 cfu/g。到第30天时,根中的菌量要大于茎和叶中的菌量。
3.6.3 注射接种将JYg07SR菌株注射到五味子茎中,初期茎内菌量远远高于其他接种方式,随着时间的延迟,菌量逐渐减少,根和叶中的菌量缓慢增加,比较平缓,以茎中注射菌液,菌体可以定殖在五味子体内,并可以由茎向根、叶扩展(图 7)。接种后第1天茎中菌量较高,为2.048×104 cfu/g,然后逐步下降,到第12天又有所增长,随后平稳降低。在根中,第6天开始出现标记菌株,在12 d和20 d有2个高峰,分别为7.62×103 cfu/g和8.42×103 cfu/g,到30 d时,根与茎中的菌量接近,高于叶中的菌量。
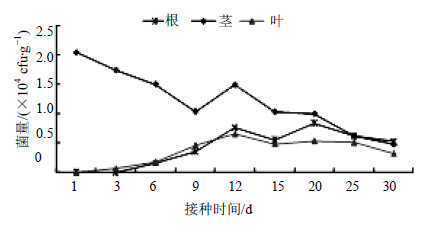 | 图 7 注射接种法JYg07SR在五味子内的定殖动态Fig.7 Colonization dynamics of strains JYg07SR cultured by injection inoculation in plants of S. chinensis |
刺伤叶片接种后,根、茎、叶中均可回收到JYg07SR菌株,并且叶中的菌量显著高于根和茎中的菌量,并呈递减趋势,接种1 d后菌量最多,为1.375×104cfu/g(图 8)。根、茎中的菌量呈由低到高再降低的趋势,接种第12天后,根内才分离到JYg07SR菌株,菌量始终处于较低水平,第20天达到最高峰菌量为4.16×103 cfu/g。接种第6天茎中回收到JYg07SR菌株,在茎中菌量最高峰在第15天,为4.63×103 cfu/g。到30 d时,根与茎中的菌量接近,略低于叶中的菌量。
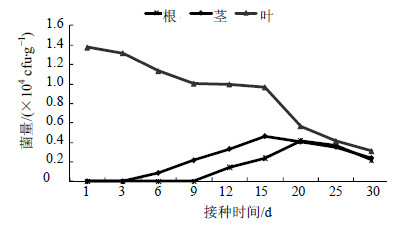 | 图 8 刺伤叶片接种法JYg07SR在五味子内的定殖动态Fig.8 Colonization dynamics of strains JYg07SR cultured by via pin-puncturing leaves in plants of S. chinensis |
综合4种接种方式所得结果,4种方式的菌株JYg07SR都可以进入五味子体内并定殖,且定殖的量没有数量级上的差别,因此采用操作简便、对植物没有伤害的灌根接种法是最佳的选择,同时可以获得较高的定殖菌量。
4 讨论多数学者认为内生细菌是通过自然孔口(气孔、水孔、皮孔等)和伤口(自身形成或外力造成)等途径进入植物体[4]。本实验采用灌根、喷雾、注射、刺伤4种方式接种抗生素标记菌株JYg07SR,每种接种方式均可以在五味子体内回收到标记菌株,说明分离到的内生拮抗细菌可以通过自然孔口和伤口入侵五味子体内。王瑞芹[5]在研究油茶内生细菌时,也证实分离到的内生拮抗细菌Y13通过自然孔口和伤口入侵到油茶体内。
内生拮抗细菌能否在植物体内稳定定殖,是影响其发挥生防作用的关键问题。黄勤知等[6]利用灌根和涂叶法证实了红树内生细菌AiL3能够在大豆体内的稳定定殖。胡伟等[7]从大豆中分离出一株能够防治香蕉枯萎病的生防菌,并利用灌根法证实抗生素标记菌株AF11Rif能定殖在香蕉的根和茎内。本实验分别采用不同接种浓度和不同接种方法对JYg07SR标记菌株在五味子体内定殖情况进行长达30 d的监测,结果显示,不论哪种方式,JYg07SR都可以在五味子体内稳定定殖,在根内的定殖能力大于茎和叶。接种方式直接影响定殖高峰出现的时间,采用灌根接种,定殖高峰在第6~12天,喷雾接种在第15~25天,注射和刺伤叶片法接种,叶片的定殖高峰在第1天,根和茎则要延迟到第15~25天,说明采用造成伤口的接种方式定殖菌量更高一些。但在实际生产中,伤口会增加病原菌的侵入途径,因此采用灌根的接种更为可靠,并且获得菌量最稳定持久,接种的菌液在土壤中还能长期存活,保证了根中内生菌的数量。接种不同稀释倍数的菌液,均能在五味子不同的部位分离到标记菌,定殖数量也能保持在较高水平上,说明菌液浓度对定殖的影响不大。菌液稀释倍数越小,在各组织中回收到的菌量也相对较多,达到定殖高峰的时间也较短。因此,在实际生产中,通过灌根的方式接种较高浓度的菌液是获得生防菌在五味子体内稳定定殖的最佳方式。
通过不同接种方法,无论是在五味子植株的哪一个部位接种,在接种后,都会在其他的部位分离到标记菌株,说明内生细菌进入植物体后,不是静止不动的,而是要向植物体内的不同组织转移。杨海莲等[8]证明了水稻内生阴沟肠杆菌能在宿主不同组织中广泛定殖,不仅能在根细胞间定殖,也能在根细胞内定殖。马同锁等[9]在辣椒叶片上接种内生细菌TS-3后发现,TS-3能够从接种的叶片向其他部位传导。
抗药性标记法存在一定的局限性,不能明确拮抗菌株进入宿主的动态过程、侵入的主要位点及传导途径。因此,还需要进一步利用基因标记并结合聚焦显微镜来更直观地揭示出内生拮抗细菌在五味子体内的定殖规律,这还有待于进一步研究。
本研究阐明了内生拮抗菌JYg07在五味子体内的定殖规律,并确定了其内生性,实验结果表明了内生拮抗菌JYg07能够在五味子的体内转移、传导,为开展利用内生拮抗菌株JYg07对五味子病害的生物防治提供了理论依据。
| [1] | 罗茗月, 路雪君, 廖晓兰. 植物内生细菌的应用研究进展 [J]. 现代农业科技, 2010(7): 11-12. |
| [2] | 韩继刚, 宋 未. 植物内生细菌研究进展及其应用潜力 [J]. 自然科学进展, 2004, 14(4): 374-379. |
| [3] | 金 岩, 孙晶波, 高 洁. 五味子中内生拮抗活性细菌的分离与筛选 [J]. 中草药, 2014, 45(7): 996-1001. |
| [4] | Mocali S, Bertelli E, Cello F D, et al. Fluctuation of bacteria isolated from elm tissues during different seasons and from different plant organs [J]. Res Micro, 2003, 154(2): 105-114. |
| [5] | 王瑞芹. 油茶内生拮抗细菌Y13定殖动态及对叶内微生物调整效应研究 [D]. 长沙: 中南林业科技大学, 2014. |
| [6] | 黄勤知, 卢乃会, 何 红, 等. 红树内生细菌AiL3在大豆体内的定殖与促生作用研究 [J]. 大豆科学, 2014, 33(2): 223-227. |
| [7] | 胡 伟, 赵兰凤, 张 亮, 等. 香蕉枯萎病生防菌AF11的鉴定及其定殖研究 [J]. 中国生物防治学报, 2013, 28(3): 387-393. |
| [8] | 杨海莲, 孙晓璐, 宋 未. 水稻内生阴沟肠杆菌的定殖研究 [J]. 自然科学进展, 1999, 9(12): 1241-1244. |
| [9] | 马同锁, 袁红楼, 赵士豪, 等. 不同处理方法对内生细菌TS-3在2种蔬菜体内定殖的影响 [J]. 安徽农业科学, 2013, 41(27): 11013-11015. |
 2015, Vol. 46
2015, Vol. 46


