神经毒素(NT)是眼镜蛇毒的主要成分之一。因其具有良好的中枢镇痛作用,无耐受性和依赖性,安全性高,临床上主要以肌肉注射方式用于镇痛和戒毒[1]。但由于其相对分子质量较大(约6 700),脂溶性小,不易透过血脑屏障(blood-brain barrier,BBB),起效缓慢,故在一定程度限制了其临床应用。纳米粒(nanoparticles,NPs)被认为是脑内药物传递系统的良好载体,具有缓释、保护药物的作用。鼻腔给药可以实现脑靶向给药,但鼻腔黏膜吸收能力十分有限,需要加入吸收促进剂以促进鼻黏膜对药物载体的吸收[2]。
前期研究发现,经聚山梨醇-80(polysorbate-80,P-80)表面修饰的神经毒素纳米粒(P-80-NT-NP)经鼻腔给药后可快速入脑,脑内消除相明显延长,通过抑制脑微毛细血管内皮细胞高效的外排泵作用,尤其能抑制具有外排作用的P-糖蛋白(P-gp)的活性,从而提高脑内药物浓度,该研究成果表明以P-80修饰的NPs为载体经鼻腔给药,是实现肽类大分子入脑的有效途径[3, 4]。本研究采用异硫氰酸荧光素(FITC)标记的方法,观察FITC标记的P-80-NT-NP在大鼠体内的分布,旨在研究表面P-80修饰后纳米递药系统在血浆、脑、心、肝、脾、肺、肾中的代谢和分布,为神经毒素新剂型的开发应用提供依据。
1 材料 1.1 仪器和试剂神经毒素由上海紫一试剂厂提供,质量分数>99%,批号ZY130114;FITC购自美国Sigma公司;聚氰基丙烯酸正丁酯由北京康派特医疗器械有限公司提供;泊洛沙姆和右旋糖苷购自德国BASF公司;P-80购自上海山浦化工有限公司;其他试剂均为国产分析纯。
岛津RF-5000型荧光分光光度计(日本岛津公司);380 ZLS激光粒度测定仪/Zeta电位仪(美国NICOMP公司);FHS-2A可调高速匀浆机(金坛市宏华仪器厂);TJ-25低温高速冷冻离心机(Beekman Coulter公司);大鼠鼻黏膜给药装置(浙江省中药制剂工程中心)。
1.2 实验动物清洁级SD大鼠,雌雄各半,体质量279~290 g,由浙江中医药大学实验动物中心提供,合格证号SCXK(沪)2007-0005。动物室每天灯光照明12 h,通风和空调设备良好,室温控制在(23±1)℃,相对湿度为50%~70%。实验室按常规定期消毒。
2 方法 2.1 动物分组与处理取40只SD大鼠,取4只以生理盐水给药作为空白对照组:用于制备空白血浆和组织样品,其余36只随机分为2组(每组18只):P-80-NT-NP组和神经毒素纳米粒(NT-NP)组,以鼻腔给药装置[5]经鼻腔给药。给药前大鼠禁食10 h,自由饮水。
2.2 药物的制备[6]称取泊洛沙姆Pluronic-68和稳定剂右旋糖苷-70各150 mg,加蒸馏水25 mL溶解,加入FITC标记的NT(FITC-NT)溶液(1 mg/mL)60 μL,调节pH值至2.0,缓慢加入聚氰基丙烯酸正丁酯(PBCA) 60 μL,匀速搅拌2 h(800 r/min),调节pH值至7.0,滤过,定容,得NT-NP胶体溶液,加入适量P-80搅拌,37 ℃恒温箱中孵化1 h,超速离心30 min(40 000 r/min),去除多余P-80,冻干,即得P-80-NT-NP。
2.3 理化性质考察 2.3.1 形态将经FITC标记的P-80-NT-NP胶体溶液,滴于覆盖碳膜的铜网上,用磷钨酸溶液钠负染,室温放置至形成薄膜后用透射电子显微镜观察其形态,并拍摄照片。
2.3.2 Zeta电位和平均粒径将经FITC标记的P-80-NT-NP胶体溶液,用Zeta电位/粒度分布仪测定Zeta电位、平均粒径及多分散系数(PDI)。
2.3.3 包封率取P-80-NT-NP胶体溶液,超速离心30 min(40 000 r/min),取上清液,采用荧光分光光度法,选择λex=488 nm作为激发波长,于发射波长520 nm处读取FITC标记的P-80-NT-NP溶液的荧光强度值,激发光谱的狭缝宽度为5 nm,发射光谱的狭缝宽度为10 nm。以荧光强度值换算其中所含NT的量,按下列公式计算纳米粒的包封率和载药量。
包封率=(C0-C1)/C0
载药量=(C0-C1)/M
C0为投入NT的初始浓度,C1为离心后NT的浓度,M为冻干后的纳米粒的质量与胶体溶液的体积的比值
2.4 NT标准曲线精密称取恒温下干燥至恒定质量的FITC-NT,配制1 mg/mL的储备液;再以甲醇进行梯度稀释,制备质量浓度分别为500、250、100、50、25、10、5、1 μg/mL的FITC-NT对照品溶液。分别精密吸取空白血浆100 μL或组织(脑、心、肝、脾、肺、肾)匀浆样品300 μL,根据不同标准曲线的浓度范围,分别加入不同质量浓度的FITC-NT对照品溶液100 μL,制成一系列质量浓度的模拟生物样品,分别加入甲醇100 μL,漩涡混匀。加入醋酸乙酯涡旋提取后,吸取有机层,氮气吹干。残渣用200 μL甲醇溶解,涡旋混匀,1.2×104 r/min 离心5 min,取上清液100 μL,加入96孔板,用荧光分光光度计测定荧光强度,设置FITC的激发波长488 nm,发射波长520 nm。以质量浓度为横坐标(X),荧光强度值为纵坐标(Y),用加权(W=1/x2)最小二乘法进行回归运算,求得直线方程,即为NT标准曲线。
2.5 组织分布研究[7]除对照组外,给药时将清醒大鼠半仰位固定在大鼠鼻黏膜给药装置上,将PE-10管插入大鼠右侧鼻腔约15 mm,使用有柔软PE-10管的微量泵给药(NT剂量为60 μg/kg)。分别于给药后5、15、30、60、120、240 min这6个时间点,每个时间点3只大鼠,分批断头处死,采集血样,并收集脑、心、肝、脾、肺、肾等组织。血样静置离心(1×104 r/min,5 min)得血浆,于−20 ℃保存备用。其余的组织样品,用生理盐水冲洗表面血污后,用滤纸吸干各组织表面残血并称质量,按质量与体积比为1∶2加生理盐水,制备成匀浆。精密吸取大鼠血浆100 μL或组织(脑、心、肝、脾、肺、肾)匀浆样品300 μL,分别加入甲醇100 μL,涡旋混匀。加入醋酸乙酯涡旋提取后,吸取有机层,氮气吹干。残渣用200 μL甲醇溶解,涡旋混匀,1.2×104 r/min 离心5 min,取上清液100 μL,加入96孔板,用荧光分光光度计测定荧光强度。根据荧光强度,按标准曲线方程求出NT在血浆或各个组织中的质量浓度。所有统计的实验数据以x±s表示,组间比较采用t检验。
3 结果 3.1 P-80-NT-NP的理化性质FITC标记的P-80-NT-NPs在电镜下观察呈圆球形,表面光滑,大小均匀(图 1)。测得的平均粒径为(73.4±9.8)nm,Zeta电位为(−18.2±5.4)mV,包封率为(74.0±6.3)%,载药量(0.119±0.030)%。
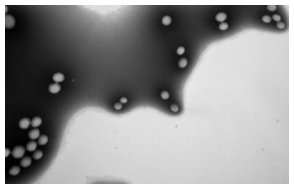 | 图 1 P-80-NT-NP 电镜图 Fig.1 TEM photograghs of P-80-NT-NP |
按照“2.4”项方法计算得到不同生物样品中NT的标准曲线,空白生物样品荧光强度与药物质量浓度成良好的线性关系,见表 1。
| 表 1 不同生物样品中NT的标准曲线 Table 1 Standard curves of NT in different biological samples |
P-80-NT-NP和NT-NP经鼻腔黏膜给药120 min后在大鼠各组织分布情况见图 2,P-80-NT-NP和NT-NP在血浆、心、肝、脾、肺、肾和脑中均有分布。P-80-NT-NP给药组血浆、脑中NT的质量浓度高于NT-NP组,而在肝组织中低于NT-NP组,差异均显著(P<0.05)。P-80-NT-NP鼻黏膜给药,脑中NT质量浓度为(0.236±0.100)μg/mL,NT-NP鼻黏膜给药,脑中NT质量浓度为(0.158±0.070)μg/mL,两组间比较差异显著(P<0.05)。
 | 图 2 P-80-NT-NP 和 NT-NP 鼻腔黏膜给药 120 min 药物在大鼠各组织分布情况 Fig.2 Tissue distribution of P-80-NT-NP and NT-NP after 120 min of administration in rats |
P-80-NT-NP经鼻腔黏膜给药后5、15、30、60、120、240 min 6个时间点药物在大鼠各组织分布情况见图 3。结果表明P-80-NT-NP在脑、心、肝、脾、肺、肾各组织中均有分布,其中以肝组织中分布最高,肾组织其次。肺、脑、肝、脾组织中,NT质量浓度5 min即达到峰值,而在肾、心组织中15 min达到峰值,之后随时间逐渐下降。NT-NP给药后药物在各组织中质量浓度变化趋势与P-80-NT-NP相似。
 | 图 3 P-80-NT-NP 给药后不同时间点药物在大鼠体内组织分布 Fig.3 Tissue distribution of P-80-NT-NP in rats at different time points after administration |
P-80-NT-NP在脑、心、肝、脾、肺、肾各组织中均有分布,P-80-NT-NP在血浆和各组织的质量浓度从高到低依次为血浆>肝>肾>脾>肺>心>脑。脑、肝、肺和脾在P-80-NT-NP给药5 min后达到药物浓度最高值,心、肾在给药15 min后达到最高值,然后迅速降低,说明P-80-NT-NP的吸收、分布及消除迅速。所考察组织中NT-NP在肝中的药物量较高,与P-80-NT-NP组有显著性差异(P<0.05),提示NT-NP与肝组织亲和力较好,且在肺部消除慢。可能NT-NP经鼻腔黏膜给药后逃逸吞噬进入血液循环,载药纳米粒进入血液循环后,在调理素的作用下,被血浆蛋白、糖蛋白等多种成分吸附,随即被肝脏中网状内皮系统吞噬[8]。
大鼠体内的组织分布研究发现,P-80-NT-NP和NT-NP在肾脏中的量均较高,两组间差异无显著性(P>0.05)。推测可能是P-80-NT-NP和NT-NP降解的部分携带着多肽从组织上被重吸收到血液循环,再重新分布到各组织[9];此外肾脏可能对NT起着解毒和分泌排泄的作用。
有学者用氯胺T法标记NT,大鼠iv给予125I-NT,观察其在体内的分布情况,30 min及120 min后分布最多的均为心脏,肾脏以外的实质性脏器分布均较少,脑中分布最低[10]。经P-80修饰后,即P-80-NT-NP鼻黏膜给药120 min,脑中药物的量为(0.236±0.100)μg/mL,NT-NP组脑中药物的量显著低于P-80-NT-NP组(P<0.05)。提示P-80-NT-NP与脑组织亲和力较好,提高脑组织的靶向分布,且消除缓慢。NT-NP经P-80修饰后,BBB透过性增强,靶向至脑组织分布,使药物量显著增大,这有利于NT发挥镇痛作用。P-80修饰的NP可以将血浆中的载脂蛋白E(ApoE)或载脂蛋白B(ApoB)吸附至其表面,利用ApoE/ApoB能与脑微血管内皮细胞(BMEC)上低密度脂蛋白(LDL)受体结合的特点,借助受体介导的胞饮作用穿过BBB并直接扩散至脑内释药[11]。
综上所述,P-80-NT-NP可显著增加NT经鼻腔吸收入脑,而且消除缓慢,同时揭示了该药物经鼻腔黏膜给药入脑后,药物在大鼠体内的分布规律。本研究所使用的大鼠脑、血浆及组织内FITC-NT量的荧光分析方法简便、快速、准确,为其他大分子多肽类的药动学研究提供了方法学参考。此外,关于P-80-NT-NP如何促进鼻腔吸收入脑的分子蛋白通路尚不明确,有待进一步研究。
| [1] | Chen R Z, Wu X R. The analgesic effect of neurotoxin from cobra (Naja naja) venom [J]. Chin Pharm Bull, 1988, 4(2): 113-116 |
| [2] | 李 玲, 马海忠, 廖明琪, 等. 鼻腔给药系统类型及临床应用进展 [J]. 中国药房, 2013, 24(17): 1615-1617. |
| [3] | Sun W Q, Xie C S, Wang H F, et al. Specific role of polysorbate 80 coating on the targeting of nanoparticles to the brain [J]. Biomaterials, 2004, 25(15): 3065-3071. |
| [4] | Cheng Q Y, Feng J, Li F Z. Brain delivery of neurotoxin-Iloaded nanoparticles through intranasal administration [J]. Acta Pharm Sin, 2008, 43(4): 431-434. |
| [5] | 赵燕敏, 夏爱晓, 魏颖慧, 等. 聚山梨酯80修饰的神经毒素纳米粒跨血脑屏障转运及细胞毒性 [J]. 药学学报, 2010, 45(10): 1312-1316. |
| [6] | 李范珠. 啮齿类动物鼻腔给药装置: 中国专利, 200520013525.5 [P]. 2007-03-28. |
| [7] | 徐陆中, 赵燕敏, 潘越芳, 等. 神经毒素纳米粒的制备及在大鼠体内的组织分布 [J]. 中国医院药学杂志, 2010, 30(17): 1425-1428. |
| [8] | 宋大千, 王 炎, 李 琦. 中药纳米粒靶向给药系统的研究进展 [J]. 中国实验方剂学杂志, 2014, 20(8): 241-244. |
| [9] | Pieter J G, Gorine C V, Albertus G B. Targeted delivery across the blood-barrier [J]. Expert Opinion Drug Deliv, 2005, 2(2): 299-309. |
| [10] | 林丽丽, 许云禄. 眼镜蛇毒神经毒素的125I标记及其在大鼠体内的分布 [J]. 海峡药学, 2009, 21(5): 36-38. |
| [11] | Kuar I P, Bhandari R, Bhandari S, et al. Protential of solid lipid nanoparticles in brain targeting [J]. J Control Release, 2008, 127(2): 97-109. |
 2015, Vol. 46
2015, Vol. 46


