绿原酸(chlorogenic acid)是一类由奎尼酸和咖啡酸缩合而成的缩酚酸,其中5-咖啡酰奎尼酸(5-caffeoylquinic acid,5-CQA)为最主要的异构体。绿原酸是植物在有氧呼吸过程中经莽草酸代谢产生的苯丙素类物质,是人们饮食中最丰富的多酚类化合物之一,广泛存在于蔬果和中药材中,如苹果、蓝莓、金银花、杜仲等,同时也是咖啡的重要组成物质,据报道,每天喝咖啡能摄入0.5~1.0 g绿原酸[1]。
糖类是主要的供能物质,同时也是人体重要的组成成分之一,糖代谢平衡对维持生物体的基本生命活动至关重要,而骨骼肌在人体内维持糖代谢平衡和稳态起着关键作用。骨骼肌占了全身质量的50%[2],是体内葡萄糖吸收的主要部位,在胰岛素刺激下,大约75%的血糖由骨骼肌处理[3]。骨骼肌糖代谢途径中的任何损伤都有可能引起代谢疾病,尤其是肥胖和2型糖尿病。葡萄糖转运入质膜是糖代谢过程中的一个限速步骤,是维持体内糖稳态的关键。胰岛素和肌肉收缩都能通过增加细胞表面的葡萄糖转运蛋白4(glucose transporter 4,GLUT-4)水平来促进骨骼肌中葡萄糖的转运[4, 5]。
随着生活水平的提高,人们的饮食结构和生活方式有所改变,在糖摄入过量的情况下,易发生代谢紊乱,严重的情况下可能发展成2型糖尿病。大量研究表明绿原酸有抗菌、抗氧化、抗癌,尤其是降糖和调血脂等药理作用[6, 7]。据报道,每天饮用3~4杯富含绿原酸的无咖啡因咖啡能显著降低患2型糖尿病的风险[8]。王艳等[9]研究发现绿原酸能上调链脲佐菌素(streptozotocin,STZ)诱导的糖尿病大鼠骨骼肌中GLUT-4基因的表达量,提高胰岛素敏感性,下调肝脏葡萄糖-6-磷酸酶(glucose-6- phosphatase,G-6-pase)的表达,从而改善糖代谢。目前尚无文献系统报道绿原酸对骨骼肌中糖代谢信号通路及相关基因mRNA表达的影响。本实验以绿原酸干预高脂饲喂大鼠,用实时荧光定量PCR的方法测定骨骼肌中与糖代谢相关基因:蛋白激酶B(PKB,又名Akt)、磷脂酰肌醇-3激酶(PI3K)、胰岛素受体底物-1(IRS-1)、GLUT-4、蛋白激酶A(PKA)、AMP依赖的蛋白激酶(AMPK-α2)、过氧化物酶体增殖物激活受体(PPARα、PPARβ、PPARγ)的表达,以探究绿原酸对骨骼肌糖代谢的作用机制。
1 材料 1.1 实验动物SPF级雄性SD大鼠40只,体质量210~230 g,购自湖南斯莱克景达实验动物有限公司,许可证编号SCXK(湘)2011-0003。
1.2 动物饲料普通饲料及高脂饲料均由湖南斯莱克景达实验动物有限公司生产。高脂饲料配方:普通饲料65%、猪油15%、鸡蛋黄粉13%、全脂奶粉5%、白砂糖2%。
1.3 药物与试剂绿原酸(质量分数>98%),Biosharp生物科技;罗格列酮(批号121008),成都恒瑞制药有限公司;Trizol,美国Invirtrogen公司;反转录试剂盒和荧光定量PCR试剂盒购自天根生化科技有限公司。
1.4 仪器ABI2720PCR扩增仪,美国ABI公司;ABI7300 实时荧光定量PCR仪,美国ABI公司;Centrifuge5417R离心机,德国Eppencbrf公司;Nanodrop1000微量光度计,美国Nanodrop公司。
2 方法 2.1 分组与给药40只SD雄性大鼠适应性饲养1周后,随机分成5组:对照组,模型组,绿原酸高、低剂量组,罗格列酮(阳性对照)组。对照组以普通饲料喂养,其余各组以高脂饲料喂养。绿原酸高、低剂量组分别ig绿原酸90、20 mg/kg;罗格列酮组ig罗格列酮3 mg/kg;对照组和模型组则ig等体积超纯水,各组每天给药1次。实验期间定期称量体质量,药物干预12周后,解剖分离骨骼肌组织于冻存管中,经液氮快速冷冻后,保存在−80 ℃冰箱中备用。
2.2 实时荧光定量PCR法测定骨骼肌中相关基因的mRNA表达Trizol法提取骨骼肌组织中的RNA,用微量光度计检测RNA量和纯度,并通过琼脂糖凝胶电泳鉴定RNA是否降解;取1 μg RNA模板,按照反转录试剂盒说明书反转成cDNA,总反应体积为20 μL;在Genebank中找到目的基因的mRNA序列,用Primer Premier 5.0软件设计引物,由南京金斯瑞生物科技公司合成,目的基因及引物序列见表 1。以GAPDH作为内参基因,进行实时荧光定量PCR:95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸31 s,延伸步骤采集荧光信号,扩增40循环后进行溶解曲线分析。
| 表 1 目的基因引物序列 Table 1 Gene primers sequences |
数据以x±s表示,数据用SPSS 19.0软件进行统计学分析,组间差异比较采用单因素方差分析(One-way ANOVA,LSD)。
3 结果 3.1 对高脂饲喂大鼠体质量的影响由表 2可以看出,经过12周的高脂饲喂,各组大鼠体质量都有明显的增加。与对照组比较,模型组大鼠体质量增加量有所上升,但差异不显著(P>0.05);与模型组比较,绿原酸低剂量组大鼠体质量有下降的趋势,且体质量增加量也有所降低;绿原酸高剂量组大鼠最终体质量及体质量增加量均显著降低(P<0.05);罗格列酮组大鼠体质量与对照组的相近(P>0.05)。说明绿原酸能有效减缓大鼠因高脂饲料引起的体质量增加,且呈剂量依赖性,高剂量绿原酸干预后效果显著。
| 表 2 绿原酸对高脂喂饲大鼠体质量的影响 (x±s, n = 8) Table 2 Effect of chlorogenic acid on body weights of HFD rats (x±s, n = 8) |
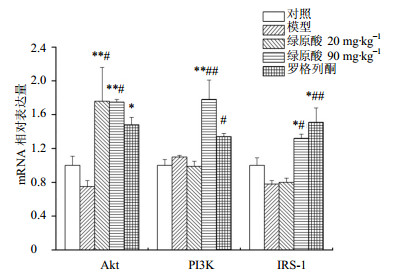
结果如图 1所示,与对照组比较,模型组Akt mRNA表达量有所下降,而绿原酸低、高剂量组Akt mRNA的表达量与对照组相比,分别上调了1.76倍和1.75倍,差异显著(P<0.05),且与模型组比较,上调非常显著(P<0.01)。模型组PI3K mRNA比对照组上调了1.1倍;绿原酸低剂量与对照组比较,无统计学差异;而绿原酸高剂量组与对照组和模型组相比分别上调了1.78倍和1.60倍,差异非常显著(P<0.01)。与对照组相比,模型组IRS-1 mRNA表达量下调了22%,绿原酸低剂量组IRS-1 mRNA水平与模型组相比,虽有所上升,但差别不大;绿原酸高剂量组与对照组和模型组相比,分别上调了1.32和1.68倍,差异显著(P<0.05)。
 |
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下同
#P < 0. 05 ##P < 0.01 vs control group; P < 0.05 **P < 0.01 vs HFD model group, same as below 图 1 绿原酸对骨骼肌中Akt、PI3K、IRS-1 mRNA表达的影响 (x±s, n = 8)Fig.1 Effects of chlorogenic acid on expression of Akt,PI3K, and IRS-1 mRNA in skeletal muscle (x±s, n = 8) |
结果如图 2所示,与对照组相比,模型组GLUT-4 mRNA表达下调了29%,差异显著(P<0.05);而绿原酸对GLUT-4 mRNA的作用呈剂量依赖性上升,绿原酸高剂量组与对照组、模型组比较,差异显著(P<0.05);罗格列酮组与对照组、绿原酸低剂量组GLUT-4 mRNA表达水平相当。模型组PKA mRNA表达量稍有降低,但差别不大;绿原酸低、高剂量组和罗格列酮组PKA mRNA的表达量分别是对照组的1.1、2.0、1.75倍,其中绿原酸高剂量组、罗格列酮组与对照组、模型组相比,差异显著(P<0.05)。模型组AMPK-α2 mRNA与对照组相比下调了29%,差异非常显著(P<0.01);与模型组相比,绿原酸低剂量组在转录水平上有所上调,且与对照组、模型组比较,差异均显著(P<0.05);绿原酸高剂量组和罗格列酮组表达水平相当,与模型组相比,分别上调了46%、51%,差异非常显著(P<0.01)。
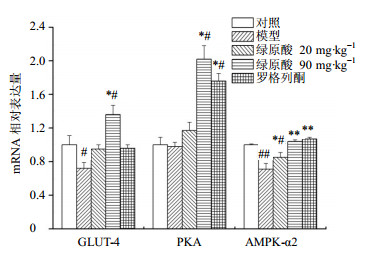 | 图 2 绿原酸对骨骼肌中GLUT-4、PKA、AMPK-α2 mRNA表达的影响 (x±s, n = 8)Fig.2 Effects of chlorogenic acid on expression of GLUT-4, PKA, and AMPK-α2 mRNA in skeletal muscle (x±s, n = 8) |
如图 3所示,模型组PPARα mRNA比对照组下调了33%;绿原酸对PPARα mRNA的影响呈剂量依赖性,绿原酸低剂量组与对照组PPARα mRNA表达在同一水平,绿原酸高剂量组的表达量是模型组的2倍,差异显著(P<0.05)。模型组PPARβ mRNA比对照组下调了46%,差异非常显著(P<0.01);绿原酸低剂量组与模型组相比,虽有所上调,但与对照组比较差异显著(P<0.01);绿原酸高剂量组比模型组上调了2.28倍,差异非常显著(P<0.01),与对照组比也有显著性的上调。模型组PPARγ mRNA表达量与对照组相比,有下降的趋势,但差异不大;绿原酸低剂量组比模型组下调了22%;而绿原酸高剂量组比模型组上调了0.34%,但差异不显著。
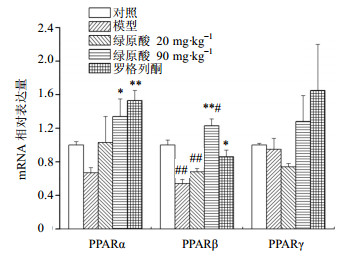 | 图 3 绿原酸对骨骼肌中PPARα、PPARβ、PPARγ mRNA表达的影响 (x±s, n = 8)Fig.3 Effects of chlorogenic acid on expression of PPARα, PPARβ, and PPARγ mRNA in skeletal muscle (x±s, n = 8) |
实验发现,经过12周高脂的饲喂,模型组与对照组相比,大鼠体质量增加更明显,但并未出现显著性差异;且相比之下,模型组大鼠行动迟缓,毛色暗淡,体型更肥大。绿原酸对高脂饲喂大鼠体质量增长有一定的改善作用,且呈剂量依赖性,其中绿原酸高剂量组大鼠最终体质量和体质量增加量与模型组相比,出现显著性差异。
骨骼肌是胰岛素介导的葡萄糖代谢和产生外周胰岛素抵抗的主要组织位点[10]。胰岛素刺激GLUT-4转位主要通过PI3K/Akt这个经典的信号通路调节。胰岛素与受体结合后,导致胰岛素受体自身发生酪氨酸磷酸化,进而引起胰岛素受体蛋白的酪氨酸发生磷酸化激活。IRS作为锚定蛋白调节下游信号分子PI3K,PI3K催化肌醇D3位置上PI4,5-二磷酸的磷酸化,和PI3,4,5-三磷酸结合,激活更多末端信号蛋白包括磷酸肌醇依赖性蛋白激酶-1和Akt。Akt已被证实是多种胰岛素作用的关键信号蛋白,包括糖原合成、蛋白合成和GLUT-4易位至细胞表面,从而增加葡萄糖运输[11]。本研究发现,绿原酸能大幅上调IRS-1、PI3K和Akt的mRNA表达量,进而促进GLUT-4转位到细胞质膜上并融合,进而转运更多的葡萄糖进入细胞。
PPAR属于核激素受体超家族,有α、β、γ 3种亚型。PPARα在肝脏、肾脏、脂肪组织、肌肉组织等中都有表达,PPARβ分布广泛,以肌肉组织和脂肪组织中表达为主,而PPARγ则主要分布在脂肪组织和肝脏组织中,肌肉中有少量表达[12]。PPAR在骨骼肌中主要通过提高胰岛素敏感性来促进糖代谢。Ye等[13]发现PPARα激动剂WY14643能改善高脂饲喂大鼠肌肉的胰岛素抵抗。体外试验表明,人的骨骼肌细胞置于PPARβ激动剂中能加强葡萄糖的吸收[14]。本实验结果显示,高剂量绿原酸能大幅提高因高脂饮食引起的PPARα和PPARβ mRNA表达量的降低。PPARγ对糖代谢调节的机制尚未明确,可能是PPARγ激活后,促进PI3K/Akt信号通路中PI3K基因的表达,增强骨骼肌中GLUT-4的表达,促进对葡萄糖的吸收,改善胰岛素抵抗,从而调节糖代谢。有研究表明绿原酸能通过促进GLUT-4和PPARγ转录来刺激肌管中葡萄糖转运[15]。本实验结果表明高剂量绿原酸组PPARγ mRNA表达量上升。
AMPK在骨骼肌中调节葡萄糖转运,被认为是“代谢传感器”。能源耗尽(AMP/ATP比率增大)和细胞内钙离子的增加引起肌肉收缩,促使AMPK激活[16]。哺乳动物基因组中AMPK基因有α、β、γ 3种亚型[17],其中AMPK-α2主要在心肌和骨骼肌中表达。Lee等[18]发现脂质灌注后的健康小鼠骨骼肌中AMPK-α2活性降低,且全身胰岛素敏感性下降。在本实验中发现,模型组AMPK-α2 mRNA与对照组相比下调了29%。与模型组相比,高剂量绿原酸极显著上调了AMPK-α2的表达,且与阳性对照组在同一水平。Ong等[19]研究证实绿原酸能通过激活AMPK来刺激db/db小鼠骨骼肌中葡萄糖的转运。与本实验结果一致。
糖原是贮存能量的、容易动员的多糖,机体贮存糖原的器官主要是肝脏和肌肉。糖原磷酸化酶是糖原降解必须的酶之一,PKA是催化磷酸化酶激酶磷酸化的酶,受环AMP(cyclic AMP,cAMP)的活化[20],PKA活化后可以促进糖原分解。试验结果显示绿原酸能促进PKA的表达,催化磷酸化酶激酶的磷酸化,进而增加肌细胞中葡萄糖浓度,调节骨骼肌中的糖原代谢。
综上所述,高剂量绿原酸能有效降低因高脂饲料引起的体质量增加,并通过PI3K/Akt途径和AMPK途径促进GLUT-4的转位来刺激骨骼肌中葡萄糖的运输。骨骼肌中糖代谢主要是由胰岛素介导的,另一方面绿原酸能上调PPAR等基因的表达,增强骨骼肌对胰岛素的敏感性,作用于PI3K/Akt途径,进而改善骨骼肌中糖的代谢。绿原酸在一定程度上能改善骨骼肌中的糖代谢途径,但部分机制尚未阐明,还有待进一步研究。
| [1] | Olthof M R, Hollman P C H, Katan M B. Chlorogenic acid and caffeic acid are absorbed in humans [J]. J Nutr, 2001, 131(1): 66-71. |
| [2] | Ehrenborg E, Krook A. Regulation of skeletal muscle physiology and metabolism by peroxisome proliferator-activated receptor δ [J]. Pharmacol Rev, 2009, 61(3): 373-393. |
| [3] | Tsuda S, Egawa T, Ma X, et al. Coffee polyphenol caffeic acid but not chlorogenic acid increases 5' AMP-activated protein kinase and insulin-independent glucose transport in rat skeletal muscle [J]. J Nutr Biochem, 2012, 23(11): 1403-1409. |
| [4] | Lund S, Holman G D, Schmitz O, et al. Contraction stimulates translocation of glucose transporter GLUT4 in skeletal muscle through a mechanism distinct from that of insulin [J]. Proc Nat Acad Sci, 1995, 92(13): 5817-5821. |
| [5] | Wilson C M, Cushman S W. Insulin stimulation of glucose transport activity in rat skeletal muscle: increase in cell surface GLUT4 as assessed by photolabelling [J]. Biochem J, 1994, 299(3): 755-759. |
| [6] | Meng S, Cao J, Feng Q, et al. Roles of chlorogenic acid on regulating glucose and lipids metabolism: a review [J]. Evidence-Based Compl Altern Med, 2013. doi: 10.1155/2013/801457. |
| [7] | 庞美蓉, 刘零怡, 高汪磊, 等. 绿原酸调节糖脂代谢的作用机制研究进展 [J]. 中草药, 2015, 46(2): 305-312. |
| [8] | Van Dam R M, Hu F B. Coffee consumption and risk of type 2 diabetes: a systematic review [J]. Jama, 2005, 294(1): 97-04. |
| [9] | 王 艳, 黄 林, 钟英丽, 等. 三种食物多酚对化学诱导DM大鼠糖脂代谢的影响 [J]. 营养学报, 2012, 34(6): 572-575. |
| [10] | Zierath J R, Krook A, Wallberg-Henriksson H. Insulin action and insulin resistance in human skeletal muscle [J]. Diabetologia, 2000, 43(7): 821-835. |
| [11] | Bruss M D, Arias E B, Lienhard G E, et al. Increased phosphorylation of Akt substrate of 160 kDa (AS160) in rat skeletal muscle in response to insulin or contractile activity [J]. Diabetes, 2005, 54(1): 41-50. |
| [12] | Abbott B D. Review of the expression of peroxisome proliferator-activated receptors alpha (PPARα), beta (PPARβ), and gamma (PPARγ) in rodent and human development [J]. Reprod Toxicol, 2009, 27(3): 246-257. |
| [13] | Ye J M, Doyle P J, Iglesias M A, et al. Peroxisome proliferator-activated receptor (PPAR)-α activation lowers muscle lipids and improves insulin sensitivity in high fat-fed rats comparison with PPAR-γ activation [J]. Diabetes, 2001, 50(2): 411-417. |
| [14] | Krämer D K, Al-Khalili L, Guigas B, et al. Role of AMP kinase and PPARδ in the regulation of lipid and glucose metabolism in human skeletal muscle [J]. J Biol Chem, 2007, 282(27): 19313-19320. |
| [15] | Prabhakar P K, Doble M. Synergistic effect of phytochemicals in combination with hypoglycemic drugs on glucose uptake in myotubes [J]. Phytomedicine, 2009, 16(12): 1119-1126. |
| [16] | Sakamoto K, Holman G D. Emerging role for AS160/TBC1D4 and TBC1D1 in the regulation of GLUT4 traffic [J]. Am J Physiol-Endocrinol Metabol, 2008, 295(1): E29-E37. |
| [17] | Barnes B R, Marklund S, Steiler T L, et al. The 5'-AMP-activated protein kinase γ3 isoform has a key role in carbohydrate and lipid metabolism in glycolytic skeletal muscle [J]. J Biol Chem, 2004, 279(37): 38441-38447. |
| [18] | Lee-Young R S, Bonner J S, Mayes W H, et al. AMP-activated protein kinase (AMPK) α2 plays a role in determining the cellular fate of glucose in insulin-resistant mouse skeletal muscle [J]. Diabetologia, 2013, 56(3): 608-617. |
| [19] | Ong K W, Hsu A, Tan B K H. Chlorogenic acid stimulates glucose transport in skeletal muscle via AMPK activation: a contributor to the beneficial effects of coffee on diabetes [J]. PLoS One, 2012, 7(3): e32718. |
| [20] | 王镜岩, 朱圣庚, 徐长法. 生物化学 (面向21世纪课程教材) [M]. 第3版. 北京: 高等教育出版社, 2002. |
 2015, Vol. 46
2015, Vol. 46


