2. 沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016
2. Key Laboratory of Structure-Based Drug Design and Discovery, Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China
结肠癌是临床上常见的消化系统恶性肿瘤之一,在全球癌症发病率居第3位[1],在过去的30多年,人民生活水平不断提高,饮食结构也发生了改变,包括我国在内的多数国家结肠癌发病率逐年上升[2],严重危害了人们的生命健康。目前临床上对结肠癌的治疗常以综合治疗为主,采用放疗、手术以及中药辅助化疗的方法。其中化疗是指用1种或1种以上有细胞毒性的抗肿瘤药物来抑制肿瘤细胞增殖并杀死肿瘤细胞,其间也对正常细胞产生一定的危害。因此对新的高效低毒的天然抗肿瘤药物的需求越来越迫切。研究显示,当前使用的多数化疗药物大多来源于药用植物[3],所以从药食同源草本中筛选出新的抗肿瘤药物是一种十分有效的途径,包括其先导化合物的发现及相关衍生物的研究。
人参作为一种珍贵的药食同源品在我国有着悠久的药用历史。人参皂苷为其主要有效成分,具有显著的抗肿瘤作用。国内开发的以人参皂苷Rg3单体作为主要成分的抗癌新药——参一胶囊,已首次在临床上用于抗肿瘤转移复发的治疗,且作用显著,适用于包括结肠癌在内的多个恶性肿瘤[4]。近10年来,本课题组针对人参中的有效成分进行了抗肿瘤方面的系列研究,特别是对人参皂苷及其衍生物深入开展了其抗癌作用的机制研究。首次发现25-羟基-原人参二醇(AD-2)和25-甲氧基-原人参二醇(AD-1)及其衍生物具有明显的抗结肠癌[5, 6]、前列腺癌[7, 8]以及肺癌[5, 9, 10, 11]的活性。研究表明[12],AD-2和AD-1及其衍生物抗肿瘤活性较人参皂苷Rg3高出5~15倍,为临床抗肿瘤药物的研究和开发提供了实验依据。目前人参皂苷及其衍生物的抗肿瘤作用研究已经成为一种趋势,其作用机制亦成为了国内外学者近年来研究的一大热点。本文以结肠癌为例,对人参皂苷及其衍生物抗结肠癌作用的研究进行综述,为从人参皂苷及衍生物中发现和研发靶向抗结肠癌新药提供科学参考。
1 人参皂苷抗结肠癌作用机制的研究 1.1 抑制结肠癌细胞增殖增殖失控和程序紊乱是癌细胞的重要特征,致使癌细胞不受宿主体液和神经等调节,出现自主的异常增殖,从而可通过抑制癌细胞的增殖来发挥抗癌作用。韩萍等[13]用MTT法检测了人参皂苷Rg3抑制结肠癌Caco-2细胞增殖的能力,结果发现人参皂苷Rg3可抑制结肠癌Caco-2细胞的增殖,其抑制作用呈现浓度依赖性。张敏等[14]研究发现人参皂苷Rg1和人参皂苷Rh2均能显著抑制结肠癌SW620细胞的增殖,其中人参皂苷Rh2对结肠癌细胞的抑制率随着浓度的增加和时间的延长而增加。李秋影等[15]采用荧光微孔法研究人参皂苷Rh2对结肠癌HT-29和Caco-2细胞增殖实验中发现,人参皂苷Rh2可明显抑制结肠癌细胞的生长;作用48 h后,人参皂苷Rh2对结肠癌Caco-2和HT-29细胞的半数抑制浓度(IC50)分别为26.79和19.68 μg/mL。赵青[16]考察了人参皂苷Rh3对结肠癌SW1116细胞生长的影响,发现人参皂苷Rh3具有显著抑制癌细胞生长的作用,且其抑制作用呈浓度和时间依赖性,当作用12 h,药物质量浓度为120 μg/mL时抑制作用达到平台期。He等[17]研究证明人参皂苷Rg3可通过阻止β-catenin核易位来抑制结肠癌细胞生长,阻遏癌细胞增殖。何运元等[18]发现人参皂苷Rg3可通过下调β-catenin的mRNA表达,降低β-catenin蛋白及其下游c-myc蛋白的表达量,并使β-catenin蛋白磷酸化程度降低,从而有效抑制结肠癌SW480和HCT-116细胞的增殖。
1.2 降低结肠癌细胞新生血管的生成恶性肿瘤生长和转移的重要生理过程之一是新生血管的形成,而血管内皮细胞(VEC)的增殖又是新生血管形成的基础。因此阻断VEC的增殖和新生血管的形成就能抑制恶性肿瘤的生长和转移。吴迪等[19]研究表明人参皂苷Rg3可能通过抑制肿瘤血管的形成来达到抑制结肠癌生长的作用。韩萍等[13]用酶联免疫吸附试验(ELISA)检测了结肠癌Caco-2细胞培养上清中血管内皮生长因子(VEGF)和白细胞介素-6(IL-6)的质量浓度,结果发现,人参皂苷Rg3对上清中VEGF和IL-6的分泌有影响。杨丕等[20]考察了参一胶囊(人参皂苷Rg3)对结肠癌患者血清中VEGF的影响,结果发现人参皂苷Rg3可使结肠癌患者血清中的VEGF水平降低,从而减少肿瘤心血管的生成。
1.3 减少结肠癌细胞的侵袭和迁移癌细胞的侵袭和迁移是恶性肿瘤的重要生物学特征之一,也是恶性肿瘤致死亡的主要原因,目前临床上治疗恶性肿瘤的主要方法就是通过减少肿瘤细胞的侵袭和扩散来减缓肿瘤细胞由局部向全身病变的过程。基质金属蛋白酶-1(MMP-1)的高表达在肿瘤细胞侵袭和转移过程中有着十分重要的意义。杜卫东等[21]研究发现人参皂苷Rg3可降低结肠癌HT-29细胞中MMP-1的表达量,从而抑制癌细胞的迁移能力,其抑制作用还呈现浓度和时间依赖性。Kim等[22]研究发现人参皂苷可增加主动脉中内源性一氧化氮(NO)的释放。NO是一种自由基,可通过调节血管生成来影响肿瘤的侵袭和转移[23]。Iishi等[24]利用自发的肿瘤转移模型研究了人参皂苷Rg3抗肿瘤转移作用,结果显示,当人参皂苷Rg3的质量浓度为5 mg/kg时,其腹膜转移率由57 %下降为13 %,证明人参皂苷Rg3能显著抑制结肠癌腹膜的转移。韩萍等[13]通过划痕实验检测结肠癌细胞迁移时发现人参皂苷Rg3能显著抑制结肠癌Caco-2细胞的迁移能力。
1.4 阻滞结肠癌细胞周期细胞周期是指细胞从一次分裂完成时开始到下一次分裂结束时为止所经历的全部过程,细胞周期分为间期(G1、S、G2)与分裂期(M)2个阶段。真核细胞的周期以G1-S-G2-M循环往复,任何一个时期受阻,均会阻滞整个细胞周期进程。多项研究表明,人参皂苷及其衍生物可通过阻滞结肠癌细胞周期起到抗结肠癌的作用。20-O-(β-D-吡喃葡糖基)-20 (S)-原人参二醇[25](人参皂苷CK)可使结肠癌HCT-116细胞阻滞在G1期,并诱导结肠癌细胞凋亡,Wang等[26]的研究也证明了这一点。细胞周期数据显示[27],5-氟尿嘧啶(5-FU)作用于细胞的S期或G2/M期。人参二醇(人参皂苷PD)可将结肠癌HCT-116细胞阻滞于G1期,加入5-FU后,细胞明显被阻滞于S期。人参皂苷PD和5-FU可通过协同作用影响结肠癌细胞周期。
1.5 诱导结肠癌细胞凋亡细胞凋亡(apoptosis or cell apoptosis)是指为了维持细胞内环境的稳定,由基因控制的自主有序的死亡。细胞在受到病理或生理的信号刺激后会启动凋亡程序,凋亡细胞会呈现一系列典型的形态特征。体内研究结果表明[28],用人参皂苷Rh2 ig荷CT-26结肠癌小鼠后,其体内cleved-caspase 3表达率明显增加,当质量分数为0.4 mg/kg(0.4 %乙醇混悬液)时能促进小鼠结肠癌CT-26细胞凋亡。虽然其抗癌作用不如5-FU效果好,但研究中未见其明显的毒副作用。人参皂苷CK[29]能通过诱导内质网应激以及线粒体依赖性的半胱天冬酶(caspase)途径,诱导结肠癌HT-29细胞凋亡。Hwang< /span>等[30]研究表明人参皂苷CK能靶向作用于钙离子介导的TRPC通道,使结肠癌CT-26细胞活力降低、膜联蛋白-V早期凋亡增加、sub-G1峰积累、核皱缩凝结,最后诱导细胞凋亡。Wang等[26]研究证明,人参皂苷CK较人参皂苷Rb1表现出更高的阻滞结肠癌SW480和HCT-116细胞周期及诱导细胞凋亡的作用。对接实验分析表明,人参皂苷CK与</ span>caspase 8、caspase 9蛋白有明显的相互作用,而这些蛋白是线粒体通路中的重要位点。Kim等[31]研究发现,人参皂苷CK促进结肠癌HT-29细胞凋亡是通过调节AMPK和线粒体信号通路来发挥作用的。研究证明[32],人参皂苷Rh2可通过激活p53信号通路来诱导结肠癌HCT-116、SW480细胞凋亡,进一步研究证明,人参皂苷Rh2可使癌细胞中活性氧增加,活化核转录因子-κB(NF-κB)通路,从而增加其诱导凋亡的作用。Bi等[5]研究发现,AD- 1可通过靶向作用于β-catenin信号通路来发挥其抑制结肠癌SW480、HCT-116细胞的作用,并诱导癌细胞的凋亡。实验证明[33],20 (S)-原人参二醇(PPD)可通过靶向作用于JNK、NF-κB和MAPK/ERK等多条信号通路来 抑制结肠癌HCT-116细胞生长并促使癌细胞凋亡。
1.6 诱导结肠癌细胞自噬自噬(autophagy or autophagocytosis)又称为II型程序性细胞死亡,是指细胞在自噬的相关基因(autophagyrelated gene,Atg)调控下与溶酶体结合来降解自身受损的蛋白质、细胞器等过程。其过程是粗面内质网无核糖体附着区脱落的双层膜包裹待降解物后形成自噬体(autophagosome),之后与溶酶体融合形成自噬溶酶体并降解其包裹的内含物,继而致使细胞核破坏[34, 35, 36]。Kim等[37]在研究人参皂苷CK对结肠癌HCT-116细胞作用时发现,人参皂苷CK对自噬相关蛋白Atg 5、Atg 6和Atg 7有相互作用,并呈现时间依赖性。敲除这些自噬相关的蛋白后,会抑制人参皂苷CK对LC3-II的积累及癌细胞活性,进一步研究证明,人参皂苷CK引起的自噬与体内活性氧有关。人参皂苷CK还能激活JNK信号通路并诱导细胞凋亡。
2 人参皂苷协同增强临床抗结肠癌的作用现代药物研究表明,中药制剂可降低化疗药物的毒副作用,并可与化疗药物结合使用,增强化疗药物的抗癌作用[38, 39]。5-FU和伊立替康(irinotecan)[40, 41]作为常见的化疗药物在结肠癌治疗过程中经常使用。与其他抗肿瘤化疗药物一样,伊立替康也具有明显的毒副作用,因此临床上伊立替康常作为二线治疗药物与5-FU联合使用来治疗转移性结肠癌[42, 43]。人参中有效抗癌成分可协同增强伊立替康抗结肠癌作用,降低伊立替康的使用剂量,降低毒副作用。Wang等[44]研究发现,西洋参可协同提高伊立替康和5-FU抗结肠癌HCT-116、HT-29和SW480细胞的作用,5-FU与西洋参联合使用后,低剂量亦可达到预期的治疗效果,从而降低了5-FU剂量相关的毒性。此外,研究还发现,人参皂苷PD与5-FU联合使用后也可表现出类似的协同作用[27]。与伊立替康单独使用相比,与人参皂苷PD联合使用后可显著提高对结肠癌HCT-116细胞的凋亡率,增加caspase 9和caspase 3的酶活力。后续分子对接模拟实验分析证实,人参皂苷PD和伊立替康可分别结合在caspase 3酶蛋白的2个不同作用位点而呈现出显著的协同作用[45] 。此外,相关研究[46, 47]表明,人参皂苷PD可与表儿茶素产生协同作用,诱导结肠癌SW480和HCT-116细胞的凋亡;相关实验还证明[48],人参皂苷Rg3与紫杉醇、多烯紫杉醇、阿霉素以及顺铂联用时,可显著抑制癌细胞的生长。人参皂苷Rg3可增强结肠癌HCT-116和SW620细胞对多烯紫杉醇及化疗的敏感性。
3 人参皂苷衍生物抗结肠癌作用机制的研究近年来,随着国内外学者对人参皂苷结构修饰和药理作用的研究越来越深入,人参皂苷衍生物在抗肿瘤方面表现出了良好的应用前景。人参皂苷衍生物是由原生皂苷转化而来,某些衍生物表现出较原生皂苷更强的抗肿瘤作用。目前,国内外学者主要通过体外细胞模型来研究人参皂苷衍生物抗肿瘤活性和构效关系[49]。体外研究发现,人参皂苷衍生物具有显著的抗结肠癌作用,主要表现为抑制结肠癌细胞生长、诱导结肠癌细胞凋亡等。研究表明[50, 51], AD-1和AD-2的脂肪酸衍生物能显著抑制结肠癌HT-29和LoVo细胞生长,且某些衍生物表现出较AD-1和AD-2更高的抗结肠癌活性;AD-2氨基酸衍生物[6, 52, 53]具有明显的抑制结肠癌HCT-116、HT-29和LoVo细胞生长的活性,且对脾脏正常细胞的副作用较小。Xia等[6]研究发现,AD-1衍生物(xl、1c、8b)能显著抑制结肠癌HCT-116、HT-29、LoVo、SW480细胞株的生长,进一步研究其诱导结肠癌HCT-116细胞凋亡机制时发现,xl、1c、8b可降低凋亡抑制因子Bcl-2的蛋白表达,上调促凋亡因子Bax的蛋白表达,提高caspase-3、caspase-9蛋白的表达量,由此发挥促凋亡作用。到目前为止,人参皂苷衍生物表现出较原生皂苷更强的抗结肠癌活性,但其确切的抗结肠癌作用机制仍需要大量的实验及临床研究来证实。基于人参皂苷衍生物的高效低毒性,显示出其在研发成新的结肠癌药物或者作为辅助药物以减轻化疗药的毒副作用方面具有潜力。人参皂苷及其衍生物促结肠癌细胞凋亡的作用机制见表 1,涉及的主要通路见图 1。
| 表 1 人参皂苷及衍生物抗结肠癌的主要作用机制 Table 1 Main effects and mechanisms of ginsenosides and their derivatives against colon cancer |
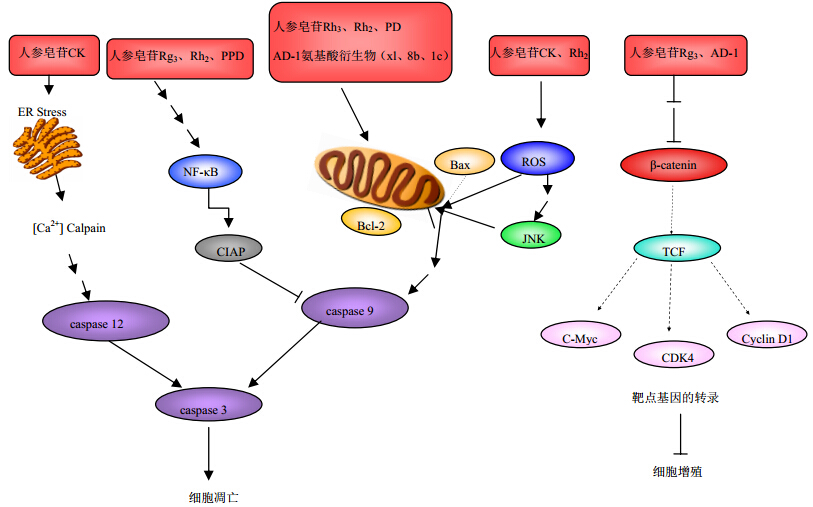 | 图 1 人参皂苷及衍生物抗结肠癌的主要作用通路Fig. 1 Main signaling pathways of ginsenosides and their derivatives against colon cancer |
国内外学者从分子水平上研究了人参皂苷及其衍生物抗结肠癌的作用机制,主要涉及到了线粒体通路、内质网应激以及WNT/β-catenin信号通路,通过抑制结肠癌细胞的生长,降低新生血管的生成,减少癌细胞的侵袭和迁移,最终诱导结肠癌细胞自噬和凋亡。人参皂苷及其衍生物能与化疗药物联合应用,降低化疗药物的毒性,并协同增强化疗药物的抗癌作用。但其确切的作用机制仍需大量的实验及临床研究来加以证实。因此,深入研究人参皂苷及其衍生物抗结肠癌的实验与临床间的联系,从分子水平到基因水平探索人参皂苷及其衍生物抗结肠癌的作用机制,为靶向防治结肠癌的药物和高效低毒的创新药物开发提供科学依据,将具有十分重要的社会和经济意义。
| [1] | Parkin D M, Bray F, Ferlay J, et al. Global cancer statistics, 2002 [J]. CA Cancer J Clin, 2005, 55(2): 74-108. |
| [2] | Jemal A, Bray F, Center M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [3] | Li X J, Zhang H Y. Western-medicine-validated anti-tumor agents and traditional Chinese medicine [J]. Trends Mol Med, 2008, 14(1): 1-2. |
| [4] | Lee S Y, Kim G T, Roh S H, et al. Proteomic analysis of the anti-cancer effect of 20 (S)-ginsenoside Rg3 in human colon cancer cell lines [J]. Biosci Biotechnol Biochem, 2009, 73(4): 811-816. |
| [5] | Bi X L, Zhao Y Q, Fang W F, et al. Anticancer activity of Panax notoginseng extract 20(S)-25-OCH3-PPD: targetting β-catenin signalling [J]. Clin Exp Pharmacol Physiol, 2009, 36(11): 1074-1078. |
| [6] | Xia X C, Jiang B W, Liu W, et al. Anti-tumor activity of three novel derivatives of ginsenoside on colorectal cancer cells [J]. Steroids, 2014, 80: 24-29. |
| [7] | Wang W, Rayburn E R, Zhao Y Q, et al. Novel ginsenosides 25-OH-PPD and 25-OCH3-PPD as experimental therapy for pancreatic cancer: anticancer activity and mechanisms of action [J]. Cancer Lett, 2009, 278(2): 241-248. |
| [8] | Hao M, Wang W, Zhao Y Q, et al. Pharmacokinetics and tissue distribution of 25-hydroxyprotopanaxadiol, an anti-cancer compound isolated from Panax ginseng, in athymic mice bearing xenografts of human pancreatic tumors [J]. Eur J Drug Metab Pharmacokinet, 2011, 35(3): 109-113. |
| [9] | Wang W, Rayburn E R, Hang J, et al. Anti-lung cancer effects of novel ginsenoside 25-OCH3-PPD [J]. Lung Cancer, 2009, 65(3): 306-311. |
| [10] | Zhang L H, Jia Y L, Lin X X, et al. AD-1, a novel ginsenoside derivative, shows anti-lung cancer activity via activation of p38 MAPK pathway and generation of reactive oxygen species [J]. Biochim Biophys Acta, 2013, 1830(8): 4148-4159. |
| [11] | Bi X L, Xia X C, Mou T, et al. Anti-tumor activity of three ginsenoside derivatives in lung cancer is associated with Wnt/β-catenin signaling inhibition [J]. Eur J Pharmacol, 2014, 742: 145-152. |
| [12] | Wang W, Rayburn E R, Zhao Y Q, et al. In vitro anti-cancer activity and structure activity relationships of natural products isolated from fruits of Panax ginseng [J]. Cancer Chemother Pharmacol, 2007, 59(5): 589-601. |
| [13] | 韩 萍, 罗 阔, 蒋青松, 等. 人参皂苷Rg3对结肠癌Caco-2细胞增殖和迁移的影响 [J]. 免疫学杂志, 2014, 30(8): 722-726. |
| [14] | 张 敏, 叶 春, 曹录秀, 等. 6个中药单体对结肠腺癌细胞SW620体外增殖活性的影响 [J]. 成都医学院学报, 2013, 8(4): 427-429. |
| [15] | 李秋影, 颜璐璐, 马晓慧, 等. 20 (S)-人参皂苷Rh2对人结肠癌细胞增殖和周期的影响 [J]. 中成药, 2011, 33(11): 1874-1878. |
| [16] | 赵 青. 人参皂苷Rh3对结肠癌SW1116的抑制作用及其机制的初步探究 [D]. 长春: 吉林大学, 2012. |
| [17] | He B C, Gao J L, Luo X J, et al. Ginsenoside Rg3 inhibits colorectal tumor growth through the down-regulation of Wnt/β-catenin signaling [J]. Int J Oncol, 2011, 38(2): 437-445. |
| [18] | 何运元, 王 营, 王 黎, 等. 人参皂苷Rg3调控WNT/β-catenin信号通路抑制结肠癌细胞生长的实验研究 [J]. 肿瘤基础与临床, 2012, 25(3): 189-194. |
| [19] | 吴 迪, 邹青峰, 马 磊, 等. 人参皂苷Rg3联合化疗抑制大肠癌生长的实验研究 [J]. 湖南中医杂志, 2008, 24(5): 96-98. |
| [20] | 杨 丕, 汤海轮, 陈笑雷. 参一胶囊对结肠癌患者血清血管内皮生长因子的影响 [J]. 临床急诊杂志, 2008, 9(1): 44-45. |
| [21] | 杜卫东, 屠巍巍, 华 晨. 人参皂苷Rg3对HT-29细胞株MMP-1表达和迁移能力的影响 [J]. 中国中西医结合外科杂志, 2009, 15(5): 544-546. |
| [22] | Kim N D, Kang S Y, Schini V B. Ginsenosides evoke endothelium-dependent vascular relaxation in rat aorta [J]. Gen Pharmacol, 1994, 25(6): 1071-1077. |
| [23] | Morbidelli L, Donnini S, Ziche M. Role of nitric oxide in tumor angiogenesis [J]. Cancer Treat Res, 2004, 117: 155-167. |
| [24] | Iishi H, Tatsuta M, Baba M, et al. Inhibition by ginsenoside Rg3 of bombbesin-enhanced peritoneal metastasis of intestinal adenocarcinimas induced by azoxymethane in Wistar rats [J]. Clin Exp Metastasis, 1997, 15(6): 603-611. |
| [25] | Zhang Z Y, Du G J, Wang C Z, et al. Compound K, a ginsenoside metabolite, inhibits colon cancer growth via multiple pathways including p53-p21 interactions [J]. Int J Mol Sci, 2013, 14(2): 2980-2995. |
| [26] | Wang C Z, Du G J, Zhang Z Y, et al. Ginsenoside compound K, not Rb1, possesses potential chemopreventive activities in human colorectal cancer [J]. Int J Oncol, 2012, 40(6): 1970-1976. |
| [27] | Li X L, Wang C Z, Mehendale S R, et al. Panaxadiol, a purified ginseng component, enhances the anti-cancer effects of 5-fluorouracil in human colorectal cancer cells [J]. Cancer Chemother Pharmacol, 2009, 64(6): 1097-1104. |
| [28] | 陈晓东. 人参皂苷Rh2对荷结肠癌CT-26小鼠抗瘤作用及免疫指标的影响 [D]. 天津: 天津医科大学, 2010. |
| [29] | Zhang R, Chung Y, Kim H S, et al. 20-O-(β-D-glucopyranosyl)-20 (S)-protopanaxadiol induces apoptosis via induction of endoplasmic reticulum stress in human colon cancer cells [J]. Oncol Rep, 2013, 29(4): 1365-1370. |
| [30] | Hwang J A, Hwang M K, Jang Y W, et al. 20-O-β-D-glucopyranosyl-20 (S)-protopanaxadiol, a metabolite of ginseng, inhibits colon cancer growth by targeting TRPC channel-mediated calcium influx [J]. J Nutr Biochem, 2013, 24(6): 1096-1104. |
| [31] | Kim D Y, Park M W, Yuan H D, et al. Compound K induces apoptosis via CAMK-IV/AMPK pathways in HT-29 colon cancer cells [J]. J Agric Food Chem, 2009, 57(22): 10573-10578. |
| [32] | Li B H, Zhao J, Wang C Z, et al. Ginsenoside Rh2 induces apoptosis and paraptosis-like cell death in colorectal cancer cells through activation of p53 [J]. Cancer Lett, 2011, 301(2): 185-192. |
| [33] | Gao J L, Lv G Y, He B C, et al. Ginseng saponin metabolite 20 (S)-protopanaxadiol inhibits tumor growth by targeting multiple cancer signaling pathways [J]. Oncol Rep, 2013, 30(1): 292-298. |
| [34] | Coates J M, Galante J M, Bold R J. Cancer therapy beyond apoptosis: autophagy and anoikis as mechanisms of cell death [J]. J Surg Res, 2010, 164(2): 301-308. |
| [35] | Gasparini R, Panatto D. Meningococcal glycoconjugate vaccines [J]. Hum Vaccin, 2011, 7(2): 170-182. |
| [36] | Giuliani C M, Dass C R. Autophagy and cancer: taking the ‘toxic' out of cytotoxics [J]. J Pharm Pharmacol, 2013, 65(6): 777-789. |
| [37] | Kim A D, Kang K A, Kim H S, et al. A ginseng metabolite, compound K, induces autophagy and apoptosis via generation of reactive oxygen species and activation of JNK in human colon cancer cells [J]. Cell Death Dis, 2013, 4(8): 1-11. |
| [38] | Lin Y J, Zhen Y Z, Zhao Y F, et al. Rhein lysinate induced S-phase arrest and increased the anti-tumor activity of 5-FU in HeLa cells [J]. Am J Chin Med, 2011, 39(4): 817-825. |
| [39] | Yamaguchi Y, Miyahara E, Hihara J. Efficacy and safety of orally administered Lentinula edodes mycelia extract for patients undergoing cancer chemotherapy: a pilot study [J]. Am J Chin Med, 2011, 39: 451-459. |
| [40] | Smorenburg C H, Peters G J, van Groeningen C J, et al. Phase II study of tailored chemotherapy for advanced colorectal cancer with either 5-fluouracil and leucovorin or oxaliplatin and irinotecan based on the expression of thymidylate synthase and dihydropyrimidine dehydrogenase [J]. Ann Oncol, 2006, 17(1): 35-42. |
| [41] | Wolpin B M, Mayer R J. Systemic treatment of colorectal cancer [J]. Gastroenterology, 2008, 134(5): 1296-1310. |
| [42] | Van Cutsem E, Dirix L, Van Laethem J L, et al. Optimisation of irinotecan dose in the treatment of patients with metastatic colorectal cancer after 5-FU failure: results from a multinational, randomised phase II study [J]. Br J Cancer, 2005, 92(6): 1055-1062. |
| [43] | Vanhoefer U, Harstrick A, Achterrath W, et al. Irinotecan in the treatment of colorectal cancer: clinical overview [J]. J Clin Oncol, 2001, 19(5): 1501-1518. |
| [44] | Wang C Z, Xie J T, Zhang B, et al. Chemopreventive effects of Panax notoginseng and its major constituents on SW480 human colorectal cancer cells [J]. Int J Oncol, 2007, 31(5): 1149-1156. |
| [45] | Du G J, Wang C Z, Zhang Z Y, et al. Caspase-mediated pro-apoptotic interaction of panaxadiol and irinotecan in human colorectal cancer cells [J]. J Pharm Pharmacol, 2012, 64(5): 727-734. |
| [46] | Du G J, Wang C Z, Qi L W, et al. The synergistic apoptotic interaction of panaxadiol and epigallocatechin gallate in human colorectal cancer cells [J]. Phytother Res, 2013, 27(2): 272-277. |
| [47] | Rodriguez M, Du G J, Wang C Z, et al. Panaxadiol's anticancer activity is enhanced by epicatechin [J]. Am J Chin Med, 2010, 38(6): 1233-1235. |
| [48] | Kim S M, Lee S Y, Yuk D Y, et al. Inhibition of NF-κB by ginsenoside Rg3 enhances the susceptibility of colon cancer cells to docetaxel [J]. Arch Pharm Res, 2009, 32(5): 755-765. |
| [49] | 刘雅飞, 崔玉娜, 赵余庆. 基于抗肿瘤活性的达玛烷型人参皂苷 (元) 结构修饰 [J]. 中草药, 2013, 44(9): 1203-1210. |
| [50] | Liu Y F, Yuan H N, Bi X L, et al. 25-methoxyl protopanaxadiol derivatives and their anti-proliferative activities [J]. Steroids, 2013, 78(14): 1305-1311. |
| [51] | Wang P, Bi X L, Xu J, et al. Synthesis and anti-tumor evaluation of novel 25-hydroxyprotopanaxadiol analogs incorporating natural amino acids [J]. Steroids, 2013, 78(2): 203-209. |
| [52] | Wang P, Bi X L, Guo Y M, et al. Semi-synthesis and anti-tumor evaluation of novel 25-hydroxyprotopanaxadiol derivatives [J]. Eur J Med Chem, 2012, 55: 137-145. |
| [53] | Qu F Z, Liu Y F, Cao J Q, et al. Novel 25-hydroxyprotopanaxadiol derivatives incorporating chloroacetyl chloride and their anti-tumor evaluation [J]. Bioorg Med Chem Lett, 2014, 24(23): 5390-5394. |
 2015, Vol. 46
2015, Vol. 46


