宫颈癌是常见的妇科恶性肿瘤,其在全球恶性肿瘤中发病率高居第2位,病死率居第4位,而在发展中国家其发病率和病死率均高居第2位,全球每年有超过25万患者死于宫颈癌[1]。近年来,宫颈癌发病率趋于年轻化,严重危害着女性的健康。宫颈癌患者死亡的主要原因是肿瘤复发和转移[2, 3, 4]。化疗药物在一定程度上能抑制肿瘤细胞增殖和转移,但传统的化疗药物毒性大且由于肿瘤耐药性,临床上疗效并不理想,且部分患者难以耐受。因此从天然植物中寻找高效低毒的具有抗肿瘤活性的成分成为了国内外研究的热点[5, 6, 7]。
毛蕊异黄酮-7-O-葡萄糖苷(calycosin-7-O-β-D- glucoside,CG)是黄芪中的主要活性成分,具有广泛的药理活性,包括抗肿瘤、降血压、调血脂、降血糖及抗氧化等[8, 9, 10]。迄今发现CG能有效地诱导细胞凋亡和抑制多种癌细胞的生长,但其作用机制仍未明确。本研究旨在探讨CG对宫颈癌HeLa细胞凋亡及Bcl-2/Bax表达的影响,以期为临床应用提供理论研究基础。
1 材料与方法 1.1 材料人宫颈癌细胞系HeLa细胞购自中国科学院上海细胞库;CG(质量分数≥95%)购于Sigma公司;胎牛血清购自Invitrogen公司;RPMI 1640培养液购于杭州四季青生物材料研究所;噻唑蓝(MTT)试剂盒购于武汉谷歌生物科技有限公司;AnnexinV/PI细胞凋亡检测试剂盒购于Bender公司;半胱氨酸天冬氨酸蛋白酶(Caspase-3)活性检测试剂盒购于南京凯基生物科技发展有限公司;Bcl-2、Bax抗体购于美国Cell Signaling Technology公司;辣根酶标记兔抗山羊IgG购自武汉博士德生物科技有限公司。
1.2 细胞培养将HeLa细胞培养于含10%小牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI 1640培养液中,置于37 ℃、5% CO2、饱和湿度培养箱内培养,取对数生长期细胞用于实验。
1.3 MTT法检测细胞增殖取对数生长期的HeLa细胞,调整细胞浓度以1×104/mL接种于96孔板,每孔200 μL,待细胞贴壁后分别加入含CG(终质量浓度为0、2.5、5.0、10.0、20.0、40.0、60.0、80.0、160.0 μg/mL)的培养液,并设立调零孔。每个质量浓度设5个复孔,继续培养24、48,于实验结束前4 h加入MTT试剂20 μL/孔,继续孵育4 h,吸弃上清,加入二甲基亚砜(DMSO)150 μL/孔,摇床上振荡10 min,结晶充分溶解后酶标仪上检测570 nm处的吸光度(A)值,计算细胞存活率。
存活率=(实验组平均A值-调零孔A值)/(对照组平均A值-调零孔A值)
1.4 Hoechst 33258染色法检测细胞凋亡分组及加药处理同“1.3”项,CG终质量浓度分别为0、20、40、80 μg/mL。培养HeLa细胞48 h后,PBS清洗1次,加入4%多聚甲醛室温固定15 min,PBS清洗2次,加入1 mmol/L Hoechst 33258室温染色15 min,封片,荧光显微镜(激发波长365 nm)下观察(×200)细胞核形态。
1.5 流式细胞仪检测细胞凋亡及细胞周期将对数生长期细胞以1×106/mL浓度接种于6孔培养板内,贴壁后分别加入含CG(终质量浓度分别为0、20、40、80 μg/mL)的培养液,培养48 h后,收集细胞,离心固定后加入Annexin V-FITC和PI,室温避光染色。筛网滤过后送流式细胞仪进行细胞凋亡及细胞周期的检测。
1.6 Western blotting检测cleaved Caspase-3、Bcl-2、Bax蛋白表达细胞接种及分组同“1.5”项,处理48 h后收集细胞,参照细胞浆蛋白抽提试剂盒说明书进行操作,提取细胞总蛋白,并测定蛋白浓度,蛋白样品加入1/5体积的5×上样缓冲液,沸水煮沸5 min,根据蛋白浓度以每孔20 μg上样,进行SDS-聚丙烯酰胺凝胶电泳,然后电转至PVDF膜上,室温封闭1 h,分别加入1∶1 000稀释的兔抗人Bcl-2、Bax蛋白,4 ℃过夜。β-actin作为内参,TBST洗膜3次,加入1∶1 000稀释的辣根酶标记的兔抗山羊IgG,室温孵育2 h,同样洗膜3次,ECL发光液显色,观察各条带深浅变化。
1.7 统计学方法采用SPSS 17.0统计学软件进行数据分析,计量资料用x±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果 2.1 CG对HeLa细胞活力的影响CG处理24、48 h,质量浓度在2.5~160.0 μg/mL内均可抑制HeLa细胞活力,且随着CG质量浓度的升高和处理时间的延长,细胞增殖抑制作用逐渐增强,呈浓度和时间依赖效应。见图 1。
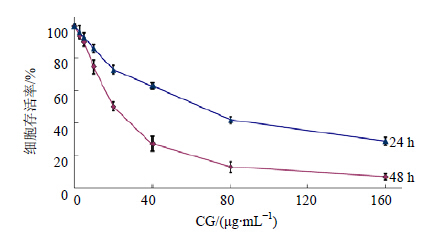 | 图 1 CG对HeLa细胞活力的影响 (x±s,n=5)Fig.1 Effect of CG on cell viability of HeLa cells (x±s,n=5) |
Hoechst 33258荧光染色法检测显示,对照组HeLa细胞发出微弱的蓝色荧光,细胞核无明显的形态学改变;CG处理组HeLa细胞核浓缩聚集、碎裂,核边集,并发出较强的蓝色荧光。结果见图 2。
 | 图 2 CG对HeLa细胞凋亡的影响 (Hoechst 33258染色)Fig.2 Effect of CG on apoptosis of HeLa cells(Hoechst 33258 staining) |
流式细胞仪检测结果显示,CG能诱导HeLa细胞凋亡。CG(终质量浓度分别为20、40、80 μg/mL)处理HeLa细胞48 h后,细胞凋亡率分别为10.40%、25.50%、39.40%,明显高于对照组凋亡率(1.2%)。见图 3和表 1。
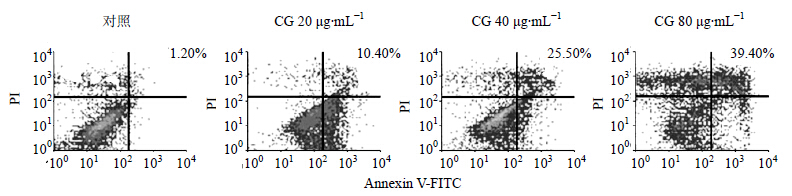 | 图 3 CG诱导HeLa细胞早期凋亡Fig.3 CG-induced early apoptosis of HeLa cells |
| 表 1 各组细胞的凋亡率及细胞周期 (x±s,n=5) Table 1Apoptosis rate and cell cycle in each group (x±s,n=5) |
与对照组比较,CG处理的细胞G0/G1期细胞比例增高,S期细胞比例减少(P<0.05),进一步说明CG处理后HeLa细胞的分裂和增殖受到抑制,而早期凋亡率增加。见表 1。
2.3 CG对HeLa细胞cleaved Caspase-3、Bcl-2和Bax表达量的影响对照组HeLa细胞中cleaved Caspase-3几乎没有表达,实验组(CG终质量浓度分别为20、40、80 μg/mL)处理HeLa细胞48 h后,HeLa细胞cleaved Caspase-3表达量浓度依赖性地增加。
CG处理HeLa细胞48 h后,结果显示随着CG质量浓度的升高,促凋亡蛋白Bax的表达量也逐渐升高,而抗凋亡蛋白Bcl-2的表达量逐渐降低。结果见图 4。
 | 图 4 CG对HeLa细胞中Caspase-3、Bax及Bcl-2表达量的影响(x±s,n=5)Fig.4 Effects of CG on intracellular expression levels of Caspase-3,Bax,and Bcl-2 (x±s,n=5) |
宫颈癌是女性常见的恶性肿瘤之一,是全球妇女中发病率仅次于乳腺癌而占第2位的恶性肿瘤,主要治疗手段包括外科手术、放疗和化疗,寻找和研制高效低毒的治疗宫颈癌的药物仍然是当前宫颈癌研究工作的热点。中药可以减轻放化疗的副反应,提高癌症患者的生活质量,延长患者的生存期。因此,中药因其安全性及副作用少等特点已成为肿瘤医学的研究热点之一[11]。
细胞凋亡是多细胞机体维持内环境稳定的重要自我调节机制,细胞凋亡与细胞增殖之间的平衡在肿瘤发生发展中具有重要意义,细胞凋亡是程序化、多基因调控的细胞死亡过程,通过诱导细胞凋亡可能是肿瘤治疗最有效的途径之一,因此促进细胞凋亡已经成为抗肿瘤研究的热点[12, 13]。本研究发现CG在2.5~160 μg/mL均能抑制人宫颈癌HeLa细胞的增殖,且呈现明显的剂量依赖及时间依赖效应。Hoechst 33258染色常用于细胞凋亡检测,染色后活细胞呈弥散均匀荧光,出现细胞凋亡时,细胞核或细胞质内可见浓染致密的颗粒状荧光。本实验发现,不同质量浓度CG处理HeLa细胞48 h后,细胞核荧光强度逐渐增强,显示出细胞出现凋亡现象。流式细胞仪检测结果同样显示,CG处理HeLa细胞48 h后可诱导凋亡,且随着药物质量浓度的升高细胞凋亡率亦增加,呈浓度依赖效应。细胞凋亡研究认为,Caspase家族蛋白的激活在细胞凋亡过程中起了关键性作用,被认为是诱发凋亡的直接效应物。已发现的Caspase家族有10余种,其中Caspase-3是该家族的重要成员,是细胞凋亡过程中的关键酶。本研究发现,CG呈浓度依赖性地增加HeLa细胞中Caspase-3的活性形式cleaved Caspase-3的表达量,提示CG能抑制细胞增殖,并可能是通过增强细胞Caspase-3活性从而促进细胞凋亡。
为进一步探讨CG诱导细胞凋亡,本研究检测Bcl-2、Bax蛋白表达的变化,研究发现不同质量浓度CG处理后,HeLa细胞Bcl-2表达下调,Bax表达上调。Bcl-2是一种内膜蛋白,主要存在于线粒体、内质网和核膜上,Bcl-2在多种肿瘤细胞中表达,能通过增强线粒体膜电位,抑制钙离子释放,阻止核酸内切酶活化,进而发挥抗凋亡作用;Bax属于Bcl-2家族成员,其作用与Bcl-2相反,可直接激活死亡效应因子Caspase或改变细胞膜通透性引起细胞色素C释放某些离子和小分子通过细胞膜,进而促进细胞凋亡。细胞Bcl-2和Bax比例改变可调节细胞凋亡[14],当Bcl-2占优势时,细胞具有抗凋亡作用;相反,当Bax过表达时,细胞容易在诱导剂作用下发生凋亡[15]。
综上所述,CG可抑制HeLa细胞增殖并诱导细胞凋亡,其诱导细胞凋亡机制可能是通过上调Bax蛋白表达并下调Bcl-2蛋白表达,增加细胞Caspase-3活性。本研究为宫颈癌治疗所需的新的化疗试剂或其类似物的发现提供了信息。随着肿瘤发生和发展的分子机制的阐明,肿瘤细胞和正常细胞的区别将会更加明确,利用生物技术找到肿瘤治疗的新突破口是非常值得深入研究的。
| [1] | Vineis P, Wild C P. Global cancer patterns: causes and prevention [J]. Lancet, 2014, 383(9916): 549-557. |
| [2] | Rodrigues L C, Gobira P H, de Oliveira A C, et al. Neuroinflammation as a possible link between cannabinoids and addiction [J]. Acta Neuropsychiatr, 2014, 26(6): 334-346. |
| [3] | Sales K J, Katz A A. Inflammatory pathways in cervical cancer-the UCT contribution [J]. S Afr Med J, 2012, 102(6): 493-496. |
| [4] | Sasagawa T, Takagi H, Makinoda S. Immune responses against human papillomavirus (HPV) infection and evasion of host defense in cervical cancer [J]. J Inf Chemother, 2012, 18(6): 807-815. |
| [5] | Fan H J, Tian W X, Ma X F. Curcumin induces apoptosis of HepG2 cells via inhibiting fatty acid synthase [J]. Target Oncol, 2014, 9(3): 279-286. |
| [6] | Li P, Tian W, Ma X. Alpha-mangostin inhibits intracellular fatty acid synthase and induces apoptosis in breast cancer cells [J]. Mol Cancer, 2014, 13(1): 138. |
| [7] | Wang Y, Nie F, Ouyang J, et al. Inhibitory effects of sea buckthorn procyanidins on fatty acid synthase and MDA-MB-231 cells [J]. Tumor Biol, 2014, 35(10): 9563-9569. |
| [8] | Fu S, Gu Y, Jiang J Q, et al. Calycosin-7-O-β-D- glucoside regulates nitric oxide/caveolin-1/matrix metalloproteinases pathway and protects blood-brain barrier integrity in experimental cerebral ischemia- reperfusion injury [J]. J Ethnopharmacol, 2014, 155(1): 692-701. |
| [9] | Liu X H, Zhao J B, Guo L, et al. Simultaneous determination of calycosin-7-O-β-D-glucoside, ononin, calycosin, formononetin, astragaloside IV, and astragaloside II in rat plasma after oral administration of Radix Astragali extraction for their pharmacokinetic studies by ultra-pressure liquid chromatography with tandem mass spectrometry [J]. Cell Biochem Biophys, 2014, 70(1): 677-686. |
| [10] | Li W, Sun Y N, Yan X T, et al. Flavonoids from Astragalus membranaceus and their inhibitory effects on LPS-stimulated pro-inflammatory cytokine production in bone marrow-derived dendritic cells [J]. Arch Pharm Res, 2014, 37(2): 186-192. |
| [11] | Fan H, Wu D, Tian W, et al. Inhibitory effects of tannic acid on fatty acid synthase and 3T3-L1 preadipocyte [J]. Biochim Biophys Acta, 2013, 1831(7): 1260-1266. |
| [12] | Li P, Tian W, Wang X, et al. Inhibitory effect of desoxyrhaponticin and rhaponticin, two natural stilbene glycosides from the Tibetan medicinal plant Rheum tanguticum Maxim. ex Balf., on fatty acid synthase and human breast cancer cells [J]. Food Funct, 2014, 5(2): 251-256. |
| [13] | Koff J L, Ramachandiran S, Bernal-Mizrachi L. A time to kill: Targeting apoptosis in cancer [J]. Int J Mol Sci, 2015, 16(2): 2942-2955. |
| [14] | Kim K Y, Seol J Y, Jeon G A, et al. The combined treatment of aspirin and radiation induces apoptosis by the regulation of bcl-2 and caspase-3 in human cervical cancer cells [J]. Caner Lett, 2003, 189(2): 157-166. |
| [15] | Mohan S, Abdelwahab S I, Kamalidehghan B, et al. Involvement of NF-kappa B and Bcl-2/Bax signaling pathways in the apoptosis of MCF7 cells induced by a xanthone compound Pyranocycloartobiloxanthone A [J]. Phytomedicine, 2012, 19(11): 1007-1015. |
 2015, Vol. 46
2015, Vol. 46

