据《中国植物志》记载,我国罗布麻种类主要有3种:罗布麻属罗布麻Apocynum venetum Linn.(又名罗布红麻)、白麻属大叶白麻Poacynum hendersonii (Hook. f.) Woodson(又名罗布白麻)和白麻P. pictum Schrenk。人们习惯把罗布红麻、罗布白麻和白麻统称为“罗布麻”。但现在白麻的分布和数量很少,很难采集到。现代药理学和临床医学研究已表明,罗布麻叶(主要是罗布红麻)具有降血压、抗抑郁、抗焦虑、抗氧化、护肝和利尿的作用[1,2,3]。罗布麻是一种药食同源植物,罗布红麻和罗布白麻叶在中国和日本均被用作茶饮[4],且目前在新疆出售的罗布麻茶多以罗布白麻叶为原料。但收入《中国药典》的罗布麻叶的原药材罗布红麻[5]。罗布白麻能否代替罗布红麻,关键在于它们主要有效成分有何异同,而有关罗布红麻和罗布白麻叶主要有效成分是否相同,尤其是两者是否含有芦丁的报道不一致[6,7]。罗布麻叶中的主要的黄酮类成分为金丝桃苷、异槲皮苷、槲皮素3-O-槐糖苷、芸香苷及少量槲皮素等[8,9,10]。采用本实验方法,可同时检测罗布红麻和罗布白麻叶中的芦丁、金丝桃苷及异槲皮苷3种主要黄酮类成分的量,通过定量差异的比较,可以评价2种罗布麻的功效。与文献方法相比[10,11,12],采用本实验方法简便快速,色谱条件不需要进行梯度洗脱,就能将2个结构异构体(金丝桃苷和异槲皮苷)及结构很相近的芦丁很好地分离和定量测定,测定结果可靠。该研究为罗布麻药材的质量标准提供依据,同时也为罗布麻的制剂质量分析提供参考。
1 材料 1.1 材料与试剂对照品金丝桃苷(批号 10081444)、芦丁(批号 10081444)和异槲皮苷(批号 10081444)质量分数98%,购买于天津一方科技有限公司。乙腈为色谱纯,磷酸、乙醇等有机溶剂均为分析纯。实验材料罗布红麻和罗布白麻野生型成熟叶采集于新疆尉犁野外,栽培型幼叶为砂培法培养2个月的幼苗叶片,砂培用种子采集于中国科学院阜康荒漠生态站盐生植物园。新疆大学生物科学系石秋梅副教授鉴定为罗布麻属罗布红麻Apocynum venetum Linn. 和白麻属罗布白麻Poacynum hendersonii (Hook. f .) Woodson。
1.2 仪器与设备Agilent1100型高效液相色谱仪;BS200S电子天秤(北京赛利斯天平有限公司);水浴锅(上海苏达实验仪器有限公司)。
2 方法与结果 2.1 对照品溶液的制备分别精密称量对照品适量,用60%乙醇溶解,配制成含芦丁0.248 mg/mL、金丝桃苷0.048 mg/mL和异槲皮苷0.512 mg/mL的对照品溶液。
2.2 供试液溶液的制备将样品干燥,粉碎过60目筛,精密称取样品粉末0.4 g样品,置于圆底烧瓶中,加60%乙醇50 mL,80 ℃水浴条件下加热回流提取1 h,提取液放冷,过滤,用60%乙醇定容至50 mL,摇匀备用。过0.45 μm的微孔滤膜,即可上液相色谱仪测定。
2.3 色谱条件色谱柱:Agilent TC-C18柱(150 mm×4.6 mm,5 μm);流动相:乙腈-0.1%磷酸水溶液(16∶84);检测波长360 nm;体积流量1.0 mL/min;柱温40 ℃;进样量10 μL。
2.4 线性关系考察分别精密移取芦丁、金丝桃苷和异槲皮苷对照品溶液0.2,0.3、0.5、1.0、1.5、2.0 mL于10 mL量瓶中,用甲醇定容,进样前用0.45 μm滤膜滤过,按上述色谱条件分别测定峰面积,以峰面积为纵坐标(Y),进样量为横坐标(X)进行线性回归,回归方程分别为芦丁Y=8.464X-4.018,R2为0.999 2,线性范围4.96~49.6 μg/mL;金丝桃苷Y=1 3.02 X-2.189,R2为0.999 0,线性范围0.96~9.6 μg/mL;异槲皮苷Y=13.46 X-13.54,R2为0.997 0,线性范围10.24~102.4 μg/mL。
2.5 精密度试验取混合对照品溶液10 μL,按“2.3”项下色谱条件重复进样5次,芦丁、金丝桃苷和异槲皮苷峰面积的RSD分别为1.9%、2.6%、1.5%。
2.6 稳定性试验精密称取温室放置的同一供试用液,分别于0、3、6、9、12、24 h测定,芦丁、金丝桃苷和异槲皮苷峰面积的RSD分别为2.0%、2.8%、1.8%,供试品溶液在24 h内稳定。
2.7 重复性试验取罗布麻粉末,按“2.2”项制备供试品溶液,按上述色谱条件测定,平行操作5份,测得芦丁、金丝桃苷和异槲皮苷的平均质量分数分别为0.55%、0.07%、0.50%,RSD分别为2.1%、2.8%、2.4%。
2.8 加样回收率试验精密称取已测定的罗布麻样品粉末5份,每份0.4 g,分别精密加入与样品相当的芦丁、金丝桃苷和异槲皮苷2.480、0.240、2.048 mg,按“2.2”项制备溶液,按上述色谱条件测定,以外标法计算回收率。结果芦丁、金丝桃苷和异槲皮苷平均回收率分别为98.2%、92.3%、100.1%,RSD分别为1.5%、3.2%、2.7%。
2.9 样品测定按“2.2”项下方法将罗布红麻叶和罗布白麻叶制成供试品溶液,按上述色谱条件进样测定。对照品和样品HPLC图谱见图 1。利用峰面积,由线性方程计算得芦丁、金丝桃苷和异槲皮苷的质量分数见表 1。
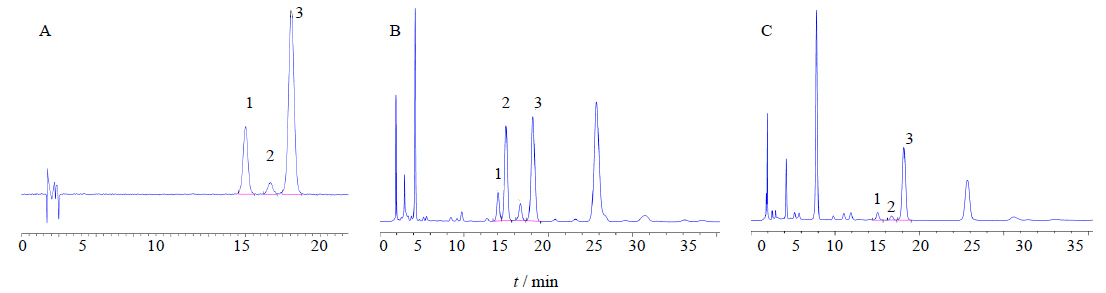 | 1-芦丁 2-金丝桃苷 3-异槲皮苷 1-rutin 2-hyperin 3-isoquercetrin图 1 混合对照品 (A)、罗布红麻叶 (B) 和罗布白麻叶 (C) 色谱图 Fig. 1 HPLCof mixed reference substances (A),leaves of A. venetum (B) and leaves of P. hendersonii (C) |
|
|
表 1 新疆产罗布红麻和罗布白麻叶中3种黄酮类化合物的量 Table 1 Determination of three kinds of flavonoids in leaves of A. venetum and P. hendersonii located in Xinjiang |
黄酮类化合物因分子中存在桂皮酰基及苯甲酰基组成的交叉共轭体系,故其甲醇溶液在200~400 nm的区域内存在2个主要的紫外吸收带,即峰带I(300~400 nm)及峰带II(220~280 nm)。由于溶剂作用的影响,在70%的乙醇溶液中,其紫外吸收光谱会发生一定的红移,但偏差不大。取芦丁、金丝桃苷和异槲皮苷对照品溶液,在在200~600 nm波长下扫描,结果三者均在360 nm处有较大紫外吸收,参阅相关文献报道[5],故选择360 nm为检测波长,在该波长处3个成分均有较强吸收,干扰少,且分离效果良好。
曾对热回流法和索氏提取法进行了比较,将对照品金丝桃苷溶液及提取液分别在200~600 nm波长下全波长扫描,结果表明,热回流法和索氏提取法获得的提取液的紫外全扫描图形状几乎完全相同,与对照品显示了相同的最大吸收波长,两者的提取率无明显差异,但由于热回流法操作简便,故选择热回流法提取。
本研究除了测定位于南疆(尉犁县)野生型罗布红麻和罗布白麻成熟叶片的黄酮类成分外,还测定了来源于北疆(阜康市)人工栽培罗布红麻和罗布白麻种子培养的幼苗叶片中的量,两者均表现出相似的规律。
对新疆产罗布红麻和罗布白麻叶中黄酮类成分量进行比较可知,所检测的3种黄酮类成分在罗布红麻中的量较罗布白麻高,尤其是芦丁,前者量接近异槲皮苷的量,而罗布白麻中量很低,但罗布白麻中的异槲皮苷量也很高,成熟叶中为0.41%,本课题组还对这2种罗布麻叶中的酸水解后总槲皮素量进行了测定,两者的量接近,均大于0.6%,因此罗布白麻也具有重要的药用价值。
此外,将新疆产罗布麻与其他产地罗布麻叶中3种黄酮类成分进行比较可知,新疆罗布红麻中的芦丁量很高,为0.55%,与异槲皮苷量相当,这与王李丽等[12]、王省超等[13]对新疆罗布红麻叶芦丁量测定结果一致,但An等[14]检测了辽宁、江苏、安徽、河南、山东、河北、天津、山西、甘肃、宁夏、内蒙古产的罗布红麻叶芦丁量,质量分数仅0.004%~0.012%;但新疆罗布白麻中的芦丁量很低,这也许正是张云峰等[6]从新疆罗布白麻叶中未分到芦丁的原因,这与强静等[15]和An等[14]对新疆罗布白麻叶芦丁量的检测结果一致。再者,新疆产2种罗布红麻的金丝桃苷量均很少,这与李奇等[13]的研究结果符合,对不同产地罗布红麻叶中主要黄酮类成分量的检测均表明,新疆产罗布红麻叶的金丝桃苷量很低,而其他产地(如安徽、辽宁)的量可达0.2%~0.3%,韩利文等[16]检测青海、山西、陕西、河北、广西和广东大叶白麻及罗布麻叶中金丝桃苷量平均分别是0.48%和 0.71%。由此可见,不同产地罗布麻叶黄酮类成分有所不同,尤其是新疆产罗布麻红麻的芦丁和金丝桃苷量与其他产地的差异非常大。《中国药典》2010年版已对罗布麻叶中的内容进行了修订,其中之一即以金丝桃苷量对罗布麻叶进行质量控制,但鉴于不同产地金丝桃苷量的巨大差异,若仅以金丝桃苷单个成分作为质量控制标准显然也是不合适的。
芦丁、金丝桃苷和异槲皮苷均为槲皮素与不同的糖形成的苷,经酸水解后可破坏其糖苷键获得槲皮素苷元,因此,在《中国药典》2010年版中即采用以酸水解后的总槲皮素量为质量标准,按干燥品计算,含槲皮素不得少于0.6%[5]。而本研究测定结果表明,罗布红麻和罗布白麻叶片中的异槲皮苷量均很高,质量分数为0.4%~0.55%,已有的文献报道也均表明不同产地罗布麻叶的异槲皮苷量高且稳定[14,15],故亦适宜作为罗布麻的质控指标。本方法的建立可作为罗布麻质量控制标准的有效补充,同时,该方法还可用于进一步鉴别区分新疆罗布红麻和罗布白麻。
| [1] | Grundmann O, Nakajima J I, Kamata K, et al. Kaempferol from the leaves of Apocynum venetum possesses anxiolytic activities in the elevated plus maze test in mice [J]. Phytomedicine, 2009, 16: 295-302. |
| [2] | Kuo C S, Wan C Y, Gong C L, et al. Apocynum venetum leaf aqueous extract inhibits voltage-gated sodium channels of mouse neuroblastoma N2A cells [J]. J Ethnopharmacol, 2011, 136(1): 149-155. |
| [3] | Xie W Y, Zhang X Y, Wang T, et al. Botany, traditional uses, phytochemistry and pharmacology of Apocynum venetum L. (Luobuma): A review [J]. J Ethnopharmacol, 2012, 141: 1-8. |
| [4] | Xiong, Q B, Fan W Z, Tezuka Y, et al. Hepatoprotective effect of Apocynum venetum and its active constituents [J]. Planta Med, 2000, 66, 127-133. |
| [5] | 中国药典 [S]. 一部. 2010. |
| [6] | 张云峰. 大花罗布麻的化学成分研究 [D]. 乌鲁木齐: 新疆医科大学, 2003. |
| [7] | 解成喜, 张丽静, 范维刚. 反相高效液相色谱法测定罗布麻叶中芦丁的含量 [J]. 天然产物研究与开发, 2005, 17: 59-61. |
| [8] | 高学敏. 中药学 [M]. 北京: 人民卫生出版社, 2000. |
| [9] | Zhang Y C, Liu C M, Zhang Z K, et al. Comprehensive separation and identification of chemical constituents from Apocynum venetum leaves by high-performance counter-current chromatography and high performance liquid chromatography coupled with mass spectrometry [J]. J Chromatogr B, 2010, 878: 3149-3155. |
| [10] | 郁韵秋, 龚纬珈, 李 端, 等. 高效液相色谱法同时测定罗布麻浸膏粉中金丝桃苷、异槲皮苷、槲皮素的含量 [J]. 复旦学报: 自然科学版, 2007, 46(3): 417-420. |
| [11] | 李 奇, 张月婵, 宋建平, 等. 不同产地罗布麻叶黄酮类成分分析 [J]. 中药材, 2009, 32(9): 1359-1362. |
| [12] | 王李丽, 程显隆, 赵英永, 等. RP-HPLC法测定罗布麻叶及其中成药中3个黄酮类成分的含量 [J]. 药物分析杂志, 2011, 31(5): 903-906. |
| [13] | 王省超, 孙 颖. 新疆罗布麻茶中芦丁和槲皮素的提取工艺研究 [J]. 新疆化工, 2011(4): 6-9. |
| [14] | An H J, Wang H, Lan Y X, et al. Simultaneous qualitative and quantitative analysis of phenolic acids and flavonoids for the quality control of Apocynum venetum L. leaves by HPLC-DAD-ESI-IT-TOF-MS and HPLC-DAD [J]. J Pharm Biomed Anal, 2013, 85: 295-304. |
| [15] | 强 静, 李 奇, 刘训红, 等. 大花罗布麻叶黄酮类成分的分析 [J]. 新疆中医药, 2009, 27(5): 31-34. |
| [16] | 韩利文, 侯晋军, 李云兰, 等. 高效液相色谱法比较不同种属和产地罗布麻叶中金丝桃苷的含量 [J]. 中国现代应用药学杂志, 2006, 23(5): 392-394. |
 2014, Vol. 45
2014, Vol. 45


