2. 广州中医药大学中医药数理工程研究院, 广东 东莞 523808
2. Dongguan Institution for Mathematics and Theoretics Engineering Research, Guangzhou University of Chinese Medicine, Dongguan 523808, China
狭基线纹香茶菜Isodon lophanthoides var. gerardianus (Benth.) H. Hara为唇形科香茶菜属植物,是中药溪黄草广东地区的主流品种,具有清利湿热、退黄利胆、凉血散瘀的功效,民间常用于治疗急性黄疸型肝炎、急性胆囊炎、咽喉炎、跌打瘀肿等疾病[1],为消炎利胆片、胆石通胶囊以及复方胆通胶囊的主要组方药材之一。近年来在化学和药理学领域对香茶菜属植物进行了大量的研究。大量药理实验表明狭基线纹香茶菜的水提液具有良好的抗炎、抗肿瘤、保肝活性,显示良好的开发前景[2, 3, 4]。但狭基线纹香茶菜水溶性部位提出的报道虽较多,药效物质基础不够明确,有待进一步深入研究。此外,溪黄草被载入《中国药典》2010年版,溪黄草各品种来源成分差异及药理药效差异尚不明确,质量标准缺乏,与其化学成分研究滞后有一定的关系。为进一步明确狭基线纹香茶菜的活性成分,本实验对狭基线纹香茶菜水溶性成分进行了研究,从中分离得到12个化合物,分别鉴定为新西兰牡荆苷II(vicenin II,1)、新西兰牡荆苷III(vicenin III,2)、异夏佛塔苷(isoschaftoside,3)、夏佛塔苷(schaftoside,4)、牡荆苷(vitexin,5)、芹菜素-6,8-二-C-α-L-吡喃阿拉伯糖苷(6,8-di-C-α-L- arabinosylapigenin,6)、芹菜素-7-O-葡萄糖醛酸苷(apigenin-7-O-glucuronide,7)、芹菜素-6-C-β-L-吡喃阿拉伯糖-8-C-α-L-吡喃阿拉伯糖苷(apigenin 6-C- β-L-arabinopyranoside-8-C-α-L-arabinopyranoside,8)、芹菜素-6-C-β-D-木糖-8-C-α-L-阿拉伯糖苷(apigenin 6-C-β-D-xylopyranosyl-8-C-α-L-arabinopyranoside,9)、咖啡酸(caffeic acid,10)、迷迭香酸(rosmarinic,11)、芦丁(rutin,12)。化合物1~9为首次从香茶菜属植物中分离得到,对各水溶性化合物进行抗肿瘤活性初步筛选,其中化合物1、6、11对HepG2细胞有较好的抑制作用。
1 仪器与材料LCQ Deca XP液-质联用仪;Bruker AVANCE III HD 500超导脉冲傅里叶变换核磁共振谱仪Shimadzu LC—8A型制备液相(手动进样,SPD—20A检测器,N2000工作站);Shimadzu PRC-ODS制备柱(250 mm×4.6 mm,7 μm);Shimadzu高效液相色谱仪(LC—20AT泵;SIL—20A自动进样器;SPD—20A二极管阵列检测器);Thermo Hypersil Gold C18色谱柱(250 mm×4.6 mm,5 μm);CP225D十万分之一电了天平(德国Sartorius公司);BP11OS万分之一天平(德国Sartorius公司);KQ3200DE医用数控超声清洗器(昆山市超声仪器有限公司);ODS-A(50 μm,YMC);Sephadex LH-20(General Electric Company);D-101大孔吸附树脂(安徽三星树脂科技有限公司);80~100目聚酰胺色谱粉(台州路桥四甲生化塑料厂)。
狭基线纹香茶菜2012年10月采于广东饶平基地,由广州中医药大学新药开发研究中心陈建南研究员鉴定为香茶菜属植物狭基线纹香茶菜Isodon lophanthoides var. gerardianus (Benth.) H. Hara地上部分,标本(20121022)保存于广州中医药大学新药开发研究中心。
2 提取与分离取狭基线纹香茶菜干燥药材(7 kg),水煎提3次,每次1.5 h,趁热滤过,合并滤液,将滤液浓缩至小体积,然后过D-101大孔吸附树脂,水洗至颜色较淡,95%乙醇洗脱,收集95%乙醇洗脱液,减压浓缩至无醇味,加水稀释,依次用石油醚、醋酸乙酯充分萃取,将剩下的水液减压回收除去少量的有机溶剂,加水稀释混匀,过D-101大孔树脂,依次用水、95%乙醇洗脱,收集95%乙醇洗脱液,浓缩回收乙醇,加水稀释,过聚酰胺(80~100目)色谱,依次用水及10%、30%、50%乙醇洗脱,分别得到4部分溶剂的洗脱液。
水洗脱液(A)减压浓缩至小体积,过Sephdex LH-20凝胶柱色谱,甲醇-水(1∶1)等度洗脱,得到色素层和黄酮层,黄酮层减压浓缩至小体积,过ODS,甲醇-水(20∶80→25∶75→30∶70→40∶60→50∶50)梯度洗脱,合并相同组分,反复过ODS进一步纯化,重结晶,分离得化合物1(88.2 mg)、2(16.3 mg)、3(125.6 mg)、4(98.1 mg)、5(24.9 mg)。同样的,10%乙醇洗脱液(B)过Sephdex LH-20凝胶柱色谱和反复过ODS,分离得化合物6(36.5 mg)、7(16.8 mg)、8(14.3 mg),30%乙醇洗脱液(C)分离得化合物9(12.0 mg)、10(8.3 mg)。
醋酸乙酯萃取层,回收醋酸乙酯,加水,超声,80 ℃水浴加热溶解,过D-101大孔吸附树脂,依次用水、30%乙醇洗脱,收集30%乙醇洗脱液,回收乙醇,过Sephdex LH-20凝胶柱色谱,甲醇-水(1∶1)洗脱,得色素层和药液层(E),E部位回收甲醇,过ODS,甲醇-水(20∶80→25∶75→30∶70→40∶60→50∶50)梯度洗脱,合并相同组分,反复过ODS进一步纯化,得化合物11(20.1 mg)、12(10.6 mg)。
3 结构鉴定
化合物1:淡黄色粉末。三氯化铁反应呈阳性,提示有酚羟基,薄层色谱,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,可能为黄酮。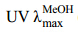 (nm): 271,334。ESI-MS m/z: 593 [M-H]-,473 [M-H-120]-,503 [M-H-90]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.76 (1H,s,5-OH),8.03 (2H,d,J = 7.2 Hz,H-2′,6′),6.92 (2H,d,J = 8.0 Hz,H-3′,5′),6.81 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物1为新西兰牡荆苷II。
(nm): 271,334。ESI-MS m/z: 593 [M-H]-,473 [M-H-120]-,503 [M-H-90]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.76 (1H,s,5-OH),8.03 (2H,d,J = 7.2 Hz,H-2′,6′),6.92 (2H,d,J = 8.0 Hz,H-3′,5′),6.81 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物1为新西兰牡荆苷II。
化合物2:淡黄色粉末,常温下可在水中析出絮状沉淀。三氯化铁反应呈阳性,提示有酚羟基,薄层色谱,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,推测为黄酮。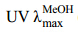 (nm): 271,334。ESI-MS m/z: 563 [M-H]-,473 [M-H-90]-,443 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.76 (1H,s,5-OH),7.96 (2H,d,J = 8.8 Hz,H-2′,6′),6.96 (2H,d,J = 8.8 Hz,H-3′,5′),6.79 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物2为新西兰牡荆苷III。
(nm): 271,334。ESI-MS m/z: 563 [M-H]-,473 [M-H-90]-,443 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.76 (1H,s,5-OH),7.96 (2H,d,J = 8.8 Hz,H-2′,6′),6.96 (2H,d,J = 8.8 Hz,H-3′,5′),6.79 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物2为新西兰牡荆苷III。
化合物3:黄色粉末,溶于热水,三氯化铁反应呈阳性,提示有酚氢基,聚酰胺薄层,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,推测为黄酮。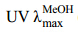 (nm): 271,336。ESI-MS m/z: 563 [M-H]-,503 [M-H-60]-,473 [M-H-90]-,443 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.67 (1H,s,5-OH),8.03 (2H,d,J = 8.0 Hz,H-2′,6′),6.90 (2H,d,J = 8.0 Hz,H-3′,5′),δ 6.81 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[5],故鉴定化合物3为异夏佛塔苷。
(nm): 271,336。ESI-MS m/z: 563 [M-H]-,503 [M-H-60]-,473 [M-H-90]-,443 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.67 (1H,s,5-OH),8.03 (2H,d,J = 8.0 Hz,H-2′,6′),6.90 (2H,d,J = 8.0 Hz,H-3′,5′),δ 6.81 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[5],故鉴定化合物3为异夏佛塔苷。
化合物4:黄色粉末,三氯化铁反应呈阳性,提示含有酚羟基,聚酰胺薄层,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,推测为黄酮。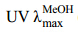 (nm): 271,336。ESI-MS m/z: 563 [M-H]-,503 [M-H-60]-,473 [M-H-90]-,443 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.82 (1H,s,5-OH),8.11 (2H,d,J = 8.0 Hz,H-2′,6′),6.91 (2H,d,J = 8.0 Hz,H-3′,5′),6.82 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4, 5],故鉴定化合物4为夏佛塔苷。
(nm): 271,336。ESI-MS m/z: 563 [M-H]-,503 [M-H-60]-,473 [M-H-90]-,443 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.82 (1H,s,5-OH),8.11 (2H,d,J = 8.0 Hz,H-2′,6′),6.91 (2H,d,J = 8.0 Hz,H-3′,5′),6.82 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4, 5],故鉴定化合物4为夏佛塔苷。
| 表 1 化合物1~9的13C-NMR (125 MHz,DMSO-d6) 数据 Table 1 13C-NMR data of aglycone moieties in compounds 1—9 (125 MHz,DMSO-d6) |
化合物5:黄色粉末,三氯化铁反应呈阳性,提示含有酚羟基,聚酰胺薄层,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,推测为黄酮。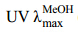 (nm): 268,336。ESI-MS m/z: 431 [M-H]-,373 [M-H-60]-,341 [M-H-90]-,311 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.17 (1H,s,5-OH),10.82 (1H,s,7-OH),10.35 (1H,s,4′-OH),6.79 (1H,s,H-6),8.03 (2H,d,J = 8.0 Hz,H-2′,6′),6.90 (2H,d,J = 8.0 Hz,H-3′,5′),6.28 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[6],故鉴定化合物5为牡荆苷。
(nm): 268,336。ESI-MS m/z: 431 [M-H]-,373 [M-H-60]-,341 [M-H-90]-,311 [M-H-120]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.17 (1H,s,5-OH),10.82 (1H,s,7-OH),10.35 (1H,s,4′-OH),6.79 (1H,s,H-6),8.03 (2H,d,J = 8.0 Hz,H-2′,6′),6.90 (2H,d,J = 8.0 Hz,H-3′,5′),6.28 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[6],故鉴定化合物5为牡荆苷。
化合物6:黄色粉末,三氯化铁反应呈阳性,提示含有酚羟基,聚酰胺薄层,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,可能为黄酮。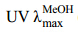 (nm): 271,335。ESI-MS m/z: 533 [M-H]-,443 [M-H+90]-,383 [M-H-90-60]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.79 (1H,s,OH-5),8.15 (2H,brs,H-2′,6′),6.91 (2H,d,J = 8.8 Hz,H-3′,5′),6.78 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物6为芹菜素-6,8-二-C-α-L-吡喃阿拉伯糖苷。
(nm): 271,335。ESI-MS m/z: 533 [M-H]-,443 [M-H+90]-,383 [M-H-90-60]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.79 (1H,s,OH-5),8.15 (2H,brs,H-2′,6′),6.91 (2H,d,J = 8.8 Hz,H-3′,5′),6.78 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物6为芹菜素-6,8-二-C-α-L-吡喃阿拉伯糖苷。
化合物7:黄色粉末,三氯化铁反应呈阳性,提示含有酚羟基,聚酰胺薄层,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,可能为黄酮。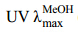 (nm): 268,337。ESI-MS m/z: 445 [M-H]-,361,300,269,255,201。1H-NMR (500 MHz,DMSO-d6) δ: 12.98 (1H,s,5-OH),6.85 (2H,d,J = 8.2 Hz,H-2′,6′),6.91 (2H,d,J = 8.2 Hz,H-3′,5′),7.89 (2H,d,J = 2.1 Hz,H-6,8),6.42 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[7],故鉴定化合物7为芹菜素-7-O-葡萄糖醛酸苷。
(nm): 268,337。ESI-MS m/z: 445 [M-H]-,361,300,269,255,201。1H-NMR (500 MHz,DMSO-d6) δ: 12.98 (1H,s,5-OH),6.85 (2H,d,J = 8.2 Hz,H-2′,6′),6.91 (2H,d,J = 8.2 Hz,H-3′,5′),7.89 (2H,d,J = 2.1 Hz,H-6,8),6.42 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[7],故鉴定化合物7为芹菜素-7-O-葡萄糖醛酸苷。
化合物8:黄色粉末,三氯化铁反应呈阳性,提示含有酚羟基,聚酰胺薄层,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,推测为黄酮。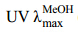 (nm): 271,335。ESI-MS: m/z 533 [M-H]-,443 [M-H-90]-,383 [M-H-90-60]-。1H-NMR (500 MHz,DMSO-d6) δ: 14.00 (1H,s,OH-5),10.03 (1H,s,H-4′),10.14 (1H,s,H-7),8.30 (2H,brs,H-2′,6′),6.88 (2H,d,J = 8.0 Hz,H-3′,5′),6.84 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[8],故鉴定化合物8为芹菜素-6-C-β-L-吡喃阿拉伯糖-8-C- α-L-吡喃阿拉伯糖苷。
(nm): 271,335。ESI-MS: m/z 533 [M-H]-,443 [M-H-90]-,383 [M-H-90-60]-。1H-NMR (500 MHz,DMSO-d6) δ: 14.00 (1H,s,OH-5),10.03 (1H,s,H-4′),10.14 (1H,s,H-7),8.30 (2H,brs,H-2′,6′),6.88 (2H,d,J = 8.0 Hz,H-3′,5′),6.84 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[8],故鉴定化合物8为芹菜素-6-C-β-L-吡喃阿拉伯糖-8-C- α-L-吡喃阿拉伯糖苷。
化合物9:黄色粉末,三氯化铁反应呈阳性,提示含有酚羟基,聚酰胺薄层,喷10% AlCl3乙醇溶液,365 nm紫外灯下检查,亮黄色斑点,推测为黄酮。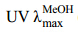 (nm): 271,337。ESI-MS m/z: 533 [M-H]-,473 [M-H-60]-,443 [M-H-90]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.79 (1H,s,OH-5),8.15 (2H,brs,H-2′,6′),6.91 (2H,d,J = 8.8 Hz,H-3′,5′),6.78 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物9为芹菜素-6-C-β-D-木糖-8-C-α-L-阿拉伯糖苷。
(nm): 271,337。ESI-MS m/z: 533 [M-H]-,473 [M-H-60]-,443 [M-H-90]-。1H-NMR (500 MHz,DMSO-d6) δ: 13.79 (1H,s,OH-5),8.15 (2H,brs,H-2′,6′),6.91 (2H,d,J = 8.8 Hz,H-3′,5′),6.78 (1H,s,H-3)。13C-NMR (125 MHz,DMSO-d6) 数据见表 1。上述数据与文献报道基本一致[4],故鉴定化合物9为芹菜素-6-C-β-D-木糖-8-C-α-L-阿拉伯糖苷。
化合物10:白色针晶(甲醇),浓硫酸-香草醛显紫红色。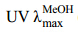 (nm): 323。ESI-MS m/z: 179 [M-H]-,163 [M-OH]-,145,135 [M-COOH]-。1H-NMR (500 MHz,DMSO-d6) δ: 7.49 (1H,J = 15.8 Hz,H-7),7.02 (1H,d,J = 2.1 Hz,H-2),6.94 (1H,dd,J = 8.5,2.0 Hz,H-6),6.77 (1H,d,J = 8.5 Hz,H-5),6.23 (1H,d,J = 15.8 Hz,H-8)。以上数据、UV及HPLC图谱与咖啡酸对照品比较基本一致,故鉴定化合物10为咖啡酸。
(nm): 323。ESI-MS m/z: 179 [M-H]-,163 [M-OH]-,145,135 [M-COOH]-。1H-NMR (500 MHz,DMSO-d6) δ: 7.49 (1H,J = 15.8 Hz,H-7),7.02 (1H,d,J = 2.1 Hz,H-2),6.94 (1H,dd,J = 8.5,2.0 Hz,H-6),6.77 (1H,d,J = 8.5 Hz,H-5),6.23 (1H,d,J = 15.8 Hz,H-8)。以上数据、UV及HPLC图谱与咖啡酸对照品比较基本一致,故鉴定化合物10为咖啡酸。
化合物11:黄色油状物,TLC对5%三氯化铁显蓝黑色。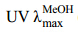 (nm): 329。UV及HPLC图谱与迷迭香酸对照品一致,故鉴定化合物11为迷迭香酸。
(nm): 329。UV及HPLC图谱与迷迭香酸对照品一致,故鉴定化合物11为迷迭香酸。
化合物12:黄色粉末,盐酸镁粉反应显阳性,Molish反应阳性。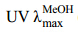 (nm): 255,359。UV及HPLC图谱与芦丁对照品比较一致,故鉴定化合物12为芦丁。
(nm): 255,359。UV及HPLC图谱与芦丁对照品比较一致,故鉴定化合物12为芦丁。
HepG2细胞使用RPMI 1640完全培养基培养,10%胎牛血清,1%抗生素(10 000 U/mL青霉素、10 000 U/mL链霉素),在含5% CO2孵箱中于37 ℃培养。细胞生长至80%时传代,使细胞保持在对数生长期。取化合物1~12用RPMI 1640完全培养液配制成储备液。MTT用PBS液配成5 mg/mL的母液,于4 ℃避光保存。将消化计数的单细胞悬液加入96孔板中,细胞浓度为1.0×105个/mL,每孔加入单细胞悬液100 μL,每组设6个复孔。培养24 h后弃去培养液,分别加入200 μL下述各培养液:RPMI 1640培养液(阴性对照);不同浓度的化合物培养液(终浓度分别为0.2、0.5、0.8、1.1、1.4、1.7、2.0、2.3 μmol/L)。给药48 h后,弃去培养液,每孔加入100 μL的MTT液,继续培养4 h后弃去上清,加入DMSO后震荡,在酶标仪(Molecular Devices公司,Spoctra Max190型)490 nm波长处读取吸光度(A)值。重复实验3次,按公式计算各组的生长抑制率(IR,IR=1-A药物组/A对照组)。用SPSS 20.0软件计算IC50值。
5 结果及讨论狭基线纹香茶菜水提液具有抗炎、保肝及抑制HepG2细胞增殖作用,黄酮类及酚酸类均具有较强的抗炎活性。本实验从传统中医药水煎提液出发,分离水溶性单体成分,并首次研究狭基线纹香茶菜水溶性单体成分体外对肿瘤细胞HepG2增殖的抑制作用。结果显示化合物1、6、11对HepG2有较强的增殖抑制作用,IC50分别为(2.14±0.40)、(1.55±0.47)、(1.49±0.49)μmol/L,见图 1。
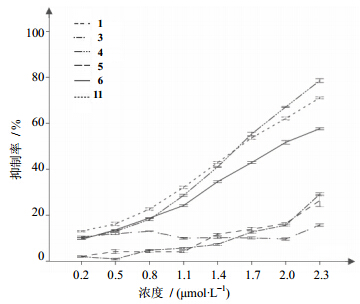 | 图 1 水溶性单体化合物对HepG2细胞增殖的抑制作用 (x±s,n = 6)Fig. 1 Inhibitory effect of tested water-soluble compounds on proliferation of HepG2 cells (x±s,n = 6) |
本实验通过对狭基线纹香茶菜水溶性成分分析,发现其水溶性成分以水溶性黄酮苷和酚酸类为主,尤其是水溶性黄酮碳苷类成分较多。近年来,溪黄草资源的开发与利用越来越引起人们的重视。狭基线纹香茶菜水溶性总黄酮和总酚酸类有待进一步的药理药效研究。本实验揭示了狭基线纹香茶菜水溶性化学成分,为抗肿瘤、抗炎、保肝等天然药物的开发及溪黄草资源的开发利用提供了新的线索。
| [1] | 广东省中药材标准 [S]. 2004. |
| [2] | 廖雪珍, 廖惠芳, 叶木荣, 等. 线纹香茶菜、狭基线纹香茶菜、溪黄草水提物抗炎、保肝作用初步研究 [J]. 中药材, 1996, 19(7): 363-365. |
| [3] | 侯少贞, 梁颖敏, 张 洁, 等. 狭基线纹香茶菜保肝、利胆的实验研究 [J]. 中药新药与临床药理, 2010, 21(6): 605-608. |
| [4] | Lin Y, Kong L. Sudies on the chemical constituents of Desmodium styracifolium (Osbeck) Merr [J]. Asian J Trad Med, 2006, 1(1): 34-36. |
| [5] | Chen X, Nigel C V, Peter J H, et al. Flavone C-Glycosides from Viola yedoensis Makino [J]. Chem Pharm Bull, 2003, 51(10): 1204-1207. |
| [6] | Hu Y M, Ye W C, Li Q, et al. C-glycosylflavones from Stellaria media [J]. Chin J Nat Med, 2006, 4(6): 420-424. |
| [7] | 孙 嘏. 撑篙竹竹叶化学成分及其生物活性的研究 [D]. 北京: 中国林业科学研究院, 2010. |
| [8] | Dou H, Zhou Y, Chen C X, et al. Chenmical constituents of the aerial parts of Schnabelia tetradonta [J]. J Nat Prod, 2002, 65(12): 1777-1781. |
 2014, Vol. 46
2014, Vol. 46


