甘遂Euphorbia kansui Liou为大戟科(Euphorbiaceae)大戟属Euphorbia L. 多年生草本植物,为我国特有植物;主要分布于陕西、河南、山西、甘肃和宁夏等地,陕西是甘遂的道地产区。其干燥块根为我国传统中药,味苦,性寒,有毒,有除水、利尿功效,主治各种水肿、腹水、血吸虫病、咳喘、肿瘤等症,历代本草和《中国药典》中都有收载[1, 2]。此外,现代研究发现甘遂还具有显著的抗癌、抗病毒等活性[3, 4]。近年来,对甘遂的化学成分和生理活性的研究较多,本文就其生物学特性、化学成分以及药理作用方面的研究报道进行综述,为甘遂的进一步研究和开发应用提供理论基础。
1 生物学特性甘遂为多年生有毒草本植物,全株含有白色乳汁;根圆柱状,末端呈念珠状膨大;茎自基部多分枝;叶互生,线状披针形、线性或线状椭圆形,变化较大;杯状聚伞花序单生于二岐分枝顶端;种子长球状,灰褐色至浅褐色;花期为4~6月,果期6~8月。甘遂常生长在荒坡、沙地、田边、低山坡、路旁等[5]。甘遂的块根是传统中药,块根是由次生生长形成的,当主根增大到一定程度时,其木栓形成层便向内产生较多的栓内层薄壁细胞,从而直径增粗形成块根,甘遂块根的这种形成方式属于一种异常次生生长。其成熟的块根由周皮、中柱鞘薄壁组织和次生维管组织组成,其中含有大量的薄壁细胞[6]。
2 化学成分甘遂化学成分已有深入研究,主要为二萜和三萜类化合物,存在于其根、茎、叶及其乳汁中。近年来,国内学者也对甘遂生药以及炮制后的化学成分进行了研究。
2.1 二萜类化合物甘遂中的二萜类化合物是其主要的有效成分,可分为2种类型:巨大戟二萜醇型和假白榄酮型。其中巨大戟二萜醇型酯类有显著的抗癌、抗病毒活性,并且也是其主要的刺激性和毒性成分。
王立岩[7]采用多种分离手段从甘遂中分离得到26种二萜类化合物,其中巨大戟二萜醇型化合物21种,假白榄酮型化合物5种,新鉴定的化合物有13种。潘勤等[3]从甘遂中分离出了6种巨大戟萜醇型二萜酯类化合物,并确定了其中的2种化合物巨大戟萜醇-3-(2,4-癸二烯酯)-20-乙酸 [ingenol-3-(2,4- decadienoate)-20-acetate] 和甘遂大戟萜酯C(kansuiphorin C)的结构。刘悦等[8]对甘遂的氯仿萃取物中的二萜类化合物进行研究,共鉴别出39种二萜类化合物。其中包括23种已知的巨大戟二萜醇型化合物和7种已知的假白榄酮型化合物,以及新鉴定的4种巨大戟二萜醇型化合物和5种假白榄酮型化合物。陈云利等[9]从甘遂中分离得到3种大环二萜:甘遂宁D1(kansuinin D1)、甘遂宁D(kansuinin D)和甘遂宁A(kansuinin A)。Guo等[10]从甘遂的根中分离出1种新型的假白榄酮型二萜化合物kansuinine J。甘遂中分离的二萜类化合物及其结构见图 1和表 1。
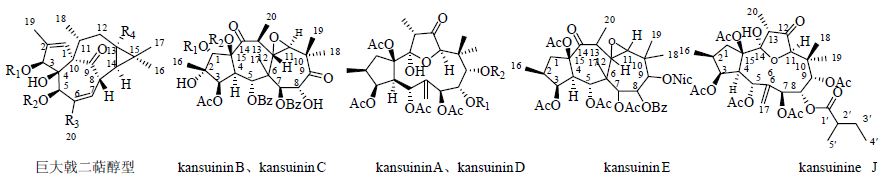 | 图 1 甘遂中的二萜类化合物结构Fig. 1 Structures of diterpenoids in E. kansui |
| 表 1 甘遂中的二萜类化合物 Table 1 Diterpenoids in E. kansui |
甘遂中三萜类化合物和二萜类化合物一样,也具有广泛的生理活性[11]。甘遂中的三萜类化合物主要有大戟醇型和甘遂醇型2种类型。从甘遂中分离得到的三萜类化合物有大戟二烯醇(euphol)、甘遂甾醇(tirucallol)、kansenonol、kansenone、epi- kansenone、11-oxo-kansenonol、kansenol[7]和kansuinone[12, 13, 14, 15]。
2.3 甾体化合物甾体化合物是一类重要的活性物质,具有抑制肿瘤细胞、调节免疫功能和抗生育等多种药理作用。王立岩[7]从甘遂中分离得到了3种甾体化合物:β-谷甾醇(β-sitosterol)、stigmast-5-ene-3β,7β-diol、stigmast-5-ene-3β,7α-diol。彭勍等[16]采用硅胶柱色谱、ODS柱色谱和高效液相色谱等多种分离手段首次从甘遂中得到8种C21甾体类化合物,它们分别为caudatin、kidjolani、penupogenin、caudatin 3-O-β- cymaropyranoside、kidjolanin 3-O-β-cymaropyranoside、kidjolanin 3-O-β-cymaropyranosyl-(1→4)-β-cymaropy- ranoside、caudatin 3-O-β-cymaropyranosyl-(1→4)-β- cymaropyranoside、caudatin 3-O-β-cymaropyranosyl-(1→ 4)-β-cymaropyranosyl-(1→4)-β-cymaropyranoside。
2.4 其他甘遂中还含有一些其他类成分,如异东莨菪亭素(isoscopletin)、棕榈酸(palmitic acid)[7]、1,1-二-(2,6-二羟基-3-乙酰基-4-甲氧基苯基) 甲烷、甲基 (2,4-二羟基-3-甲酰基-6-甲氧基) 苯基酮[17]、草酸、鞣质、树脂、葡萄糖、蔗糖、淀粉和维生素B1[18]。
3 药理作用 3.1 抗肿瘤作用甘遂中的二萜类化合物和三萜类化合物都具有抗肿瘤作用,甘遂根提取物在民间被广泛地用于治疗肿瘤。甘遂的乙醇提取物可以抑制人类HepG2细胞株的生长[19]。将甘遂提取物作用于小鼠移植的肿瘤瘤株Hep和S180,发现提取物可明显抑制小鼠瘤细胞的生长[20],随后采用台盼蓝染色法、MTT比色法、克隆形成法以及流式细胞仪检测发现甘遂提取物对人上皮样肝癌BEL-7402细胞的生长也有明显的抑制作用,且效果随提取物浓度的增加而递增,故推测甘遂提取物可能通过破坏肿瘤细胞的细胞膜和线粒体进而抑制肿瘤细胞的生长[21]。甘遂大戟萜酯A(kansuiphorin A)和大戟萜酯B(kansuiphorin B)在剂量分别为0.1、0.5 mg/kg时均有显著抗P338淋巴细胞白血病活性[22]。另外,甘遂大戟萜酯A还对一些人体癌细胞有选择性细胞毒性,包括非小细胞肺癌、结肠癌、黑色素瘤、肾脏癌细胞及白血病(HL-60TB)等[23]。从甘遂95%的醇提物中得到的甘遂大戟萜酯也有显著的抗白血病作用[24]。曹艳等[25]研究了甘遂醇提物、醋酸乙酯及环己烷萃取物对体外培养的MCF-7、A549、HspG2肿瘤细胞的作用,发现甘遂的醇提取物及不同极性溶剂萃取物对体外培养的MCF-7肿瘤细胞都有显著的抑制作用,而甘遂的醋酸乙酯和环己烷萃取物仅在高浓度时对A549和HepG2细胞增殖有抑制作用,所以甘遂抗肿瘤成分可能存在于醋酸乙酯及环己烷的萃取部位。
3.2 抗病毒作用近年的研究表明,甘遂提取物对肺炎、肝炎以及流感病毒等具有显著的抑制作用。郑维发等[4]发现甘遂醇提取物中的4种二萜类化合物甘遂大戟萜酯A、13-十一酰基-3-(2,4-二甲基丁酰基) 巨大戟萜酯、3-(癸-2,4-二烯酰基) 巨大戟萜酯及甘遂大戟萜酯A均对鸡新城疫病毒有明显的抑制作用;并给感染流感病毒亚甲型小鼠肺炎适应株FM1的小鼠ig这4种化合物,均表现出有效的体内抗病毒活性[26],这些成分的抗病毒活性可能是通过刺激淋巴细胞的增殖,进而增强杀伤病毒感染细胞的能力而实现的[27]。另外,从甘遂中得到的巨大戟二萜醇型二萜酯类化合物对人类免疫缺陷病毒(HIV)也有很强的抑制作用[28]。
3.3 抗生育作用甘遂注射液具有抗生育、引产的作用[29, 30],并且甘遂药材和含甘遂复方制剂对小鼠均有终止中期妊娠的作用[31]。对甘遂注射液中起引产作用的有效成分进行研究,发现其为四环三萜类化合物,并进一步确定为大戟二烯醇(euphol)[32]。
3.4 抑制细胞分裂的作用Wang等[33]从甘遂根的提取物中分离出了12种多环二萜类化合物,其中9种巨大戟二萜醇型化合物均具有非常显著的抑制胚胎细胞分裂的活性,而3种假白榄酮型化合物只有甘遂宁B显示这一活性。大部分抑制细胞分裂的二萜类化合物也具有抑制拓扑异构酶II的活性[34]。大戟烷/甘遂烷型三萜类化合物中,C-7位有酮羰基的4种化合物显示出一定的抑制细胞分裂的活性[35]。
3.5 杀虫作用目前,化学杀虫剂的大量使用已对自然生态环境造成了严重影响。近来有研究报道甘遂具有杀虫作用,所以作为植物性农药甘遂也具有广泛的开发前景。潘实清等[36]研究了甘遂的乙醚、乙醇、丙酮以及水提取物对致倦库蚊和白纹伊蚊幼虫的杀伤作用,结果表明甘遂的乙醚和乙醇提取物对致倦库蚊和白纹伊蚊幼虫有显著的杀伤作用,而水提取物无杀伤作用。所以推断甘遂杀虫的主要成分为脂溶性成分。甘遂根的甲醇提取物中3-O-(2,3-dimethyl- butanoyl)-13-O-dodecanoylingenol和3-O-(2′E,4′Z- decadienoyl)-ingenol 2种二萜类物质都有抗稻褐飞虱活性,而且前者还有抗二斑叶螨活性[37]。还有研究发现甘遂具有抗线虫[38]、抗日本白蚁[39]活性。
3.6 抗氧化作用甘遂具有抗氧化和抗疲劳的特性,甘遂提取物中半乳糖苷和葡萄糖苷衍生物可以增强超氧化物歧化酶(SOD)和谷胱甘肽过氧化酶(GSH-PX)的活性,减少过氧化物和羟基乙基的产生,抑制脂质过氧化增加,对小鼠运动导致的氧化压力具有一定的保护作用[40]。
3.7 对免疫系统的作用甘遂的粗提取物能够明显抑制绵羊红细胞(SRBC)诱导的迟发型过敏反应,说明甘遂对免疫系统有抑制作用[41]。
3.8 对肠道影响从传统的功效应用来看,甘遂的主要作用是峻下逐水,通过泻下通便而利小便以达到排水的目的。甘遂能刺激肠管,促进肠蠕动,产生泻下作用。60%的甘遂醇提取物对家兔的离体回肠平滑肌张力有兴奋作用,表现为肠道的蠕动大幅度增加,强度增强[42]。甘遂提取物会促进小鼠腹泻,抑制小肠平滑肌收缩,引起肠黏膜炎症反应[43]。
3.9 毒性作用甘遂对皮肤、黏膜有较强的刺激作用,对炎症细胞具有强烈的刺激作用,引起炎症反应。甘遂根的95%的乙醇提取物中kansuinine B、kansuinine A、3-O-(20E,40Z-decadienoyl)-20-O-acetylingenol可以显著促进小鼠脾脏淋巴细胞(SPL)的扩增和小鼠腹膜巨噬细胞NO的产生[44]。通过代谢组学的研究发现甘遂会引起小鼠内生代谢物改变,使内脏环境紊乱[45]。甘遂生品能够显著抑制人正常肝细胞的增殖,但醋制后可以降低对肝细胞的毒性。
4 结语甘遂是我国传统中药,历版《中国药典》都有收载。其化学成分比较复杂,主要药用成分为二萜和三萜类化合物,生物活性多样,具有抗肿瘤、抗病毒、抗生育、杀虫等生理作用。此外,甘遂作为生物农药也有很好的开发前景。但是,近年来,关于甘遂的研究成果大多集中在化学成分、药理和毒性作用方面,对其炮制减毒机制尚不明确。目前,甘遂均为野生,而关于其生长发育及其各器官中药用成分积累规律尚缺乏系统研究。此外,其药用成分主要存在于植物体乳汁管的乳汁中,所以,乳汁管的发育与萜类物质的合成、转运及积累有密切关系。为此,开展上述方面的研究,可为甘遂的人工栽培以及适时采收,提高药材产量和质量提供科学依据。
| [1] | 中国科学院西北植物研究所编著. 秦岭植物志 (第一卷第三分册) [M]. 北京: 科学出版社, 1974. |
| [2] | 中国药典 [S]. 一部. 2010. |
| [3] | 潘 勤, 闵知大. 甘遂中巨大戟萜醇型二萜酯类化学成分的研究 [J]. 中草药, 2003, 34(6): 489-492. |
| [4] | 郑维发. 甘遂醇提物中4种二萜类化合物的体内抗病毒活性研究 [J]. 中草药, 2004, 35(1): 65-68. |
| [5] | 中国科学院中国植物志编辑委员会. 中国植物志 (第44卷) [M]. 北京: 科学出版社, 1997. |
| [6] | 任 毅, 金玉姬, 胡正海. 甘遂块根的发育解剖学研究 [J]. 西北植物学报, 1995, 15(2): 104-109. |
| [7] | 王立岩. 甘遂的化学成分及其生物活性研究 [D]. 沈阳: 沈阳药科大学, 2003. |
| [8] | 刘 悦, 刘志强, 李慧琳, 等. 传统中药甘遂根中二萜类化学成分的电喷雾质谱研究 [J]. 高等学校化学学报, 2008, 29(9): 1727-1735. |
| [9] | 陈云利, 袁 丹, 徐 鑫, 等. 甘遂中麻风树烷型大环二萜类化学成分研究 [J]. 中国中药杂志, 2008, 33 (15): 18-36. |
| [10] | Guo J, Fang X, Di Y T, et al. Kansuinine J, a new macrocyclic diterpenoid from the roots of Euphorbia kansui [J]. Chin Chem Lett, 2010, 21: 943-946. |
| [11] | Yasukawa K, Akihisa T, Yoshida Z Y. et al. Inhibitory effect of euphol, a triterpene alcohol from the roots of Euphorbia kansui, on tumour promotion by 12-O-tetradecanoyl phorbol-13-acetate in two-stage carcinogenesis in mouse skin [J]. Pharm Pharmacol, 2000, 52(1): 119-124. |
| [12] | 张本印, 王 环, 沈建伟, 等. 大戟属三萜类结构及生物活性 [J]. 化学进展, 2010, 22(5): 877-887. |
| [13] | Guo J, He H P, Fang X, et al. Kansuinone, a novel euphane-type triterpene from Euphorbia kansui [J]. Tetrahedron Lett, 2010, 51: 6286-6289. |
| [14] | Bernd S, Erich H. Chemisty of ingenoII esters of ingenol and 7, 8-isoingenol [J]. Zeitschrift für Naturforschung. Teil B: Anorganische Chemie, Organische Chemie, 1982, 37B(6): 748-756. |
| [15] | Gewall M B, Hattori M, Tezuka Y, et al. Constituents of the latex of Euphorbia antiquorum [J]. Phytochemistry, 1990, 29: 1625-1628. |
| [16] | 彭 勍, 李国玉, 张 珂, 等. 甘遂的C21甾体类化学成分 [A]// 中华中医药学会中药炮制分会2009年学术研讨会论文集 [C]. 武汉: 中华中医药学会, 2009. |
| [17] | Ding Y L, Jia Z J. Two phenolic derivatives from Euphorbia kansui [J]. Phytochemistry, 1992, 31(4): 1435-1436. |
| [18] | 郭晓庄. 有毒中草药大辞典 [M]. 天津: 天津科技翻译出版公司, 1992. |
| [19] | Whelan L C, Ryan M F. Ethanolic extracts of Euphorbia and other ethnobotanical species as inhibitors of human tumour cell growth [J]. Phytomedicine, 2003, 10: 53-58. |
| [20] | 陈 亮, 于志敏. 甘遂提取物对肿瘤瘤株Hep、S180的抑制作用观察 [J]. 中国现代医药杂志, 2008, 10(7): 6-8. |
| [21] | 陈 亮. 甘遂提取物对人上皮样肝癌BEL-7402的体外实验研究 [J]. 西北植物学报, 2008, 28(9): 1889-1892. |
| [22] | Wu T S, Lin Y M, Haruna M, et al. Kansuiphorins A and B, two novel antileukemic diterpene esters from Euphorbia kansui [J]. J Prod, 1991, 54(3): 823-829. |
| [23] | 刘春安, 彭 明. 抗癌中草药大辞典 [M]. 武汉: 湖北科学技术出版, 1994. |
| [24] | Wang L Y, Wang N L, Yao X S, et al. Kansuinone, a novel euphane-type triterpene from Euphorbia kansui [J]. Nat Prod, 2003, 66: 630-633. |
| [25] | 曹 艳, 周云云, 宋成武, 等. 甘遂醇提取物及不同极性溶剂萃取物对肿瘤细胞增殖的影响 [J]. 医学导报, 2010, 29(11): 1416-1418. |
| [26] | Zheng W F, Cui Z, Zhu Q. Cytotoxicity and activity of the compounds from Euphorbia kansui Liou [J]. Planta Med, 1998, 64(8): 754-756. |
| [27] | 郑维发, 陈才法, 朱爱华. 甘遂醇提物抗流感病毒FM1有效部位的筛选 [J]. 中成药, 2002, 24(5): 362-365. |
| [28] | FujiWara M, Ijichi K, Konno K, et al. Ingenol derivatives, ingredient of ‘Kansui', are highly potent inhibitor of HIV [J]. Antivir Res, 1995, 26(3): 228. |
| [29] | 韩向阳. 中药甘遂注射液妊娠中期引产效果的观察 [J]. 哈尔滨医科大学学报, 1979, 13(4): 21-29. |
| [30] | 韩向阳. 中药甘遂抗生育作用研究及其临床应用 [J]. 医学研究通报, 1980, 9(5): 8-11. |
| [31] | 王秋静, 于小风, 刘宏雁, 等. 复方甘遂制剂宫内给药终止动物中期妊娠及毒性实验 [J]. 白求恩医科大学学报, 1994, 20(5): 461-463. |
| [32] | 韩燕燕. 中药甘遂抗生育作用的研究进展 [J]. 黑龙江中医药, 2011(3): 57-59. |
| [33] | Wang L Y, Wang N L, Yao X S, et al. Diterpenes from the roots of Euphorbia kansui and their in vitro effects on the cell division of Xenopus [J]. Am Chem Soc Am Soc Pharm, 2002, 65: 1246-1251. |
| [34] | Miyata S, Wang L Y, Yoshida C, et al. Inhibition of cellular proliferation by diterpenes, topoisomerase II inhibitor [J]. Bioorg Med Chem, 2006, 14: 2048-2051. |
| [35] | Wang L Y, Wang N L, Yao X S, et al. Euphane and tirucallane triterpenes from the roots of Euphorbia kansui and their in vitro effects on the cell division of Xenopus [J]. J Nat Prod, 2003, 66: 630-633. |
| [36] | 潘实清, 王 玲, 罗海华, 等. 甘遂和贯众不同提取物对蚊幼虫的杀伤作用 [J]. 热带医学杂志, 2002, 2(3): 252-254. |
| [37] | Dang Q L, Choi Y H, Choi G J, et al. Pesticidal activity of ingenane diterpenes isolated from Euphorbia kansui against Nilaparvata lugens and Tetranychus urticae [J]. J Asia-Pacific Entomol, 2010, 13: 51-54. |
| [38] | Shi J X, Li Z X, Nitoda T, et al. Antinematodal activities of ingenane diterpenes from Euphorbia kansui and their derivatives against the pine wood nematode (Bursaphelenchus xylophilus) [J]. Z Naturforsch, 2008, 63: 59-65. |
| [39] | Shi J X, Li Z X, Izumi M, et al. Termiticidal activity of diterpenes from the roots of Euphorbia kansui [J]. Z Naturforsch, 2008, 63: 51-58. |
| [40] | Yu F, Lu S Q, Yu F, et al. Protective effects of polysaccharide from Euphorbia kansui (Euphorbiaceae) on the swimming exercise-induced oxidative stress in mice [J]. Can J Physiol Pharmacol, 2006, 84: 1071-1079. |
| [41] | 李嗣英. 甘遂对小鼠免疫功能的影响 [J]. 中国药理通讯, 1989, 6(2): 10. |
| [42] | 宗倩倩, 唐于平, 沈祥春, 等. 甘遂醇提物对家兔离体回肠平滑肌张力的影响 [J]. 中药新药与临床药理, 2008, 9(6): 438-440. |
| [43] | Chai Y S, Hu J, Wang X K, et al. Euphorbia kansui roots induced-diarrhea in mice correlates with inflammatory response [J]. Chin J Nat Med, 2013, 11: 231-239. |
| [44] | Shu X Y, Yu L, Tang Y P, et al. Bioassay-guided separation of the proinflammatory constituents from the roots of Euphorbia kansui [J]. J Nat Med, 2010, 64: 98-103. |
 2014, Vol. 45
2014, Vol. 45


