泽泻为泽泻科植物泽泻Alisma orientalis (Sam.) Juzep. 的干燥块茎。其性寒,味甘、淡,入肾、膀胱经,具有利水渗湿、泄热、化浊降脂的功效[1]。关于泽泻质量标准的研究,《中国药典》2010年版首次增加了定量测定项目,将23-乙酰泽泻醇B作为指标成分。对照品的制备,传统方法是采用有机溶剂回流提取结合常压柱色谱方法[2, 3]或中压柱色谱方法[4]制备,近年开始有较多学者[5, 6, 7, 8, 9, 10]采用高速逆流色谱(HSCCC)法快速分离纯化天然药物的活性成分,还有将超临界流体萃取技术与HSCCC技术结合起来分离纯化的报道[11, 12, 13]。关于超临界CO2萃取技术在中药泽泻提取中的应用也有相关文献报道[14, 15]。本研究以泽泻为原料,应用超临界流体萃取技术结合HSCCC技术,从泽泻中快速制备23-乙酰泽泻醇B,旨在为闽产中药泽泻化学对照品高效提取纯化与工业化制备提供参考。
1 仪器与材料HA221—40—11超临界CO2流体萃取装置,江苏南通华安超临界萃取有限公司;TBE—300A高速逆流色谱仪,上海同田生化技术有限公司;API QSTAR Pulsar液相色谱/四极杆/飞行时间串联质谱仪、岛津LC—20AT液相色谱仪、Bruker DRX—500 MHz超导核磁共振仪、Bruker TENSOR27傅里叶变换中红外光谱仪、Shimadzu UV2401PC紫外可见分光光度仪、Jasco P—1020全自动旋光仪、艾科浦超纯水机,重庆颐洋企业发展有限公司;AL204电子天平,梅特勒-托利多仪器上海有限公司。
泽泻采自福建省建瓯市吉阳镇泽泻药材GAP基地,经福建省建瓯市吉阳镇农技站站长葛培盛鉴定为泽泻科植物泽泻Alisma orientalis (Sam.) Juzep. 的干燥块茎;23-乙酰泽泻醇B对照品购自中国食品药品鉴定研究院(批号111846-201102,质量分数98.5%),甲醇、乙腈为色谱纯,乙醇等试剂均为国产分析纯。
2 方法与结果 2.1 泽泻超临界CO2流体萃取物的制备将泽泻切片后,60 ℃烘箱干燥,再粉碎成粗粉备用。称取泽泻粗粉3 194.8 g,装入超临界CO2流体萃取装置10 L萃取釜,旋紧萃取釜和分离釜的顶盖,旋紧出料阀,接通总电源,设定所需压力温度40 ℃,打开制冷系统,CO2钢瓶,打开压缩机对系统进行增压,当压力达到设定压力35 MPa时,连通整个系统,开始进行萃取,并随时监控压力变化,必要时进行调节,萃取满2 h后,停掉压缩机、制冷系统,打开放料阀放料,放空系统压力,打开萃取釜,取出萃余物,经干燥称质量得127.5 g浸膏,该步骤制备的泽泻超临界CO2萃取物得率为4.0%。
2.2 HPLC分析条件色谱柱为Lnertsil® ODS-sp-C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(80∶20);检测器为DAD(二极管阵列检测器);体积流量1.0 mL/min;进样量10 μL;柱温25 ℃;检测波长208 nm。23-乙酰泽泻醇B对照品与泽泻超临界CO2萃取物的液相色谱图见图 1,峰面积归一化法显示泽泻超临界CO2流体萃取物中23-乙酰泽泻醇B峰面积占34.81%。
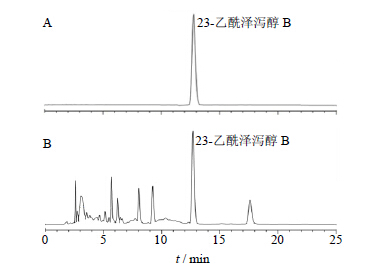 | 图 1 23-乙酰泽泻醇B对照品 (A) 和泽泻超临界CO2Fig. 1 HPLCof 23-acetate alisol B (A) and SFE-CO2 |
溶剂系统是考察逆流色谱分离效果的重要指标,同时也是HSCCC分离工作的难点。对于HSCCC来说,溶剂系统中两相溶剂的分配系数(K)值的最佳范围为0.5≤K≤1[16],可以通过测定K值来选
择合适的HSCCC溶剂系统。首先参考文献报道[10]找到与23-乙酰泽泻醇B结构接近的化合物的分离溶剂系统,然后按比例配制好不同溶剂,加入泽泻超临界CO2萃取物适量,超声溶解,静置分层后,分取上下相,挥去溶剂,加入等量乙腈溶解,用0.45 μm滤膜滤过后,用HPLC检测上下相中23-乙酰泽泻醇B的峰面积(A),则K=A上/A下。尝试了6个不同溶剂系统,测得的K值见表 1。结果表明,系统5的分离效果最佳,因此确定正己烷-醋酸乙酯-甲醇-水(3∶2∶3∶2)作为本次HSCCC分离的溶剂系统。
| 表 1 不同溶剂体系的K值 Table 1 values of components in different solvent systems |
将溶剂系统正己烷-醋酸乙酯-甲醇-水按3∶2∶3∶2配制于分液漏斗中,剧烈振荡15 min后,静置30 min,待体系平衡后分离出上、下相,上相作固定相,下相作流动相,超声脱气30 min,备用。精密称取泽泻萃取物200 mg,超声溶解于10 mL下相中,配制成20 mg/mL上样溶液,仪器转速为800 r/min,流动相体积流量为2.0 mL/min,紫外检测器检测波长为254 nm。根据紫外吸收色谱图手动收集各组分,按时间进行标记,具体出峰情况见图 2。
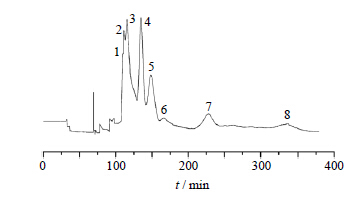 | 图 2 泽泻超临界萃取物HSCCC分离图Fig. 2 HSCCC of SFE-CO2extractfromA. orientalis |
根据逆流色谱图的峰型、峰位,对收集的组分进行了归属并处理,并对图 2中8个主要的色谱峰组分、泽泻超临界萃取物原液与对照品溶液进行了液相色谱分析比对,确定图 2中的7号峰为23-乙酰泽泻醇B,7号峰附近(200~250 min)收集的流分液相色谱图见图 3,面积归一化法显示23-乙酰泽泻醇B峰面积占82.7%,有1个较大的杂峰,需要重结晶去除。
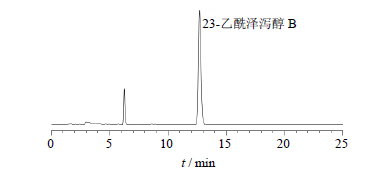 | 图 3 逆流色谱分离图中7号峰组分HPLC图Fig. 3 HPLCof components of peak No. 7 in HSCCC |
由于1次逆流色谱分离得到的23-乙酰泽泻醇B流分中尚有其他杂质,故需要进行结晶精制。将7号峰附近收集的溶液,挥去部分溶剂后,在4 ℃冰箱中放置一段时间,可见无色棱状、针状结晶析出,取该结晶适量,用1 mL乙腈溶解后进行液相色谱纯度分析,面积归一化法显示,23-乙酰泽泻醇B峰面积占99.8%,见图 4。用离心方法收集结晶,干燥称定质量得20.0 mg结晶,计算精制工艺对照品的得率为10.0%,总的提取分离纯化干燥得率为0.4%。
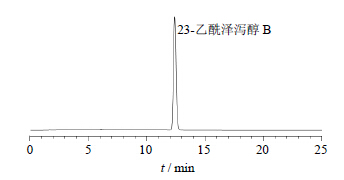 | 图 4 所得结晶的HPLC色谱图Fig. 4 HPLC of obtained crystal |
将所得晶体进行理化性质及紫外光谱、红外光谱、质谱及核磁共振氢谱、碳谱鉴定,结果显示本品为无色针晶,mp 183 ℃;EI-MS m/z: 515 [M+H]+, IR νmax (cm−1): 3 474 (OH), 1 744 (COO), 1 705 (CO);1H-NMR (600 Mz, CDCl3)δ: 1.72 (1H, d, J =10.8 Hz, H-9α), 3.78 (1H, td, J = 10.8, 5.6 Hz, H-11α), 1.06 (3H, d, J =6.8Hz, 21-CH3), 4.57 (1H, td, J = 8.8, 2.4 Hz, 23-H), 2.76 (1H, d, J =8.8 Hz, 24-H), 2.07 (3H, s, CH3CO);13C-NMR (150 Mz, CDCl3) δ: 220.6 (C-3), 170.3 (CH3CO), 138.3 (C-13), 134.3 (C-17), 71.7 (C-23), 70.5 (C-11), 65.3 (C-24), 58.7 (C-25), 57.2 (C-14), 50.1 (C-9), 48.6 (C-5), 47.2 (C-4), 40.9 (C-8), 37.1 (C-10), 36.9 (C-2), 34.7 (C-12), 34.4 (C-7), 33.9 (C-22), 31.1 (C-1), 30.8 (C-15), 29.8 (C-28), 29.3 (C-16), 28.0 (C-20), 25.9 (C-19), 24.9 (C-27), 24.0 (C-27), 23.4 (C-30), 21.4 (CH3CO),检测结果表明,与文献报道的23-乙酰泽泻醇B数据一致[2],进一步确定所得晶体为高纯度的23-乙酰泽泻醇B。
3 讨论超临界CO2流体萃取法一般在低温条件下进行,且萃取时间短,在此条件下,活性成分不易破坏,而且还有提取收率高、无溶剂残留等优点。SFE-CO2对小分子、低极性、亲脂性、低沸点的成分如挥发油、烃、酯、内酯、醚、环氧化合物等表现出优异的溶解性,本实验药材泽泻中的23-乙酰泽泻醇B为亲脂性的物质,非常适合采用超临界CO2流体萃取。实验最后优化确定正己烷-醋酸乙酯-甲醇-水按3∶2∶3∶2配制溶剂系统最为理想。本方法简捷、快速、高效,所得产物纯度高且费用较低,适合于泽泻对照品的快速制备。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 彭国平, 潘林梅, 文红梅. 泽泻的对照品研究 [J]. 南京中医药大学学报: 自然科学版, 2001, 17(3): 154-156. |
| [3] | 潘菽弢, 于启平, 高 晶, 等. 泽泻对照品23-乙酰泽泻醇B克级制备工艺研究 [J]. 时珍国医国药, 2011, 22(11): 2741-2743. |
| [4] | 李小艳, 许 文, 丘建芳, 等. MPLC合p-HPLC法分离制备泽泻中23-乙酰泽泻醇B [J]. 福建中医药大学学报, 2013, 23(3): 35-37. |
| [5] | 刘雪辉, 王 振, 吴 琪, 等. 高速逆流色谱法分离玫瑰茄中的花色苷 [J]. 现代食品科技, 2014, 30(1): 190-194. |
| [6] | 尹西拳, 桂蜀华, 万玉华, 等. 高速逆流色谱法分离何首乌中的游离蒽醌及二苯乙烯苷 [J]. 中药材, 2014, 37(2): 328-332. |
| [7] | 张 琳, 赵晓辉, 岳会兰. 高速逆流色谱法从斑唇马先蒿中分离两种黄酮类化合物 [J]. 天然产物研究与开发, 2014, 26(1): 15-18. |
| [8] | 胡利锋, 廖晓兰, 柏连阳, 等. 硅胶柱色谱-高速逆流色谱法分离纯化羌活中佛手柑内酯 [J]. 中草药, 2013, 44(6): 701-704. |
| [9] | 胡 瑕, 谢红旗, 罗 巍, 等. 高速逆流色谱法分离制备蛹虫草发酵液中虫草素 [J]. 中草药, 2013, 44(5): 557-561. |
| [10] | 吕 政, 孔维军, 杨世海, 等. 天然产物分离中高速逆流色谱溶剂体系的研究进展 [J]. 中南药学, 2014, 12(3): 238-246. |
| [11] | Chu C, Zhang S, Tong S, et al. An efficient strategy for the extraction and purification of lignans from Schisandra chinensis by a combination of supercritical fluid extraction and high-speed counter-current chromatography [J]. J Sep Sci, 2013, 36(24): 3958-3964. |
| [12] | Li S, Guo L, Liu C, et al. Combination of supercritical fluid extraction with counter-current chromatography to isolate anthocyanidins from the petals of Chaenomeles sinensis based on mathematical calculations [J]. J Sep Sci, 2013, 36(21/22): 3517-3526. |
| [13] | Li S, Guo L, Liu C, et al. Application of supercritical fluid extraction coupled with counter-current chromatography for extraction and online isolation of unstable chemical components from Rosa damascene [J]. J Sep Sci, 2013, 36(13): 2104-2113. |
| [14] | 易 醒, 肖小年, 冯永明, 等. 超临界二氧化碳萃取泽泻中三萜类总组分 [J]. 时珍国医国药, 2006, 17(7): 1129-1130. |
| [15] | 韦 玮, 周盈利, 唐铁鑫, 等. 薄层色谱图像分析定量-高速逆流色谱法快速分离制备吴茱萸中的三个生物碱类化合物 [J]. 分析试验室, 2014, 33(1): 109-112. |
| [16] | Ito Y. Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography [J]. J Chromatogr A, 2005, 1065(2): 145-168. |
 2014, Vol. 45
2014, Vol. 45

