西瓜霜Mirabilitum Praeparatum又名西瓜硝、西瓜白霜,为葫芦科植物西瓜Citrullus lanatus (Thunb.) Matsumu. et Nakai的成熟新鲜果实与芒硝Natrii Sulfas经炮制加工制成。西瓜霜性味咸、寒,归肺、胃、大肠经,具有清热泻火、消肿止痛的功效;用于咽喉肿痛、口舌热疮、牙疳等。
一直以来,人们认为西瓜霜为西瓜中析出的细小的芒硝结晶,并将其归属为炮制分类的制霜法。但根据观察,传统西瓜霜制备中,西瓜与芒硝混合后,第2、3天即开始出现西瓜酸败及真菌生长的现象,西瓜霜的加工生产时间长达月余,而收集的粉霜中除芒硝结晶外,更有大量的菌丝。由此推断耐高盐菌株以西瓜为培养基进行发酵应当是炮制制备西瓜霜的内涵实质,而发酵产物应为西瓜霜发挥药效作用的物质基础。本课题组前期进行西瓜霜抗菌有效物质的化学研究,本研究继续对西瓜霜传统制备工艺中的发酵微生物进行分离、鉴定。 1 材料 1.1 原料
自制西瓜霜发酵液[1]。将带皮西瓜与芒硝按照质量比100∶15,放入不带釉瓦罐(购自哈尔滨陶瓷公司)内,一层西瓜一层芒硝,在秋季放置于通风阴凉处,发酵15~45 d。 1.2 培养基
自制PDA培养基[2]、CZA培养基[3]、Sabourand培养基。 2 方法 2.1 发酵菌的分离纯化
取不同天数的发酵液10 mL,制成0.1倍稀释液[4]。然后连续稀释制成10-2~10-9倍浓度的稀释菌液备用。取0.2 mL各浓度的稀释液,采用常规平板涂抹法,将各梯度的稀释液涂布在4种分离培养基PDA、CZA、Sabourand和牛肉膏蛋白胨上,28 ℃恒温培养。菌落出现后,根据菌落形态、颜色的差异以及出现时间的不同,再分别接于新的平板上进行分离培养,并逐步纯化。 2.2 西瓜霜发酵真菌的形态学鉴定 2.2.1 菌落形态观察
用接种针从斜面上蘸取极少量孢子,接种于PDA培养基平板中心,培养观察菌落形态与生长情况。 2.2.2 显微结构观察
盖玻片经160 ℃干热灭菌2 h后,以倾角40°插入已倒好的PDA平板中,每皿插5片。将待观察真菌接种于盖玻片与培养基交界处,使其菌丝在生长过程中能够附着在盖玻片上,每日取盖玻片,经乳酸-棉兰染液染色,显微镜观察真菌结构。 2.3 分子鉴定 2.3.1 发酵真菌基因组DNA的提取
将菌体接入PDA液体培养基中,摇床培养,滤过清洗得菌体;将菌体放入研钵加液氮研磨;置离心管中,加缓冲液,混匀离心,取上清液加等体积酚-氯仿,混匀,取上清液;DNA提取缓冲液加等体积氯仿,混匀离心,取上清液;加2倍体积冰乙醇,-20 ℃过夜;离心,去上清液,加70%乙醇,离心;去上清液,挥干,加入50 μL 1×TAE溶解沉淀,为DNA模板。置-20 ℃保存备用[5]。 2.3.2 发酵真菌基因组DNA的检测
取少量DNA模板,采用分光光度法测定吸光度值A260/A280,检测DNA模板纯度,并计算DNA浓度。采用1×TAE作为电泳缓冲液,0.8%琼脂糖凝胶电泳检测真菌基因组DNA模板。加样量为6 μL,电场强度为5 V/cm,电泳时间1.5 h。紫外灯检测真菌基因组DNA提取结果[6]。 2.3.3 发酵菌ITS序列的扩增
采用真菌鉴定通用引物V9D与LS266,对真菌进行ITS序列扩增,50 μL反应体系:模板DNA 1 μL,5 U/μL TaqDNA聚合酶0.35 μL,10×PCR 缓冲液 7 μL,2.5 mmol/L dNTP 4 μL,10 μmol/L引物V9D 2 μL,10 μmol/L引物LS266 2 μL,灭菌去离子水33.65 μL。
循环参数:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环,最后72 ℃延伸10 min。反应结束后,取扩增产物5 μL,经0.8%琼脂糖凝胶电泳,鉴定目的条带与预期大小是否相符。 2.3.4 PCR扩增产物的序列测定与数据处理
将PCR扩增产物测序。将测序结果与Genbank中已知序列进行比较分析,从Genbank数据库中获得相关种属的ITS序列信息,应用DNAStar100软件进行多序列比对,并计算结果。 3 结果与分析 3.1 西瓜霜发酵菌种的分离
从15~45 d的发酵菌液中均分离得到以下6种真菌(图 1~图 6)。
菌WF-1在PDA培养基中生长迅速,菌落圆形,边缘整齐,菌落中部淡橙色,边缘白色,质地疏松,气生菌丝不发达,绒毛状。显微观察分生孢子梗分枝不规则,成群分布,孢子单生,无色,多细胞,长圆形,微弯曲(图 1)。根据镰霉孢属的特征,初步鉴定菌WF-1为镰孢霉属Fusarium。
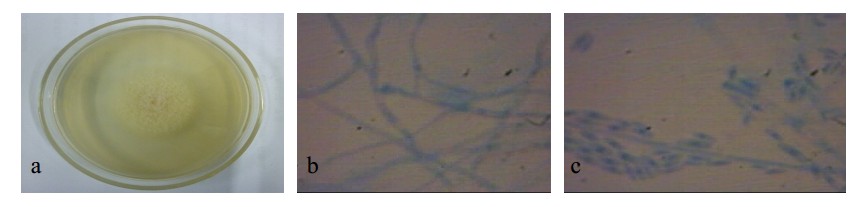 |
a-菌种在PDA中培养基中的菌落形态 b-菌丝形态 c-分生孢,下同 a-colony morphology in PDA medium b-mycelial morphology c-conidia same as below 图 1 WF-1菌落形态和显微结构 Fig. 1 Colony morphology and microstructure of WF-1 |
菌WF-2在PDA养基中,菌落圆形,绿色,边缘白色,中部有较大的疣状突起,菌落周围培养基显棕红色环,背面浅棕色。显微观察分生孢子梗单生,顶端生排列成帚状的间枝,分生孢子串呈不分枝的链状,单个孢子球形,光滑(图 2)。根据青霉属的特征,初步鉴定菌WF-2为青霉属Penicillium。
 | 图 2 WF-2菌落形态和显微结构 Fig. 2 Colony morphology and microstructure of WF-2 |
菌WF-3在PDA养基中生长迅速,菌落圆形,黑色,绒毛状,气生菌丝不发达。显微观察孢囊梗单轴状分枝,分枝不规则;孢子囊球形,壁易破裂;单个孢子球形,黄色。厚垣孢子在菌丝和孢囊梗中大量形成,无色乃至黄色(图 3)。根据毛霉属的特征,初步鉴定菌WF-3为毛霉属Mucor [4]。
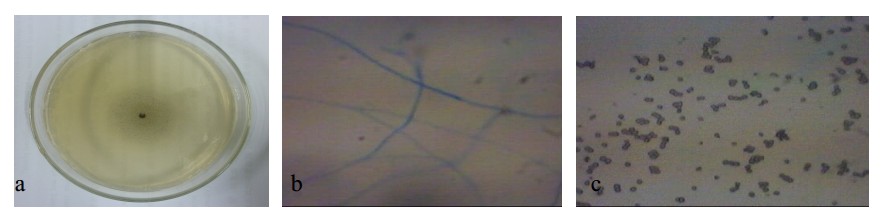 | 图 3 WF-3菌落形态和显微结构 Fig. 3Colony morphology and microstructure of WF-3 |
菌WF-4在PDA培养基上菌落蔓延迅速,菌落圆形,初为白色,后变成鲜黄色直至黑色,背面中央略带黄褐色。显微观察分生孢子梗分枝,淡榄褐色,分生孢子单生,形成的孢子链,褐色,倒棒形或卵形,表面光滑,横隔明显,并且1~2个隔膜增厚,有喙(图 4)。根据交链孢霉属的特征,初步鉴定菌WF-4为交链孢霉属Alternaria。
 | 图 4 WF-4菌落形态和显微结构 Fig. 4 Colony morphology and microstructure of WF-4 |
菌WF-5在PDA养基中生长迅速,菌落等径生长,圆形,墨绿色,边缘整齐,呈白色,偶见由分泌物形成的透明液滴。显微观察分生孢子梗直立,分枝,分生孢子单生,倒棒形,链状排列,分隔明显且无规律,喙较长,约占孢子总长度的一半(图 5)。根据交链孢霉属的特征,初步鉴定菌WF-5为交链孢霉属Alternaria。
 | 图 5 WF-5菌落形态和显微结构 Fig. 5 Colony morphology and microstructure of WF-5 |
菌WF-6在PDA养基中生长迅速,菌落圆形,初期白色,渐变为黄绿色,菌落外圈有两个同心环,气生菌丝色淡,白色。显微观察菌丝有疣状突起,2天即可产生分生孢子,分生孢子卵形或倒棒形,表面平滑,形成不分枝的长链,具横隔,有喙[7](图 6)。根据交链孢霉属的特征,初步鉴定菌WF-6为交链孢霉属Alternaria。
 | 图 6 WF-6菌落形态和显微结构 Fig. 6 Colony morphology and microstructure of WF-6 |
所提取基因组DNA的A260/A280值均介于1.8~2.0,非特异性RNA杂质导致部分比值偏高,并不影响ITS序列的PCR扩增。由图 7可以看出,各真菌DNA模板均有一清晰条带,且均无拖尾现象,证明所得基因组DNA完整,符合进行下一步PCR扩增条件。
 | 1-WF-1 2-WF-2 3-WF-3 4-WF-4 5-WF-5 6-WF-6 M-Marker 图 7 内生真菌基因组DNA电泳图谱 Fig. 7 Electrophoretogram of genomic DNA extracted from endophytic fungi |
由图 8可见,西瓜霜发酵真菌ITS序列的PCR扩增产物在约1 000 bp的位置有清晰条带,相对分子质量大小范围与文献报道[8]一致,无其他杂质,证明PCR产物为预期产物。
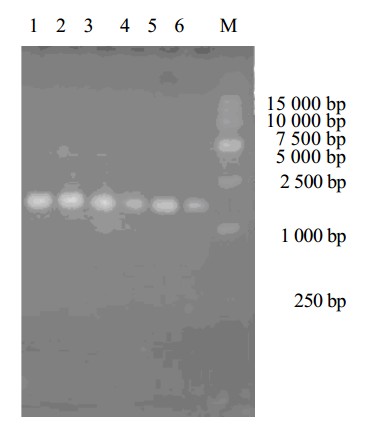 | 1-WF-1 2-WF-2 3-WF-3 4-WF-4 5-WF-5 6-WF-6 M-Marker 图 8 PCR电泳结果 Fig. 8 Electrophoretogram of PCR |
PCR测定结果显示,各菌种ITS扩增片段长度在516~609 bp,整个序列包括部分18 S序列,全部ITS1、5.8 S、ITS2序列,以及部分28 S序列。
将所得序列提交至美国国立生物技术信息中心NCBI)网页,通过Blast搜索相关序列,选取相似性高(一般要求大于98%,个别种大于95%)且种属地位明确的序列,应用DNAStar100进行多序列比对,并计算结果。结果显示,所有待鉴定菌株不同种,其中WF-1、3、5、6分别与其参考株聚为一簇,即与其参考株同属。所以WF-2、WF-4通过形态和显微结构分别鉴定为青霉属、交链孢霉属;通过进一步的分子鉴定得出WF-1为镰孢霉属;WF-3为毛霉属;WF-5、WF-6鉴定为交链孢霉属。 4 讨论
本研究共从西瓜霜的发酵液中分离出6株菌株,均为真菌,其颜色呈现白、黄、绿、灰,与西瓜霜在自然情况下传统炮制中呈现的颜色是一致的,说明西瓜霜的炮制加工过程确实有微生物的发酵过程,微生物发酵应当为西瓜霜炮制加工的内涵实质。
在本课题组的前期研究中,笔者对西瓜霜提取物的抗菌活性进行了研究,发现其提取物对口腔致病菌、常见致病菌具有较强的抑菌、杀菌活性,抑菌作用应当为其发挥药效作用的主要机制。但对有效发酵菌种的确定,还需要进行纯种或混合菌种发酵,并结合发酵产物的抗菌活性来予以确定。
本研究揭示出西瓜霜的炮制过程为发酵过程,可为对西瓜霜药效物质基础的研究提供新的思路,即基于微生物代谢产物的药效物质基础的崭新认识,区别于以往认为的仅仅是芒硝的细小结晶和少量的氨基酸[9]等物质基础的认识,将为西瓜霜规范化的炮制生产、质量控制提供依据。
本研究选择通用的PDA培养基,选择适合青霉、曲霉的CZA培养基及适合真菌生长的Sabourand培养基进行菌种的分离。结果发现,所分离的真菌均可在PDA培养基中正常培养,形态、颜色与其他培养基培养的结果相同,简单、易得的PDA培养基可用于西瓜霜菌种分离鉴定。
| [1] | 龚千峰. 中药炮制学 [M]. 北京: 中国中医药出版社, 2012. |
| [2] | 张文娟, 王贞, 魏少鹏. NYS-4菌株发酵液抑菌活性成分的分离及初步结构鉴定 [J]. 农药学学报, 2012, 14(4): 372. |
| [3] | 冉淦侨, 王楠, 戴佳锟, 等. 枯草芽孢杆菌BS24在苹果叶面的定殖及其对叶面菌群的影响 [J]. 生物技术通报, 2013, 10(10): 131-136. |
| [4] | 王鸿, 倪建良, 曹小吉, 等. 海洋毛霉属真菌Mucor sp. MNP801转化天然香豆素后的挥发性成分研究 [J]. 中国海洋药物, 2010, 29(5): 10-13. |
| [5] | 冯广达, 陈美标, 羊宋贞, 等. 用于PCR扩增的细菌DNA提取方法比较 [J]. 华南农业大学学报, 2013, 34(3): 165-168. |
| [6] | 谢丽源, 张勇, 邓科君. 基于rDNA ITS序列分析的桑黄真菌菌株分子鉴定 [J]. 食品科学, 2010, 31(9): 182-184. |
| [7] | 朱富春. 食用菌链孢霉的发生特点, 原因与综合防治方法 [J]. 食药用菌, 2013, 21(20): 126-128. |
| [8] | 王国芬, 彭军, 代鹏. 香蕉枯蒌病镰刀菌ITS序列的PCR扩增及其分子检测 [J]. 华南热带农业大学学报, 2007, 13(3): 2-3. |
| [9] | 邹节明, 李昆, 祝长青. 西瓜霜化学成分分析 [J]. 中成药研究, 1988(6): 30-31. |
 2014, Vol. 45
2014, Vol. 45


