2. 福建农林大学中药材GAP研究所, 福建 福州 350002;
3. 河南中医学院药学院, 河南 郑州 450046;
4. 河南省中医药研究院, 河南 郑州 450004
2. Institute of Chinese Crude Drugs GAP, Fujian Agriculture and Forestry University, Fuzhou 350002, China;
3. School of Medicine, Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China;
4. Henan Province Institute of Chinese Medicine Research, Zhengzhou 450004, China
地黄Rehmannia glutinosa L. 为玄参科多年生草本植物,以块根入药,是著名“四大怀药”之一。因其用药历史悠久、临床疗效确切,已成为构建我国现代大中药产业链重点推荐研究利用的大宗药材之一[1, 2]。然而,由于地黄生产上多以块根进行无性繁殖,易遭受病原菌和病毒侵袭而发病。而且,地黄生产上存在非常严重的连作障碍问题,造成地黄产量和品质明显下降,种植过地黄的土地须隔8~10年方可再种。培育脱毒地黄虽然能够提高地黄的产量,但并没有改变地黄的遗传特性,病毒复侵速度快,2~3代就要更换1次种苗,成本高。这些都在很大程度上影响了地黄生产的稳定发展,也制约了地黄道地产区中药农业的可持续发展。近年来,由于高通量DNA测序技术的发展,地黄的基因转录本不断被解析,快速获取地黄产量形成和活性成分合成调控的基因信息成为可能[3, 4]。最近,关于地黄蛋白编码基因克隆的报道越来越多[5, 6, 7, 8]。因此,通过遗传转化的方法对地黄的遗传特性进行修饰,对于获得产量高、活性成分量高和抗病虫能力强的优良地黄品种具有重要的现实意义。
地黄是较早开展组织培养技术的药用植物之一,已经建立了高效的地黄脱毒、快繁和再生体系[9]。然而,有关怀地黄遗传转化的研究却很少。付建喜等[10]报道用发根农杆菌侵染地黄子叶、叶柄和茎,获得了转基因地黄植株。然而,由于发根农杆菌转化的转基因植株普遍表现地上部分节间缩短、地下部分以须根为主,而且Ri质粒改造技术滞后,限制了其在植物基因组的遗传修饰方面的应用。Park等[11]虽然最早报道获得了根癌农杆菌介导的地黄转化植株,然而,作为转化受体的地黄种质不明,且转化程序较复杂。臧亚超[12]虽也获得了地黄转基因植株,但由于抑菌抗生素质量浓度过高,再生芽分化慢,转化效率也低。因此,构建转化程序简单、转化效率高、重复性好的怀地黄遗传转化再生体系仍是地黄种质遗传改良中亟需解决的问题。
1 材料与方法 1.1 材料地黄温85-5为道地产区大面积推广品种,具有高产优质的特点,经河南省中医药研究院张留记研究员鉴定为地黄Rehmannia glutinosa L.。
1.2 遗传转化的潮霉素和AS处理筛选适宜于遗传转化的潮霉素质量浓度,实验设置0、3、6、9、12 mg/L 5个质量浓度梯度。研究乙酰丁香酮(acetosyringone,AS)在遗传转化中的作用,实验设置了在侵染培养基和共培养培养基中添加100 μmol/L AS和不添加AS的2个处理。统计愈伤诱导率(愈伤诱导率=诱导出愈伤的叶盘数/接种的叶盘总数)和再生芽分化率(再生芽分化率=分化出再生芽的叶盘数/接种的叶盘总数)。
1.3 遗传转化方法 1.3.1 怀地黄无菌苗的制备将田间挖取的直径约1~2 cm的怀地黄块根洗净,用体积分数为70%乙醇表面消毒30 s,然后用0.1%HgCl2消毒10~15 min,无菌水冲洗5~6次;将带芽眼的部分切成1.5~2.0 cm小块放入MS基本培养基中,15 d后把再生芽转至新的MS基本培养基,30d继代1次。
1.3.2 菌株的活化与侵染菌液的制备将鉴定正确的含质粒载体pCABMA1301的根癌农杆菌LBA4404在含50mg/L卡那霉素的YEB固体培养基上划线活化,于27 ℃下暗培养48 h,挑取单克隆菌落接种到20~30 mL 含50 mg/L卡那霉素YEB液体培养基中,于27 ℃下,180 r/min振荡培养24 h,取100 μL的菌液接种到50 mL的YEB液体培养基中,于27 ℃下180 r/min振荡培养,至A600为0.4~0.8,4 000 r/min条件下离心10 min收集菌体,弃上清,用侵染培养基悬浮至A600为0.5,待用。
1.3.3 侵染和共培养将怀地黄无菌苗的叶片去掉主脉,剪成长宽约0.5~1.0 cm的小块即叶盘,置于制备好的农杆菌液中浸泡5~10min,用无菌滤纸吸去叶盘上多余的菌液,接种到添加适宜质量浓度6-BA和NAA的共培养培养基上暗培养48~72 h。
1.3.4 外植体的抗性愈伤诱导和再生芽分化共培养后的叶盘转接到含200 mg/L特美汀、0.1 mg/L NAA、2.0 mg/L 6-BA以及不同质量浓度的潮霉素、AS的筛选培养基上,3~4周后把抗性愈伤转接到新的筛选培养基上,2~3周长出抗性芽。
1.3.5 再生芽增殖和生根将长2~3 cm的抗性芽转接到含0.2 mg/L 6-BA和0.01 mg/L NAA的丛生芽分化培养基中进行抗性芽扩繁,把长2~3 cm的丛生芽剪下转接入含0.01 mg/L NAA和适宜质量浓度潮霉素的生根培养基中生根。
所有材料均在智能光照培养箱里培养,温度为25 ℃,光照强度为2 000~4 000 lx,14 h/d。计算转化率(转化率=分化出抗性芽的叶盘数/接种的叶盘总数)。
1.4 转基因植株分子检测取所获得的抗性再生植株的叶片,采用CTAB法提取叶片的基因组DNA,用潮霉素标记基因特异引物5’-ATCGAAATTGCCGTCAACC-3’ /5’-ACAG-CGTCTCCGACCTGAT-3’进行PCR鉴定,能扩增出794 bp的特异片段的为阳性植株。
β-葡萄糖苷酶(GUS)染色方法参照Sieburth等[13],并做适当修改。将抗性愈伤、再生芽和幼苗浸没在GUS染色液 [50 mmol/L磷酸钠缓冲液(pH 7.0),0.5 mmol/L铁氰化钾,0.5 mmol/L亚铁氰化钾,10 mmol/L EDTA-Na2,0.1% Triton X-100,10 mmol/L X-Glu] 中,37 ℃暗培养24 h,分别用50%、70%和100%乙醇去除叶绿素,显微镜下观察。
2 结果与分析 2.1 潮霉素和AS对抗性愈伤诱导的影响以添加NAA0.1 mg/L、6-BA 2.0 mg/L为筛选培养基的激素质量浓度,分析不同侵染培养基和筛选培养基对抗性愈伤诱导的影响,把叶片小块(叶盘)在菌液里侵染5 min,在共培养培养基上2 d后置于筛选培养基上培养(图 1-A),2周后统计愈伤,结果(表 1)表明,对于未进行农杆菌侵染的叶盘在潮霉素6mg/L以下筛选培养基上培养,愈伤诱导率均超过90%,当潮霉素为9mg/L时愈伤诱导率仅有48.89%,潮霉素为12 mg/L时所有叶片均没有诱导出愈伤。在不含AS的侵染培养基中侵染的叶盘,置于含潮霉素低于6 mg/L的筛选培养基上培养,愈伤诱导率较未侵染的稍低,除6 mg/L的处理外均不显著,之后随着潮霉素质量浓度的增加愈伤诱导率迅速降低,12 mg/L时诱导率仅有21.11%。而在添加了100 μmol/L AS的侵染培养基侵染过的地黄叶盘,在潮霉素6 mg/L以下筛选培养基上培养,愈伤诱导率与未侵染的几乎一致,9 mg/L时愈伤诱导率没有降低,12 mg/L时诱导率虽有降低,但仍有61.11%,而且愈伤鲜黄色,生长速度快(图 1-B)。
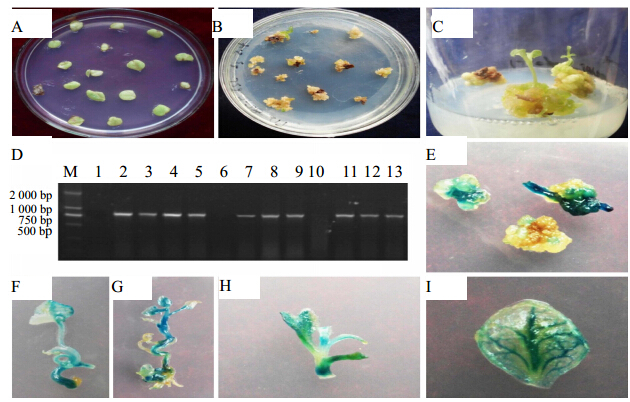 | A-叶片接种B-抗性愈伤诱导 C-再生芽分化 D-转基因地黄的PCR检测(M-Marker,1-阴性对照,2-质粒阳性对照,3~13-遗传转化后不同的地黄植株) E-抗性愈伤F、G-分化芽 H-苗 I-叶片 A-leaf inoculation B-inductionof resistant callus C-differentiation of shoot D-detection oftransformed shoots with PCR amplification (M-Marker,1-negative control 2-plasmidpositive control 3-13-regenerated plants of R. glutinosa aftergenetic transformation) E-resistant callus F and G-seedlingsH-plantlets I-leaf图 1 地黄的遗传转化及转基因苗的分子检测Fig. 1 Molecular detection on genetic transformation and transgenic seedlings of R. glutinosa |
| 表 1 潮霉素和AS对地黄叶片抗性愈伤诱导的影响 Table 1 Effects of hygromycin and AS on resistant callus induction from leaf explants of R. glutinosa in selective media at different concentration |
对上述侵染农杆菌的地黄叶片诱导的愈伤继续在含相应质量浓度潮霉素的筛选培养基上培养,结果表明(表 2),随着潮霉素质量浓度的增加,未添加AS的处理再生芽分化率呈递减趋势,当潮霉素质量浓度达到6 mg/L时,愈伤几乎均不同程度褐变,很少有再生芽出现,潮霉素质量浓度为12 mg/L时,3次重复实验均没有分化出再生芽。随潮霉素质量浓度增加,添加AS的处理再生芽分化率虽也有降低,但降低趋势不明显,除了潮霉素9 mg/L时再生芽分化率不足10%以外,其余4个处理的再生芽分化率均在20%以上。观察发现,潮霉素质量浓度为12 mg/L时,添加AS的处理愈伤生长状态好,再生芽分化率高(图 1-C)。以PCR扩增的方法对产生的抗性芽进行检测,结果表明(图 1-D),无论是否添加AS,当潮霉素质量浓度低于6 mg/L时所有的芽均无法扩增出潮霉素抗性基因特异的PCR产物,为假阳性。未添加AS的处理,潮霉素为9 mg/L时1个叶盘分化出的抗性芽为阳性。添加AS的处理,潮霉素为9 mg/L时3次重复共8个叶盘分化出抗性芽,其中有5个为阳性,阳性率为62.5%;潮霉素质量浓度为12 mg/L时3次重复共有22个叶盘分化出再生芽,其中19个为阳性,阳性率为96.4%。为了进一步检测抗性芽是否为阳性,对所有PCR扩增检测为阳性的再生芽和愈伤进行了GUS染色分析,结果(图 1-E~I)表明,这些愈伤和再生芽均能够被染成深浅不一的蓝色,证实为阳性愈伤和转基因再生芽。
| 表 2 不同浓度潮霉素和AS对地黄抗性芽分化的影响 Table 2 Effects of hygromycin and ASon resistant seedling regeneration of R. glutinosa in selective media at different concentration |
以上结果表明,添加100 μmol/L的AS能够显著提高农杆菌侵染后的叶片诱导愈伤和分化抗性芽,9 mg/L为潮霉素发挥作用的临界质量浓度,12 mg/L为适宜于遗传转化的筛选剂质量浓度。
2.3 抗性植株的增殖、生根和移栽把分子检测为阳性的转化再生芽转入含0.2 mg/L 6-BA和0.01 mg/L NAA的丛生芽分化培养基中进行扩繁,25个转化体共获得69株增殖芽,增殖系数为2.76。
以12 mg/L的潮霉素为生根筛选剂,把增殖的转化芽转入含筛选剂和0.01 mg/L NAA的生根培养基上,发现转接后7 d多数转化地黄芽即开始生根,转接后15 d所有分子检测鉴定为阳性的转化地黄丛生芽均能正常生根,而且植株生长旺盛(图 2-A~C)。而未转基因的地黄芽转接7 d后没有生根,15 d后所有植株仍然没有生根,且部分植株开始变黄、枯死(图 2-E~F)。结果表明,分子检测为阳性的抗性芽的潮霉素基因均得到了表达,进一步验证了分子检测结果的可靠性。
 | A~C-分化抗性芽 D-转化地黄植株水培炼苗 E~G-未转化地黄芽 H-盆栽的转基因地黄苗 A—C-differentiationof resistant seedlings D-transformed seedlings of R.glutinosawith liquid MS medium E—G-untransformed seedlings of R. glutinosa H-pot-plantedtransgenic seedlings图 2 转基因地黄生根和移栽Fig.2 Rooting and transplanting of transgenic R. glutinosa |
为了提高其成活率,生根的转基因植株移栽前先炼苗。即把转基因苗置入含1/4 MS液体培养基的营养液中水培生长10 d(图 2-D),之后把地黄苗移栽到含蛭石-草炭(1∶1)的营养基质中生长15~20 d(图 2-H),然后把健壮的地黄苗移栽到大田。结果69株转基因苗移栽成活57株,成活率82.6%。
3 讨论在植物的遗传转化体系中,影响转化效率的主要有外植体来源、基因型、农杆菌株、侵染时间、培养基组分、激素、抑菌抗生素、筛选抗生素、添加物和培养条件等多个因素的影响,但激素、抑菌抗生素、筛选抗生素的种类和质量浓度,以及是否添加AS等成为限制遗传转化的关键因素。Park等[11]最早报道获得了地黄的遗传转化植株,筛选抗生素卡那霉素的质量浓度为50mg/L,抑菌抗生素特美汀的质量浓度为200mg/L,但是没有说明所用地黄的种质。系统进化研究表明,ITS和rps16区域序列中国地黄与韩国地黄的序列一致,但是应用一对RAPD引物(HRgF和HRgR)能够完全区分中国地黄与韩国地黄,说明二者有明显的遗传差异[14]。刘志刚等[15]初步探讨了影响怀地黄遗传转化的抗生素质量浓度,认为适于地黄转化的卡那霉素质量浓度以20 mg/L为宜,羧苄西林钠400 mg/L为宜,但没有进行遗传转化验证。李萌萌[16]初步确定筛选抗生素潮霉素的质量浓度为4 mg/L,羧苄青霉素的质量浓度为200 mg/L,检测了GUS基因的表达效率,但未获得GUS基因稳定表达的转化体。臧亚超[12]确定了适于转化的卡那霉素质量浓度为75 mg/L,抑菌抗生素氨苄青霉素(Amp)的质量浓度为600 mg/L,获得了6株抗性苗,其中5株为阳性,且Amp质量浓度为400、500 mg/L时并不能有效抑制农杆菌的生长,虽然600 mg/L时抑菌效果较好,但高质量浓度的Amp对于地黄丛生芽的分化有强烈的抑制作用,不利于转化叶片的再生。
本实验所用的遗传转化受体材料为温85-5。为了确定适宜的抑菌抗生素质量浓度,前期分别选用羧苄青霉素和特美汀做预实验,发现抑菌效果二者基本一致,200 mg/L即可有效抑制农杆菌的继续生长,而且发现特美汀对于叶片愈伤分化有一定的促进作用,因此选用200 mg/L的特美汀进行地黄遗传转化。实验室的多个表达载体均具有潮霉素抗性基因,因此,对适宜遗传转化的潮霉素质量浓度进行了研究。结果发现潮霉素6 mg/L以下时,虽然也有再生芽分化,但均为假阳性;12 mg/L时分化率仍有21.11%,阳性率高达96.4%,是适宜于遗传转化的质量浓度,比李萌萌[16]确定的潮霉素质量浓度要高。实验还发现,添加100 μmol/L的AS对于遗传转化再生芽的分化有显著地促进作用,这与李萌萌[16]、臧亚超[12]的研究结果一致。
本实验建立了有效的根癌农杆菌介导的怀地黄遗传转化再生体系,明确了适宜于温85-5遗传转化的特美汀质量浓度为200 mg/L,潮霉素质量浓度为12 mg/L,侵染培养基和共培养培养基中应加入100 μmol/L的AS以提高转化效率。
| [1] | 黄璐琦, 李军德, 李 哲, 等. 我国现代大中药产业链发展趋势及对策 [J]. 中国科技投资, 2010(5): 67-69. |
| [2] | 司 南, 杨 柳, 王宏洁, 等. 近红外光谱法鉴别怀地黄药材道地性的研究 [J]. 现代药物与临床, 2013, 28(4): 542-546. |
| [3] | Sun P, Song S, Zhou L, et al. Transcriptome analysis reveals putative genes involved in iridoid biosynthesis in Rehmannia glutinosa [J]. Int J Mol Sci, 2012, 13(10): 13748-13763. |
| [4] | Li M J, Yang Y H, Chen X J, et al. Transcriptome/Degradome-Wide identification of R. glutinosa miRNAs and their targets: The role of miRNA activity in the replanting disease [J]. PLoS One, 2013, 8(7): e68531. |
| [5] | 周延清, 张永华, 张 喻, 等. 怀地黄3-酮酯酰CoA-硫解酶基因的克隆, 序列特征和时空表达分析 [J]. 中草药, 2013, 44(1): 76-84. |
| [6] | 刘 驰, 李明杰, 王鹏飞, 等. 地黄内质网型 (ER) Ca2+ ATPase基因的克隆及表达分析 [J]. 植物生理学报, 2013, 49(5): 445-451. |
| [7] | 王丰青, 田云鹤, 李明杰, 等. 地黄Aux/IAA家族基因RgIAA1的克隆和表达分析 [J]. 中国中药杂志, 2013, 38(23): 4033-4039. |
| [8] | 赵春丽, 李先恩, 都晓伟, 等. 地黄microRNAs和靶基因的生物信息学预测及验证 [J]. 中草药, 2014, 45(8): 1129-1135. |
| [9] | 王丰青, 田云鹤, 周 勋, 等. 地黄高效叶片离体再生系统的建立 [J]. 中国现代中药, 2013, 15(2): 122-126. |
| [10] | 付建喜, 范喜梅, 周春娥, 等. 发根农杆菌介导的怀地黄遗传转化研究 [J]. 河南农业科学, 2007(10): 72-76. |
| [11] | Park S U, Kim H H, Yu C Y, et al. Agrobact eriummediated genetic transformation of Chinese foxglove, Rehmannia glutinosa L [J]. Biotechnol Lett, 2002, 24(7): 547-550. |
| [12] | 臧亚超. 地黄扩展蛋白基因RgExpA1的克隆及遗传转化体系的优化 [D]. 保定: 河北农业大学, 2012. |
| [13] | Sieburth L E, Meyerowitz E M. Molecular dissection of the AGAMOUS control region shows that cis elements for spatial regulation are located intragenically [J]. Plant Cell, 1997, 9(3): 355-365. |
| [14] | Kim Y S, Ryuk J A, Ko B S. Discrimination of korean Rehmannia glutinosa from chinese Rehmannia glutinosa using sequence-characterized amplified region marker [J]. J Korean Soc Appl Biol Chem, 2012, 55(1): 1-6. |
| [15] | 刘志刚, 李明军, 张振臣. 地黄叶片遗传转化再生系统的建立 [J]. 河南农业科学, 2006(11): 83-85. |
| [16] | 李萌萌. 地黄高频再生体系的建立及遗传转化体系的初步研究 [D]. 北京: 中国中医科学院, 2007. |
 2014, Vol. 45
2014, Vol. 45


