2. 南通大学附属南通第三医院, 江苏 南通 226006;
3. 南通大学, 江苏 南通 226001;
4. 南京中医药大学, 江苏 南京 210023
2. Third Affiliated Hospital of Nantong University, Nantong 226006, China;
3. Nantong University, Nantong 226001, China;
4. Nanjing University of Chinese Medicine, Nanjing 210023, China
大黄为蓼科植物唐古特大黄Rheum tanguticum Maxim. ex Balf.、掌叶大黄Rheum palmatum L. 或药用大黄Rheum officinale Baill. 的干燥根及根茎。大黄主要含有蒽醌类、鞣质类、二苯乙烯类、苯丁酮类等多种化学成分,其中蒽醌类成分又分单蒽核类和双蒽核类,单蒽核类中游离型占10%~20%,研究最多的有芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚等5种,双蒽核类有番泻苷A~D等[1]。大黄中所有化学成分几乎均具有多种药理活性[2, 3],但目前的大部分研究仅围绕上述5种游离型蒽醌类成分,总蒽醌的测定也是基于酸解后这5种游离型蒽醌类的总和,《中国药典》2010年版对该药材的质量控制也是如此[4]。目前分别见有同时测定大黄中上述5个游离型蒽醌和番泻苷A、番泻苷B量及这7个成分加没食子酸、儿茶素合计9种成分量的报道等[5, 6],但测定结合型蒽醌量的报道较少。本研究建立了HPLC法同时测定大黄中5种游离型蒽醌、4种结合型蒽醌及没食子酸、儿茶素共计11种成分量的方法,旨在为较客观评价大黄药材的质量及其药效物质基础研究提供参考。
1 仪器与试药Waters Alliance高效液相色谱系统,包括e2695分离单元、2998二极管阵列检测器、Empower色谱工作站(美国Waters公司);SK5200H超声波清洗器(上海科导超声仪器有限公司);Sartorius BT 25S型电子天平(德国赛多利斯公司)。
对照品没食子酸(批号110831-201204,质量分数89.9%)、儿茶素(批号110877-201203,质量分数97.2%)、芦荟大黄素(批号110795-201007,质量分数98%)、大黄酸(批号110757-200206,质量分数≥98%)、大黄素(批号110756-200110,质量分数≥98%)、大黄酚(批号110796-201118,质量分数99.5%)、大黄素甲醚(批号110758-201013,质量分数99.8%)购自中国食品药品检定研究院,芦荟大黄素-8-O-葡萄糖苷(批号2012072301,质量分数≥98%)、大黄素-1-O-葡萄糖苷(批号2012072301,质量分数≥98%)、大黄酚-1-O-葡萄糖苷(批号2012072301,质量分数≥98%)、大黄素-8-O-葡萄糖苷(批号2012072301,质量分数≥98%)购自鼎瑞化工(上海)有限公司。
大黄药材(1号,批号121249-201003)购自中国食品药品检定研究院,大黄药材(2号,批号130703)购自南通三越中药饮片公司,大黄饮片(3~12号)购自江苏省内10家医院中药房,经南通市药品检验所龚旭东主任中药师鉴定为蓼科植物掌叶大黄Rheum palmatum L.。
甲醇均为色谱纯(国药集团化学试剂有限公司),纯净水(杭州娃哈哈集团有限公司)。
2 方法与结果 2.1 色谱条件Symmetry C18(250 mm×4.6 mm,5 μm)色谱柱;流动相为甲醇(A)-0.1%磷酸水(B),梯度洗脱:0~10 min,5%~30% A;10~40 min,30%~60% A;40~60 min,60% A;60~70 min:60%~100% A;70~80 min,100% A。体积流量1 mL/min;柱温30 ℃;检测波长254 nm。以上色谱条件下的样品及混合对照品色谱图见图 1。
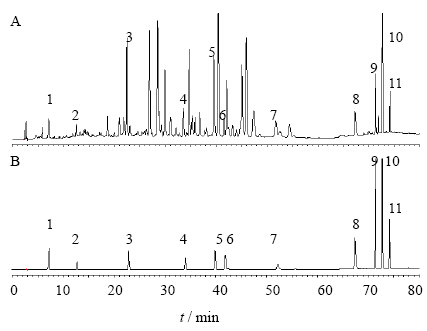 | 1-没食子酸 2-儿茶素 3-芦荟大黄素-8-O-葡萄糖苷 4-大黄素-1-O-葡萄糖苷 5-大黄酚-1-O-葡萄糖苷 6-大黄素-8-O-葡萄糖苷 7-芦荟大黄素 8-大黄酸 9-大黄素 10-大黄酚 11-大黄素甲醚
1-gallic acid 2-catechin 3-aloe-emodin-8-O-glucopyranoside 4-emodin-1-O-glucoside 5-chrysophanol-1-O-glucoside 6-emodin-8-O-glucoside 7-aloe-emodin 8-rhein 9-emodin 10-chrysophanol 11-physcion 图 1 样品 (A) 及混合对照品 (B) HPLC色谱图Fig.1 HPLC of sample (A) and mixed reference substances (B) |
精密称取没食子酸5.20 mg、儿茶素9.00 mg、大黄酚4.90 mg、大黄素甲醚8.15 mg分别置5 mL量瓶中,芦荟大黄素-8-O-葡萄糖苷1.03 mg、大黄素-1-O-葡萄糖苷1.02 mg、大黄酚-1-O-葡萄糖苷2.04 mg、大黄素-8-O-葡萄糖苷1.92 mg、芦荟大黄素1.98 mg、大黄酸2.02 mg、大黄素1.96 mg,分别置2 mL量瓶中,加甲醇至刻度,摇匀,分别配成11个对照品储备液。精密吸取儿茶素、大黄酚、大黄素甲醚储备液各1 mL,芦荟大黄素-8-O-葡萄糖苷储备液0.8 mL,大黄素储备液0.65 mL,没食子酸、大黄素-1-O-葡萄糖苷储备液各0.6 mL,大黄酚-1-O-葡萄糖苷、大黄酸储备液各0.5 mL,大黄素-8-O-葡萄糖苷储备液0.3 mL,芦荟大黄素0.2 mL,置10 mL量瓶中,加甲醇至刻度,摇匀,配成混合对照品溶液。将上述对照品储备液、混合对照品溶液于4 ℃保存,备用。
2.2.2 供试品溶液制备取样品粉末(过3号筛)各约0.5 g,精密称定,置25 mL量瓶中,加入甲醇24 mL,超声提取30 min,加甲醇至刻度,摇匀,滤过,取续滤液过0.45 μm滤膜,即得。
2.3 方法学考察 2.3.1 线性关系考察分别精密吸取混合对照品溶液1、5、10、15、20、25 μL,按“2.1”项下色谱条件进样,测定其峰面积值,以峰面积(Y)对进样量(X)进行回归处理,得11种成分的回归方程及线性范围,见表 1。
| 表 1 11种成分回归方程及线性范围 Table 1 Regression equations and linear ranges of 11 constituents |
精密吸取7号样品供试品溶液10 μL连续进样6次,记录没食子酸、儿茶素、芦荟大黄素-8-O-葡萄糖苷、大黄素-1-O-葡萄糖苷、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积积分值,计算RSD,分别为0.86%、1.73%、3.59%、4.20%、4.10%、2.10%、3.32%、0.66%、2.11%、0.32%和0.26%,表明仪器精密度良好。
2.3.3 稳定性试验精密吸取7号样品供试品溶液10 μL,分别于制备后的0、3、6、9、12、24 h进样测定,记录没食子酸、儿茶素、芦荟大黄素-8-O-葡萄糖苷、大黄素-1-O-葡萄糖苷、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积积分值,计算RSD,分别为1.61%、1.58%、4.48%、4.37%、4.29%、4.62%、3.61%、1.48%、2.05%、0.50%和1.28%,表明供试品溶液在24 h内稳定。
2.3.4 重复性试验称取7号样品粉末(过3号筛)各约0.5 g,精密称定,按“2.2.2”项方法制备6份供试品溶液,进样分析,计算没食子酸、儿茶素、芦荟大黄素-8-O-葡萄糖苷、大黄素-1-O-葡萄糖苷、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚平均质量分数的RSD,结果分别为4.83%、4.05%、4.11%、3.78%、4.23%、4.55%、3.81%、4.05%、4.27%、3.63%和3.44%,表明该方法的重复性良好。
2.3.5 回收率试验称取7号样品粉末(过3号筛)各约0.1 g 6份,精密称定,置10 mL量瓶中,分别精密添加一定体积11种对照品储备液,加甲醇至9.5 mL,按“2.2.2”项下方法制成10 mL供试品溶液,测定并计算各成分的加样回收率以及RSD。结果没食子酸、儿茶素、芦荟大黄素-8-O-葡萄糖、大黄素-1-O-葡萄糖苷、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的平均回收率分别为97.38%、96.43%、95.74%、96.42%、96.38%、96.92%、96.08%、96.91%、98.93%、95.52%和95.37%,RSD分别为2.08%、2.17%、1.09%、0.91%、0.43%、1.50%、1.79%、2.36%、1.08%、1.49%和1.82%。
2.4 样品测定分别精密吸取1~12号样品供试品溶液10 μL,注入高效液相色谱仪,测定各成分峰面积,代入回归方程,计算各成分在样品中的质量分数。结果见表 2。
| 表 2 12批大黄样品中11种成分的测定结果 Table 2 Determination of 11 constituents in 12 batches of Rhei Radix et Rhizome |
以11种成分的提取率为指标,考察了甲醇和乙醇两种提取溶剂,结果表明前者优于后者;考察了甲醇超声和回流2种提取方法,结果表明两者无明显差异;考察了甲醇超声提取30、45、60 min 3种提取时间,结果表明三者也无明显差异。故提取方法最终确定为甲醇超声30 min。
供试品溶液制备方法为称样量0.5 g定容至25 mL,按回收率试验应该称取0.25 g样品加含量相当的对照品储备液定容至25 mL,考虑到对照品比较昂贵,所以称样量减至0.1 g,定容体积相应减少为10 mL,实际两者是一致的。
从测定结果看,1号和2号样品(均为药材)游离型蒽醌量占总蒽醌量的比例分别为19.04%和30.57%,较其他10批样品(均为饮片,游离型蒽醌量占总蒽醌量的比例在69.99%~91.82%)的比例明显偏低,这与前期本课题组对分别以大黄药材和饮片组成的茵陈蒿汤中蒽醌类成分的测定结果一致[7],另有文献报道,与生大黄相比,熟大黄和大黄炭游离型蒽醌总量分别增加了75%和46%[8],其原因可能是饮片生产特别是浸润过程中导致部分结合型蒽醌水解为游离型。游离型蒽醌极性较小,难溶于水,而中药基本采用水煎煮服用,在总蒽醌量相近的情况下,游离型蒽醌占比偏高可能会影响疗效。而目前《中国药典》2010年版对大黄的质量控制主要是测定总蒽醌的量[4],建议增加游离型蒽醌的测定。
| [1] | 匡海学. 中药化学[M]. 北京: 中国中医药出版社, 2003. |
| [2] | 谭玉柱, 童婷婷, 赵高琼, 等. 基于一测多评法对大黄地上部位提取物的质量控制研究[J]. 中草药, 2013, 44(9): 1190-1194. |
| [3] | 乔振奎, 张卓然, 田立志, 等. 大黄素对犬自体肾移植缺血再灌注损伤的保护作用研究[J]. 现代药物与临床, 2014, 29(2): 131-134. |
| [4] | 中国药典[S]. 一部. 2010. |
| [5] | 王哲, 许利嘉, 何春年, 等. HPLC测定不同来源大黄中蒽醌和二蒽酮类成分[J]. 中草药, 2011, 42(6): 1114-1118. |
| [6] | 程小丽, 魏胜利, 刘春生, 等. RP-HPLC-DAD同时测定大黄中9种有效成分的含量[J]. 中国实验方剂学杂志, 2013, 19(18): 99-102. |
| [7] | 葛建华, 窦志华, 罗琳, 等. 高效液相色谱法测定茵陈蒿汤中5种蒽醌类成分的含量[J]. 中国医院药学杂志, 2009, 29(7): 590-592. |
| [8] | 李丽, 肖永庆. 大黄饮片炮制前后物质基础变化规律研究[J]. 中华中医药杂志, 2012, 27(4): 803-813. |
 2014, Vol. 45
2014, Vol. 45


