2. 中国中医科学院中药研究所, 北京 100700
2. Institute of Chinese Mateia Madica, China Academy of Chinese Medical Sciences, Beijing 100700, China
局灶性脑缺血发生后,脑梗死病灶由缺血中心区及其周围的缺血半暗带区组成,临床治疗的主要目的是拯救半暗带区神经细胞[1]。星形胶质细胞在脑梗死后神经元的存活和神经功能的恢复中发挥至关重要的作用。星形胶质细胞间存在大量以缝隙连接蛋白43(connexin 43,Cx43)为结构基础的缝隙连接,使得细胞之间相互沟通,形成强大功能体系[2]。脑缺血后,星形胶质细胞活化程度及Cx43表达变化对缺血半暗带区神经元存活或坏死起到了介导作用[3]。
黄连解毒汤对缺血性脑病具有良好的治疗作用[4,5,6,7,8]。本实验以缺血半暗带区星形胶质细胞活化及Cx43作为干预靶点,探讨黄连解毒汤水提物及其3个有效部位(总生物碱、总黄酮、总环烯醚萜)抗脑缺血作用机制。
1 材料 1.1 动物SPF级SD大鼠,雄性,体质量320~350 g,由北京维通利华实验动物技术有限公司提供,动物合格证号SCXK(京)2012-0001。动物饲养在首都医科大学实验动物中心SPF级实验室,动物实验设施许可证号SYXK(JING)2010-0020。动物在实验室适应1周后正式进行实验。
1.2 药品与试剂黄连解毒汤水提物及水提物3个有效部位(总生物碱、总黄酮、总环烯醚萜),由中国中医科学院中药研究所提供。黄连解毒汤药物处方组成:黄连9 g、黄芩9 g、黄柏6 g、栀子9 g。水提物粉末得率为20%;总生物碱为水提取液过D-151离子交换树脂,氨水-95%乙醇洗脱部分(质量分数为48.50%,主要成分有黄连碱、表小檗碱、小檗碱、巴马汀);总黄酮为水提取液过D-151离子交换树脂,60%乙醇洗脱部分(质量分数为32.22%,主要成分是黄芩苷、汉黄芩苷、黄芩素、汉黄芩素);总环稀醚萜为水提取液过SP825吸附树脂,30%乙醇洗脱部分(质量分数为43.08%,主要成分是栀子苷、京尼平龙胆双糖苷、京尼平苷)。小鼠抗胶质纤维酸性蛋白(GFAP),Millipore公司;兔抗Cx43,Abcam公司;Alexa Flur488标记山羊抗小鼠IgG、Dylight594-山羊抗兔IgG,由北京中杉金桥有限公司提供;RNAprep Pure动物组织总RNA提取试剂盒、RNase-Free DNase I试剂盒、SuperReal PreMix(SYBR Green)试剂盒和TIANScript cDNA第一链合成试剂盒,由天根生化科技有限公司提供。
1.3 仪器Centrifuge 5810R高速冷冻离心机(Eppendorf,美国);ASP 300全自动脱水机(Leica,德国);Eclipse生物显微镜(Nikon,日本);NIS-Elements Basic Research图像采集分析系统(Nikon,日本);7300型实时荧光定量PCR仪(ABI,美国);Mastercycler pro梯度PCR仪(Eppendorf,美国);微孔板检测系统(Molecular Devices,美国);ImageQuant350凝胶成像系统(GE Healthcare,美国)。
2 方法 2.1 分组及给药依据药理实验动物与人体临床等效剂量换算关系确定黄连解毒汤水提物及水提物3个有效部位的给药剂量。黄连解毒汤水提物大鼠给药剂量相当于临床等效剂量,1 g提取物折合处方生药量5 g,大鼠给药量为800 mg/kg。各有效部位的大鼠给药量按生药剂量确定,黄连解毒汤总生物碱1 g折合处方生药量90 g,大鼠给药量为44 mg/kg;总黄酮1 g折合处方生药量80 g,大鼠给药量为50 mg/kg;总环稀醚萜1 g折合处方生药量50 g,大鼠给药量为80 mg/kg。实验大鼠随机分为6组:假手术组、模型组、水提物组、总生物碱组、总黄酮组、总环烯醚萜组,每组11只动物。造模后2 h各给药组大鼠ig给药1次,造模24 h再ig给药1次,连续给药7 d,每天1次,给药体积为0.5 mL/100 g。假手术组、模型组ig等体积生理盐水。
2.2 大鼠永久性脑缺血模型的制备参照文献线栓法[9]建立大脑中动脉栓塞(MCAO)永久性缺血模型。雄性SD大鼠10%水合氯醛麻醉,仰卧位固定,常规消毒皮肤,结扎颈总动脉近心端和颈外动脉,将预先处理成圆头的尼龙线(直径0.265 mm)置于颈内动脉18 mm,扎紧动脉残端,缝合皮肤。假手术组大鼠麻醉后,仅暴露颈内、外动脉分支,不闭塞大脑中动脉。术中、术后室温严格控制在24~25 ℃,大鼠体温维持在36.5~37.5 ℃。待大鼠麻醉清醒后即刻观察其活动状态,术后出现明显左侧偏瘫体征(不能完全伸展左前肢、行走时向左侧倾倒或转圈)者选为实验对象。
2.3 指标检测 2.3.1 HE染色检测脑组织病理形态改变各组随机取4只动物,麻醉后,4%多聚甲醛0.1 mol/L磷酸缓冲液(pH 7.4)心内灌注固定,恒定灌注时间60 min。待固定充分后,开颅取脑,切取视交叉后4 mm组织块,常规石蜡包埋、切片,进行HE染色。光学显微镜下观察各组大鼠脑组织病理学改变,NIS-Elements Basic Research图像采集分析系统对缺血半暗带区顶叶皮层、尾壳核内侧各5个视野神经元进行计数。
2.3.2 GFAP免疫荧光染色观察星形胶质细胞活化程度石蜡切片机对石蜡包埋脑组织行冠状连续切片(片厚2 μm),贴附于经多聚赖氨酸处理过的载玻片上,在60 ℃温箱中烤干备用。采用免疫荧光染色进行GFAP染色,柠檬酸盐缓冲液高热修复20 min;一抗GFAP(1∶600)4 ℃孵育48 h;Alexa Flur488标记IgG(1∶400)避光孵育2 h;DAPI封片。Nikon荧光显微镜下观察,NIS-Elements Basic Research图像采集分析系统分析缺血半暗带区顶叶皮层、尾壳核内侧各5个视野GFAP免疫荧光强度。
2.3.3 GFAP/Cx43免疫荧光双标染色观察大鼠星形胶质细胞Cx43表达石蜡切片经柠檬酸盐缓冲液高热修复20 min;一抗GFAP(1∶600)及Cx43(1∶100)混合后4 ℃孵育48 h;二抗Alexa Flur488标记山羊抗小鼠IgG(1∶400)及Dylight 594-山羊抗兔IgG(1∶800)避光孵育2 h;DAPI封片。Nikon荧光显微镜下观察GFAP/Cx43双标阳性细胞,NIS-Elements Basic Research图像采集分析系统分析缺血半暗带区顶叶皮层、尾壳核内侧各5个视野Cx43免疫荧光强度。
2.3.4 实时RT-PCR检测Cx43基因表达按照总RNA提取试剂盒说明书提取大鼠缺血侧顶叶皮层(缺血半暗带区)RNA。根据RT-PCR 试剂盒的说明合成cDNA。PCR引物由大连TakaRa公司合成,β-actin产物长度为150 bp,正向引物序列为5’-GGAGATTACTGCCCTGGCTCCTA-3’,反向引物序列为5’-GACTCATCGTACTCCTGCTTGCTG-3’;Cx43产物长度为129 bp,正向引物序列为5’-GGAGATTACTGCCCTGGCTCCTA-3’,反向引物序列为5’-GACTCATCGTACTCCTGCTTGCTG-3’。扩增条件为95 ℃、5 min预变性,95 ℃、10 s,52 ℃、30 s,72 ℃、30 s,共40个循环。按照文献方法[10]分析实验数据,以看家基因β-actin为内参对照,2-ΔΔCt(Ct代表循环阀值)表示Cx43基因相对表达量。
2.4 统计学处理所有数据均以表示,SPSS 11.5统计软件包进行数据统计分析,组间比较采用单因素方差分析。
3 结果 3.1 对脑缺血大鼠脑组织病理学的影响HE染色显示,假手术组大鼠脑组织结构完整,神经元密集,层次清晰,形态正常。模型大鼠缺血中心区大量神经元及胶质细胞坏死脱失,血管水肿明显。缺血半暗带区部分神经元固缩塌陷、血管水肿明显。与模型组相比,黄连解毒汤水提物及有效部位(总生物碱、总黄酮、总环烯醚萜)组大鼠缺血半暗带区固缩浓染神经元减少,组织间隙水肿减轻,见图 1。
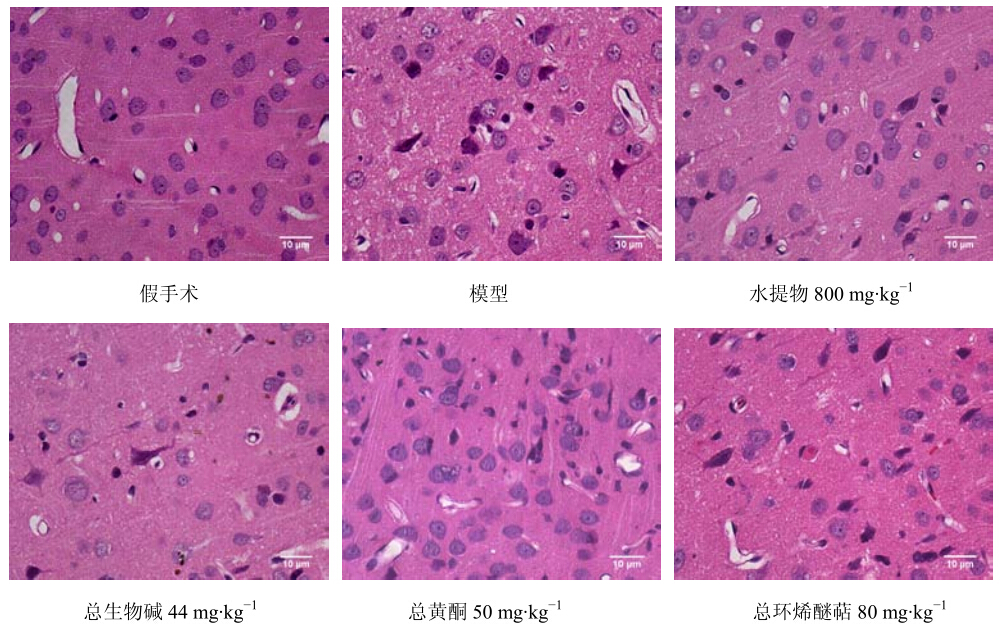
| 图 1 各组大鼠缺血侧顶叶皮层组织病理学观察 Fig.1 Histopathologic observation on parietal cortex of ischemic side in rats of each group |
图像分析结果显示,模型组、黄连解毒汤水提物及其有效部位组大鼠缺血半暗带区神经元计数较假手术组均明显减少(P<0.01)。黄连解毒汤水提物及其3个有效部位组大鼠缺血半暗带区顶叶皮层、尾壳核内侧神经元计数均较模型组明显增加(P<0.05、0.01),见表 1。
| 表 1 黄连解毒汤水提物及其有效部位对脑缺血大鼠缺血半暗带区神经元数目的影响 (x±s,n=4 ) Table 1 Effectof water extract and active fractions of HJD on number of neurons in ischemic penumbra of rats after cerebral ischemia (x±s,n=4 ) |
GFAP为成熟和反应性星形胶质细胞的特征性标记物。GFAP免疫荧光染色后,GFAP阳性细胞在激发波长470 nm、发射波长490 nm条件下呈现绿色荧光。脑缺血后,星形胶质细胞发生形态学改变,大量增粗变长的GFAP阳性纤维在缺血半暗带区交织成密集的网,其纤维末端向梗死灶的中央伸延。图像分析结果显示,模型组大鼠顶叶皮层和尾壳核内侧GFAP表达较假手术组明显增强(P<0.01);黄连解毒汤有效部位(总生物碱、总黄酮、总环烯醚萜)组大鼠顶叶皮层和尾壳核内侧GFAP表达均较模型组明显下调(P<0.05、0.01);与假手术组比较,水提物、总生物碱组大鼠顶叶皮层、尾壳核内侧GFAP表达均明显增强(P<0.01),总黄酮、总环烯醚萜组大鼠顶叶皮层GFAP表达也较假手术组明显上调(P<0.01),但尾壳核内侧GFAP表达与假手术组比较无统计学差异。结果见图 2和表 2。
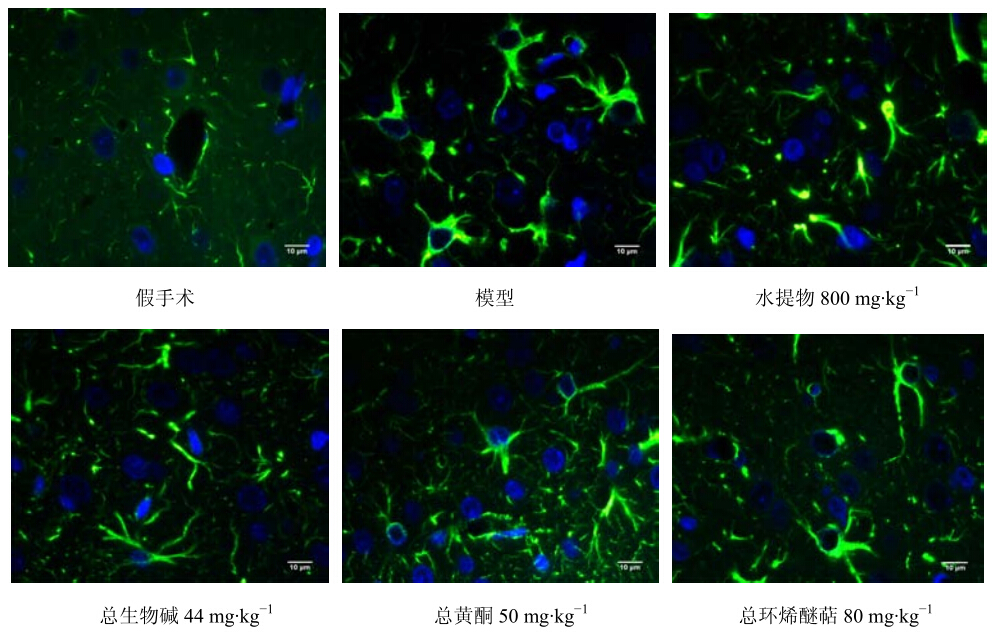
| 图 2 各组大鼠缺血侧顶叶皮层GFAP表达的观察 Fig.2 Expression of GFAP in parietal cortexof ischemic side in rats of each group |
| 表 2 黄连解毒汤水提物及其有效部位对脑缺血大鼠缺血半暗带区GFAP表达的影响 (x±s,n=4 ) Table 2 Effectof water extract andactive fractions of HJD on expression of GFAP in ischemic penumbra of rats after cerebral ischemia (x±s,n=4 ) |
GFAP/Cx43免疫荧光双标染色,在激发波长470 nm、发射波长490 nm条件下GFAP阳性细胞呈现绿色荧光,在激发波长540 nm、发射波长580 nm条件下Cx43阳性细胞呈现红色荧光。Cx43阳性细胞呈点状分布,与GFAP存在明显的共定位关系。局灶性脑缺血7 d大鼠缺血半暗带区Cx43表达强烈,呈团簇状分布在星形胶质细胞的终足部位,紧密包绕在毛细血管壁上。图像分析结果显示,模型组大鼠顶叶皮层和尾壳核内侧Cx43表达较假手
术组明显增强(P<0.01)。黄连解毒汤水提物及其有效部位(总生物碱、总黄酮、总环烯醚萜)Cx43表达较模型组显著下调(P<0.01),和假手术组相比无统计学差异。结果见图 3和表 3。
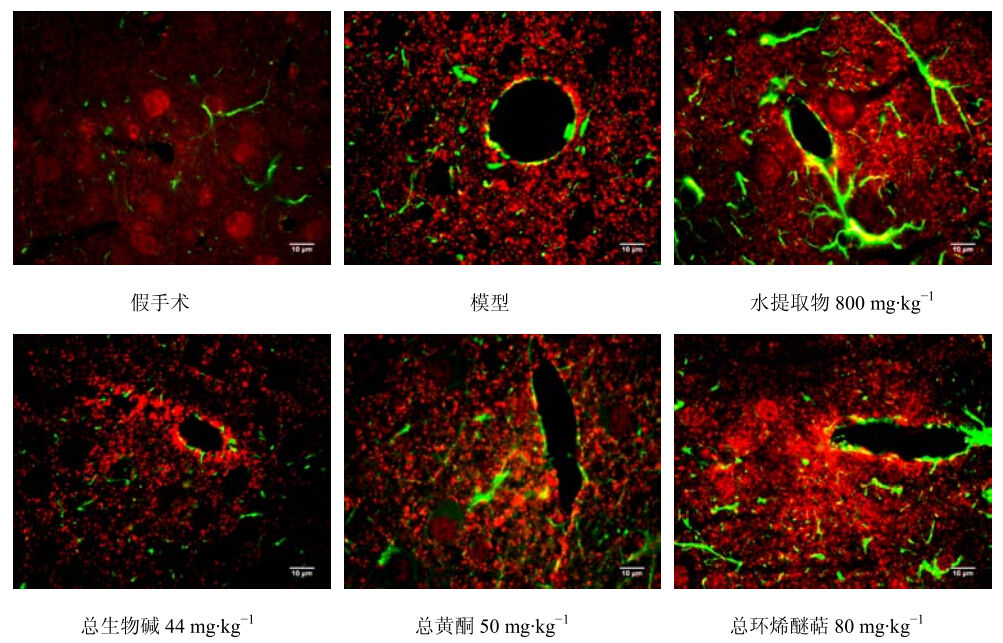
| 图 3 各组大鼠缺血侧顶叶皮层Cx43表达的观察 Fig.3 Expression of Cx43 in parietal cortex of ischemic side in rats of each group |
| 表 3 黄连解毒汤水提物及其有效部位对脑缺血大鼠缺血半暗带区Cx43表达的影响 (x±s,n=4 ) Table 3 Effectof water extract andactive fractions of HJD on expression of Cx43 in ischemic penumbra of rats after cerebral ischemia (x±s,n=4 ) |
内参β-actin、Cx43基因的熔点曲线均为单一峰,说明Cx43为特异性扩增。数据分析结果显示,模型组大鼠顶叶皮层Cx43 mRNA表达较假手术组明显增强(P<0.01)。黄连解毒汤水提物及其有效部位(总生物碱、总黄酮、总环烯醚萜)组大鼠皮层Cx43 mRNA表达较模型组均明显下调(P<0.05、0.01)。结果见表 4。
| 表 4 黄连解毒汤水提物及其有效部位对脑缺血大鼠顶叶皮层Cx43基因表达的影响 (x±s,n=4 ) Table 4 Effectof water extract andactive fractions of HJD on gene expression of Cx43 in parietal cortex of rats after focal cerebral ischemia (x±s,n=4 ) |
星形胶质细胞与神经元之间存在着复杂的细胞间相互作用,以维持神经系统内环境的稳定。观察和分析HE染色病理切片,发现中动脉栓塞7 d大鼠缺血半暗带区以及远隔脑区胶质细胞大量活化,胶质细胞周围部分神经元核固缩浓染呈三角形。表明,脑缺血不仅引起神经元的损伤,还会引起胶质细胞病理性改变。星形胶质细胞活化对神经元起保护或毒性作用[11],其双刃效应与缝隙连接功能改变密切相关[12]。实验中注意到脑缺血大鼠缺血半暗带区神经元数目减少,星形胶质细胞微丝结构蛋白GFAP表达增高的同时,Cx43免疫反应明显增强,同时Cx43转录水平增加,结果提示,星形胶质细胞活化、Cx43表达改变与缺血半暗带区神经细胞损伤存在直接的联系。近期研究表明,星形胶质细胞缝隙连接功能改变与缺血半暗带区神经元凋亡或死亡密切相关。一方面星形胶质细胞的缝隙连接通讯能将损伤信号分子从损伤中心区传递至半暗带区,导致半暗带区细胞死亡[13],另一方面,缺血半暗带区星形胶质细胞将自身的ATP、基本代谢物质、葡萄糖等营养物质通过缝隙连接顺着浓度梯度运送到损伤中心区的凋亡细胞,导致半暗带区更多的神经元因能量短缺而凋亡[14]。因而调节缝隙连接蛋白对保护缺血半暗带区神经元具有积极的意义。有报道显示,Cx43阻断剂辛醇可通过抑制海马及皮质Cx43表达,从而降低脑缺血模型死亡率及梗死体积,发挥神经保护作用[15]。
黄连解毒汤对缺血性中风具有良好的治疗作用[16],本实验结果也显示黄连解毒汤水提物3个有效部位(总生物碱、总黄酮、总环烯醚萜)可减轻局灶性脑缺血大鼠神经病理学损伤,增加缺血半暗带区存活神经元数目。在研究中,发现黄连解毒汤水提物及3个有效部位均可抑制脑缺血半暗带区星形胶质细胞异常活化,下调Cx43基因、蛋白表达。同时注意到黄连解毒汤总生物碱组大鼠缺血半暗带区Cx43基因、蛋白表达明显下调的同时,GFAP活化程度虽较模型组明显下调,但较假手术组明显增强,提示,黄连解毒汤总生物碱既促进星形胶质细胞适度活化,发挥其对神经元的保护作用,又自限了缺血半暗带区星形胶质细胞的过度活化,减少因其过度活化对神经元产生的损伤作用。
以往研究表明,黄连解毒汤生物碱类主要有效成分小檗碱可通过升高超氧化物歧化酶(SOD)活性、降低丙二醛(MDA)水平发挥抗缺血性脑损伤作用[17];黄连解毒汤黄酮类主要有效成分黄芩苷对缺血缺氧致脑组织脂质过氧化反应升高具有明显的拮抗作用[18],并可降低Ca2+量,促进热休克蛋白70表达[19];黄连解毒汤环烯醚萜类主要有效成分栀子苷为抗氧化剂,可减轻自由基引起的神经细胞损伤[20]。因此,推测黄连解毒汤抗脑缺血作用一方面通过清除氧自由基,减少钙内流、阻抑脑缺血损伤级联反应;另一方面可能通过抑制星形胶质细胞过度活化,干预Cx43表达,适时阻断星形胶质细胞缝隙连接,减轻氧自由基、炎性因子等毒性物质对神经元的损伤。
| [1] | Heiss W D.The ischemic penumbra: correlates in imaging and implications for treatment of ischemic stroke [J].Cerebrovasc Dis, 2011, 32(4): 307-320. |
| [2] | Rouach N, Koulakoff A, Abudara V, et al.Astroglial metabolic networks sustain hippocampal synaptic transmission [J].Science, 2008, 322(5907): 1551-1555. |
| [3] | Contreras J E, Sanchez H A, Veliz L P, et al.Role of connexin-based gap junction channels and hemichannels in ischemia-induced cell death innervous tissue [J].Brain Res Rev, 2004, 47(1/3): 290-303. |
| [4] | 张丽美, 李贵海.黄连解毒汤的药理及临床研究进展 [J].时珍国医国药, 2007, 18(7): 1635-1637. |
| [5] | 梁晖, 潘晓明.黄连解毒汤治疗急性期高血压性脑出血的临床研究 [J].湖南中医药大学学报, 2008, 28(1): 57-58. |
| [6] | 唐晓玲, 唐敏.黄连解毒汤临床研究进展 [J].实用中西医结合临床, 2010, 10(5): 90-92. |
| [7] | 吴彦, 孙建宁, 张爱林, 等.黄连解毒汤有效部位对实验性脑缺血的保护作用 [J].中药材, 2004, 27(5): 357-360. |
| [8] | 吴彦, 孙建宁, 于绍坤, 等.黄连解毒汤有效部位对动物脑缺血缺氧的保护作用 [J].中国现代应用药学, 2004, 21(6): 451-454. |
| [9] | 田金洲.血管性痴呆 [M].北京: 人民卫生出版社, 2003. |
| [10] | Livak K J, Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) method [J].Methods, 2001, 25(4): 402-408. |
| [11] | Buffo A, Rolando C, Ceruti S.Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential [J].Biochem Pharmacol, 2010, 79(2): 77-89. |
| [12] | Perea G, Araque A.Astrocytes potentiate transmitter release at single hippocampal synapses [J].Science, 2007, 317(5841): 1083-1086. |
| [13] | Karpuk N, Burkovetskaya M, Fritz T, et al.Neuroinflammation leads to region-dependent alterations in astrocyte gap junction communication and hemichannel activity [J].J Neurosci, 2011, 31(2): 414-422. |
| [14] | Contreras J E, Sanchez H A, Eugeni'n E A, et al.Metabolic inhibition induces opening of unapposed connexin 43 gap junction [J].PNAS, 2002, 99(1): 495-500. |
| [15] | 牛晓珊, 玛依努尔·买买提, 党辉, 等.缝隙连接蛋白-43阻断剂辛醇对小鼠脑缺血再灌注损伤的神经保护作用 [J].中风与神经疾病杂志, 2012, 29(5): 409-411. |
| [16] | 任玲玲, 薛兴亚.黄连解毒汤高效液相色谱分析方法的建立 [J].世界科学技术—中医药现代化, 2005, 7(5): 41-44. |
| [17] | 朱华旭, 张新龙, 曾明飞, 等.黄连解毒汤中小檗碱在脑缺血模型大鼠体内药动学与药效学相关性研究 [J].中草药, 2012, 43(3): 546-551. |
| [18] | 陈忻, 董晓丹, 张楠, 等.黄芩苷对局灶性脑缺血大鼠的保护作用 [J].广州中医药大学学报, 2006, 23(6): 506-508. |
| [19] | 刘萍, 张岫美, 王菊英, 等.黄芩苷对大鼠局灶性脑缺血再灌注损伤的保护作用 [J].中国药学杂志, 2007, 42(10): 743-748. |
| [20] | 周静, 邱碧菡, 潘林梅, 等.黄连解毒汤抗脑缺血有效部位中栀子苷的药动/药效学研究 [J].中国医院药学杂志, 2012, 32(7): 487-491. |
 2014, Vol. 45
2014, Vol. 45


