2. 浙江工业大学药学院, 浙江 杭州 310014;
3. 江苏康缘药业股份有限公司, 江苏 连云港 222001;
4. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. School of Pharmacy, Zhejiang University of Technology, Hangzhou 310014, China;
3. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China;
4. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Progress, Lianyungang 222001, China
银杏叶总黄酮(TFGF)是从银杏叶中提取的黄酮类化合物的总称,主要包括槲皮素、异鼠李素、山柰素3种苷元与糖基结合形成的黄酮醇苷。据报道银杏黄酮类成分在抗氧化和心血管疾病方面疗效显著[1,2]。
普通银杏叶制剂存在给药次数频繁、血药浓度波动大、不方便患者长期服用[3]。渗透泵控释制剂是以零级恒速释药为基本特征、以膜内外的渗透压差为释药动力的一种新型释药系统。渗透泵控释制剂主要有适用于水溶性药物的初级单室渗透泵控释片和适用于难溶性药物的双层渗透泵控释片。渗透泵制剂具有零级释药特征、释药行为不受环境pH值、胃肠蠕动等因素影响;可最大限度地避免或减小血药浓度波动,提高药物制剂的有效性和安全性;可减少服药次数,提高患者用药的顺应性[4]。因此,为避免普通制剂存在的不足,研制渗透泵控释片势在必行。渗透泵在国外早有上市,经济效益好,且开发周期短,所以产业化的前景较可观。本研究在单因素考察基础上采用星点设计[5,6,7],选出最优处方,制备了日服1次的TFGF双层渗透泵控释片。
1 仪器与材料DF—101S型集热磁力搅拌器(河南省太康科教仪器厂);AR1140型电子分析天平(奥豪斯国际贸易上海有限公司);AG245型超微量电子天平(瑞士Mettler Toledo公司);DZF—6020型真空干燥箱(上海精宏实验设备有限公司);TDP型单冲式压片机(上海第一制药机械厂);小型包衣机(上海黄海药检仪器厂),2RS—6G型智能溶出度仪(天津天大天发科技有限公司)。
TFGF(含槲皮素10.97%、山柰素10.39%、异鼠李素3.20%、总黄酮醇苷61.63%,江苏康缘药业有限公司提供);聚氧乙烯(PEO,上海卡乐康辅料有限公司);醋酸纤维素(CA,中国医药集团上海化学试剂公司);十二烷基硫酸钠(SDS,天津市博迪化工有限公司);聚乙二醇4000(PEG 4000,分析纯,沈阳化学试剂厂);氯化钠(分析纯,天津博迪化工有限公司);硬脂酸镁(上海药用辅厂);分析纯的无水乙醇和丙酮。
2 方法与结果 2.1 UV分析方法测定TFGF醇苷的方法主要有HPLC法和UV法[8],据文献报道,由于两者在测定TFGF醇苷时无显著性差异[9],因此本课题选择简单易行的UV法进行处方研究。
精密称取TFGF 40 mg,于100 mL量瓶中,加0.5% SDS溶液配制成400 μg/mL溶液,作为储备液。精密移取一定体积并稀释成质量浓度分别为4、8、12、16、20、32 μg/mL的溶液,在264 nm处测定吸光度(A)值,以A值为纵坐标,质量浓度(C)为横坐标,进行线性回归,得回归方程为A=0.024 4 C+0.001 5(R2=0.999 9),表明TFGF在0~32 μg/mL线性关系良好。
2.2 HPLC分析方法[10] 2.2.1 色谱条件色谱柱为Diamonsil C18柱(200 mm×4.6 mm,5 μm,迪马公司);保护柱C18柱(10 mm×4.6 mm,天津金州科学仪器有限公司);流动相为甲醇-0.4%磷酸溶液(55∶45);柱温为室温;检测波长360 nm;体积流量0.85 mL/min;进样量20 μL;理论塔板数按槲皮素峰计算应不低于2 500。
2.2.2 标准曲线的绘制分别精密称取槲皮素对照品3.0 mg、山柰素对照品3.0 mg和异鼠李素对照品2.0 mg于10 mL量瓶中,用甲醇溶解稀释至刻度,摇匀,得对照品储备液。
分别精密量取上述对照品溶液不同体积,加不同体积的甲醇溶液,稀释成一系列质量浓度溶液,进样20 μL,记录峰面积。由峰面积(A)对质量浓度(C)作线性回归,得回归方程分别为槲皮素A=76 809 C+133.5,R2=0.998 9(n=7),山柰素A=72 093 C+2 804,R2=0.998 8(n=7),异鼠李素A=72 755 C-19 243,R2=0.998 8(n=7)。结果表明,槲皮素和山柰素1.5~150 μg/mL线性关系良好,异鼠李素在1.0~100 μg/mL线性关系良好。
2.2.3 供试品溶液制备取供试品20片,精密称定,研细,精密称取粉末适量(相当于1片含药量),加甲醇-25%盐酸(4∶1)混合溶液50 mL,置水浴中加热回流2 h后,迅速冷却至室温,转移至100 mL量瓶中,用甲醇稀释至刻度,摇匀,用0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.3 TFGF双层渗透泵的制备及体外释放测定 2.3.1 制备工艺TFGF双层渗透泵控释片由片芯和包裹片芯的带有释药孔的半透衣膜组成。片芯分为含药层和助推层,含药层组成为TFGF、低相对分子质量PEO(PEO N-10,平均相对分子质量为1×105),促渗剂氯化钠、硬脂酸镁;助推层组成为高相对分子质量PEO(PEO WSR 303,平均相对分子质量为7×106),促渗剂氯化钠、硬脂酸镁。具体制备方法[11]为将处方量的药物与辅料分别过80目筛,以等量递加法混合均匀,用9 mm浅凹冲将含药层和助推层粉末压制成双层片芯即可。
将CA溶于丙酮之中,然后再加入溶于水中的PEG 4000溶液混合,搅拌4 h。在包衣锅转数为30 r/min,包衣液体积流量为8 mL/min,包衣床温度40 ℃的条件下进行包衣。包衣后在40 ℃下干燥12 h,然后在TFGF双层渗透泵片的含药层(淡黄色)表面打释药孔。
2.3.2 释放度测定按2010年版《中国药典》二部附录XD溶出度测定第一法,以900 mL的0.5% 十二烷基硫酸钠(SDS)溶液为溶出介质,转速为100 r/min,温度(37±0.5)℃。分别于1、2、4、6、8、10、12、14 h取样5 mL,过0.45 μm微孔滤膜,同时补加同温等体积的新鲜释放介质。取续滤液于264 nm下进行测定,以总黄酮醇苷的释放量为指标,计算其累积释放率[12]。
2.4 处方单因素考察影响TFGF双层渗透泵控释片的因素较多,为简化实验,本实验在固定包衣工艺参数和片芯制备工艺的条件下,对片芯处方和包衣膜处方进行简单的考察及评价。
2.4.1 含药层PEO种类对释放度的影响对于双层渗透泵来说,在含药层加入一些具有膨胀作用的高分子材料可以使药物达到混悬状态,有利于药物释放完全。本实验选择PEO作为含药层的助悬剂分别考察了助悬剂PEO N-10、PEO N-80、PEO N-750(相对分子质量分别为1×105、2×105和3×105)对释药行为的影响。由图 1的释放曲线可知,PEO的相对分子质量对药物释放有一定影响,相对分子质量越大,药物释放越慢,但PEO N-10和PEO N-80无太大区别,综合考虑最后选择以PEO N-10为助悬剂。
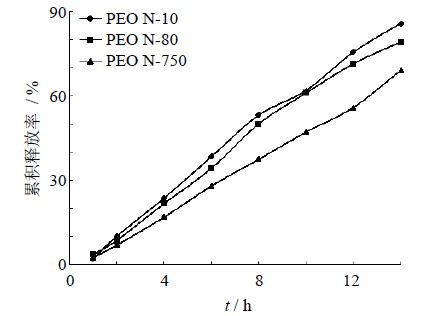 | 图 1 含药层不同相对分子质量的PEO对药物释放的影响 Fig. 1 Effect of PEO with different molecular weights in drug layer on drug release |
固定处方中其他辅料的用量,包衣和工艺条件不变,分别考察PEO N-10用量为10、20、40 mg时对药物释放度的影响。由图 2可知,含药层PEO用量对药物的释放没有显著影响。
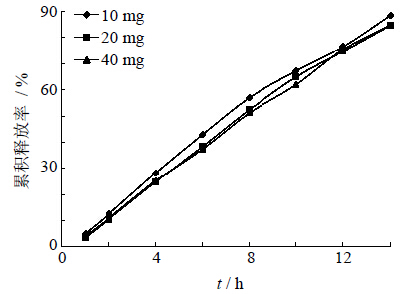 | 图 2 含药层PEO用量对药物释放的影响 Fig. 2 Effect of PEO amount in drug layer on drug release |
由于TFGF渗透压较小,需要加入促渗剂来调节渗透压。本实验选择甘露醇、氯化钠、乳糖3种常用的促渗剂进行考察。由图 3可知,3种促渗剂的活性:氯化钠>甘露醇>乳糖,由于氯化钠的流动性较好,因此综合考虑选择氯化钠为促渗剂。
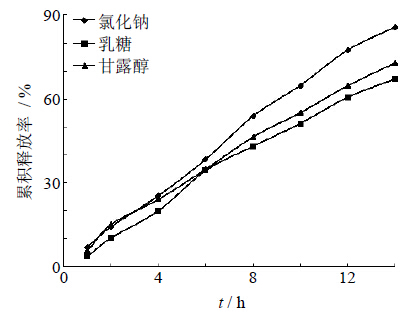 | 图 3 含药层不同促渗剂种类对药物释放的影响 Fig. 3 Effectof different osmotic promoting agents on drug release |
固定处方中主药、辅料和包衣工艺分别考察氯化钠用量为10、30、60 mg时,考察其对药物释放的影响。由图 4可知氯化钠的用量对药物释放无显著影响。
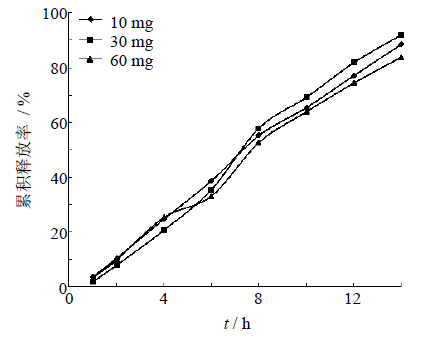 | 图 4 含药层促渗剂用量对药物释放的影响 Fig. 4 Effectof osmotic promoting agent amount on drug release |
助推层为药物的释放提供足够的动力,以此达到恒速释放,因此选择膨胀系数较大的PEO。本实验选择相对分子质量为7×106的PEO WSR303为助推剂,并考察其用量为50、100、150 mg时,对药物释放的影响。由图 5可知,PEO用量对药物释放无显著性影响。由于PEO为50 mg不能使药物有效的释放而150 mg会使助推层较厚,因此最终选择助推层中PEO WSR303为100 mg。
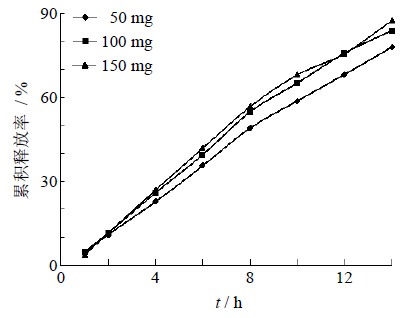 | 图 5 助推层PEO用量对药物释放的影响 Fig. 5 Effectof PEO amount in push-layer on drug release |
本实验选用氯化钠为助推层的促渗剂,考察其用量为10、30、50 mg时对药物释放的影响,见图 6。结果表明,氯化钠用量对药物释放没有显著影响。随着氯化钠用量的增加,单位促渗剂用量的变化对药物释放的影响越来越弱。
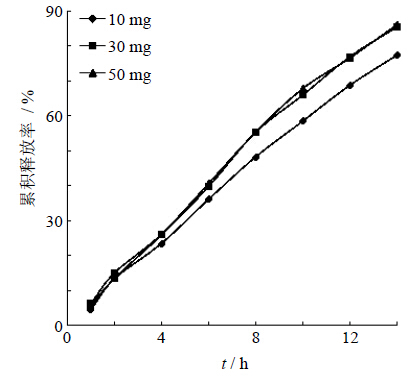 | 图 6 助推层促渗剂用量对药物释放的影响 Fig. 6 Effectof osmotic promoting agent amount in push-layer on drug release |
致孔剂用量的考察对释放度的影响 由于CA与其他包衣材料相比,具有坚固、坚韧、通透性好的特性,故选用其作为主要的成膜材料。此外,还应加入增强衣膜柔韧性和强度的增塑剂,以及能调节包衣膜对水的通透性的致孔剂。水溶性材料PEG可以起到上述2方面作用[13]。本实验在固定片芯处方、包衣增重和CA用量下,选择PEG 4000作为致孔剂,考察其不同用量对药物释放的影响,释放曲线见图 7。由图可知,致孔剂的用量对药物释放影响显著,药物的释放随着致孔剂用量的增加而增加。
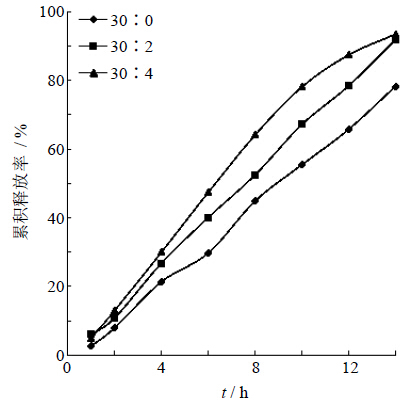 | 图 7 PEG 4000用量对药物释放的影响 Fig. 7 Effect of PEG 4000 amount on drug release |
固定片芯处方和工艺条件,以衣膜质量(用片芯增重计算)表示包衣膜的厚度,制备衣膜增重分别为4%、7%、9%的渗透泵控释片,考察包衣膜增重对药物释放的影响,释放曲线见图 8。结果表明,包衣增重对药物的释放有显著的影响,包衣增重越大,药物释放越慢。
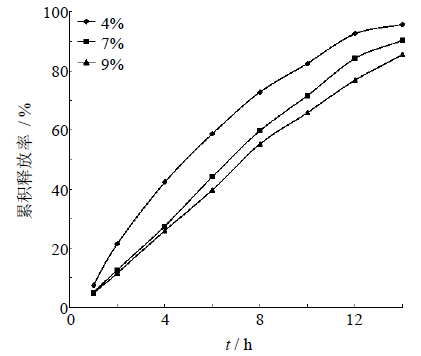 | 图 8 包衣增重对药物释放的影响 Fig. 8 Effectof membrane weight gain on drug release |
在单因素考察的基础上,选择对释药行为影响较显著的2个因素作为考察因素,即包衣增重(X1)、致孔剂PEG 4000的用量(X2)为考察因素,以TFGF双层渗透泵控释片在1 h内的累计释放量(Y1)、14 h内累积释放量(Y2)、1~12 h TFGF双层渗透泵控释片的累积释放曲线的复相关系数(R2,Y3)为考察指标,做2因素5水平的星点设计。根据星点设计原理,各因素取5个水平,用代码-α、-1、0、1、α来表示。对于2因素星点设计α=1.414,在单因素考察的基础上确定X1的范围为6%~12%、X2的范围为0~4 g。因素和水平代码以及实验结果安排见表 1和表 2。
|
|
表 1 星点设计的因素与水平 Table 1 Factors and levels of central composite design |
|
|
表 2 星点设计结果 Table 2 Results of central composite design |
采用Design-Expert 8.0软件对所测得各实验数据进行处理,并对各水平进行多元非线性回归,得到二项式拟合方程分别为Y1=6.24-0.95 X1+0.493 X2-0.13 X1X2+0.19 X12-1.69 X22(R2=0.946 9,P=0.000 2),Y2=92.44-2.21 X1+4.93 X2+1.29 X1X2+0.25 X12-3.60 X22(R2=0.969 3,P<0.000 1),Y3=0.99+4.864×10-3 X1-9.927×10-4 X2+3.450×10-3 X1X2+2.563×10-4 X12+2.73×10-3 X22(R2=0.956 2,P=0.000 1)。
由回归方程的R2和P可知,设计模型拟合程度良好,可以用此模型对TFGF双层渗透泵的处方进行分析和预测。
由表 3方差分析结果可知,包衣增重对TFGF双层渗透泵控释片在1~12 h累积释放曲线的R2具有非常显著的影响(P<0.01),随着包衣增重的减少,对药物累积释放曲线的R2具有负相关作用,可能是因为衣膜较薄,水分进入片芯的速度较快,致使含药层水化速度快于助推层而产生较大的膨胀压,因而释药动力主要由含药层提供,使药物释放过快,导致累计释放曲线的的R2较小。致孔剂对1~12 h内的累积释放量有非常显著影响(P<0.01),可能是增加了衣膜的通透性,使水分易于进入片芯,加速了药物的释放。
|
|
表 3 响应值Y1、Y2和Y3的方差分析 Table 3 Variance analysis of responses Y1,Y2,and Y3 |
应用实验设计软件,根据拟合所得的模型,选择指标Y1、Y2、Y3和2个因素X1、X2,绘制三维效应面图(图 9)。从效应图可以直观地看出效应趋势。
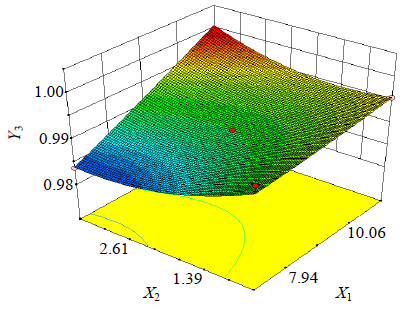 | 图 9 X1和X2对效应值Y3的影响 Fig. 9 Effects of X1 and X2 on response Y3 by response surface plot |
诸多因素对R2有影响,如图 9所示,随着致孔剂用量的增多和包衣增重的减小,Y3有减小的趋势,且致孔剂和包衣增重对Y3有交互作用。这可能是随着包衣增重的减少或者是致孔剂的增多,水分进入片芯的速度较快,致使含药层水化速度较助推层快,而提供主要的释药动力,使药物释放过快,因此1~12 h内零级释放特征不显著,线性复相关性系数下降。本实验Y1小于10%,Y2大于85%,Y3控制在0.980 0~1.000 0,通过满意度来预测最优处方。结果表明最优处方为X1=7.58%,X2=3.41 g。
2.8 优化处方的验证在预测最优处方的基础上,按相同制备工艺制备3批TFGF双层渗透泵片进行验证。
按UV法对最优处方的溶出样品进行检测:TFGF双层渗透泵控释片的释放结果见表 4和图 10。由表 4可见,各指标偏差的绝对值均小于5%,建立的数学模型具有良好的预测效果。
|
|
表 4 最优处方的实测值与预测值 Table 4 Observed and predicted response values of optimized formulation |
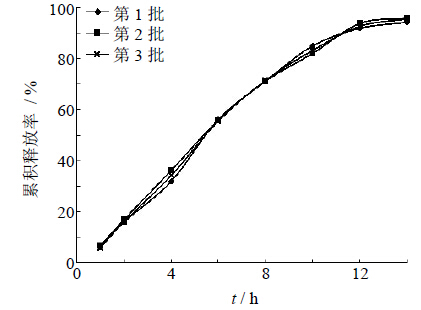 | 图 10 优化处方的药物释放曲线 Fig. 10 Release profile of optimized formulation |
按HPLC法对最优处方的溶出样品进行检测:取各时间点下的样品溶液,按“2.2.3”项下供试品溶液制备方法进行样品处理,进样,记录峰面积,以自身对照法计算相应质量浓度。各苷元成分的释放曲线见图 11。
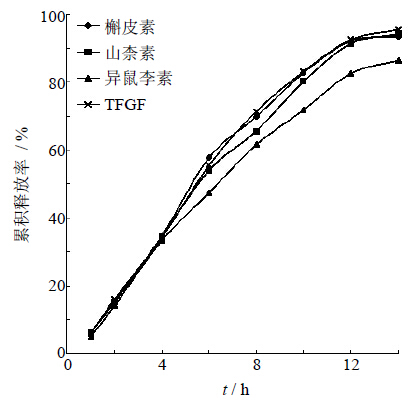 | 图 11 优化处方的药物中各苷元成分释放曲线 Fig. 11 Release profile of optimized formulation of aglycones |
由表 5可知,采用相似因子f2法[11]对总黄酮和3种苷元的释放度曲线进行相似性评价,f2值均大于50,说明总黄酮和3种苷元的释放曲线之间相似性较好,并达到了同步释放的要求。
|
|
表 5 释放度的2种检测方法的f2值 Table 5 f2 values of two analysis methods in detection of drug release |
TFGF主要包括槲皮素、山柰素、异鼠李素3种苷元以及与糖结合形成的黄酮醇苷,其中还有其他难溶性药物[13]。据文献报道[9,14],多成分的中药若制成单层渗透泵控释片,其零级释药效果不明显,且药物释放不完全,而双层渗透泵片可以使其中不同溶解度的有效部位群释放完全并且呈现零级释放的特点,因此选择制备成双层渗透泵控释片。
致孔剂和包衣增重对释药有显著影响,1、14 h内的累积释药量随着致孔剂的增加而加大,而随着包衣增重的增加而减少,当包衣增重较小时1 h内的释药可能会发生突释效应,这可能是衣膜较薄,片芯中的药物释放出孔外时经过的路径较少有关,也可能是因为衣膜较薄对水的通透性增加,水进入片芯后能很好地溶解并混悬药物,使释药速率增加。
采用星点设计-效应面法筛选和优化处方,克服了正交设计和均匀设计的缺点,因为在大多数情况下,各因素对效应的影响并不是线性的,因此选择线性数学模型进行拟合,精度不够,预测性较差。而选择非线性拟合的实验设计方法可以解决此类问题。本研究采用了星点设计-效应面法对TFGF双层渗透泵控释片处方进行优化,用多指标综合考察,得到的最优处方1 h内释放量符合要求,14 h累积释放量均达到85%以上,且释放符合零级释药的要求。通过处方验证表明,所拟合的方程具有很好的预测性。
| [1] | 王飞娟. 银杏叶中黄酮类化合物的研究进展 [J]. 西北药学杂志, 2010, 25(2): 155-156. |
| [2] | 王大力, 狄 斌, 李 龙, 等. 银杏叶片中银杏黄酮在比格犬体内的药动学研究 [J]. 中国现代应用药学,2012, 29(6): 483-486. |
| [3] | 王建筑, 郝吉福, 郭丰广, 等. 银杏叶提取物缓释片的制备 [J]. 中国医院药学杂志, 2011, 31(16): 1351-1354. |
| [4] | 黄 涛, 孙燕燕, 林 宏, 等. 中药口服渗透泵制剂的研究进展 [J]. 现代药物与临床, 2012, 27(6): 642-645. |
| [5] | Nutan M T H, Soliman M S, Taha E I, et al. Optimization and characterization of controlled release multiparticulate beads coated with starch acetate [J]. Int J Pharm, 2005, 294(1/2): 89-101. |
| [6] | 张志宏, 唐 歆, 彭 博. 星点设计-效应面法优化双嘧达莫漂浮渗透泵给药系统 [J]. 药学学报, 2009, 44(2): 203-207. |
| [7] | 刘艳杰, 武项荣. 星点设计效应面优化法在药学实验设计中的应用 [J]. 中国现代应用药学杂志, 2007, 24(6): 455-457. |
| [8] | 姜 帆, 杨星钢, 郭迎新, 等. 银杏叶制剂溶出液中槲皮素、山柰素与异鼠李素的HPLC测定方法研究 [J]. 沈阳药科大学学报, 2013, 30(9): 691-695. |
| [9] | 郭迎新, 潘卫三, 李 非, 等. 不同检测方法在银杏叶缓释制剂处方设计中的比较研究 [J]. 天津中医药大学学报, 2013, 32(3): 157-160. |
| [10] | van Beek T A, Montoro P. Chemical analysis and quality control of Ginkgo biloba leaves, extracts, and phyto- pharmaceuticals [J]. J Chromatogr A, 2009, 1216(11): 2002-2032 |
| [11] | 郭迎新. 银杏叶提取物缓控释制剂的研究 [D]. 沈阳: 沈阳药科大学, 2013. |
| [12] | 吕慧怡, 范 青, 邓 卅. 不同pH介质中银杏叶总黄酮醇苷溶出度的考察 [J]. 中国药事, 2005, 19(12): 750-752. |
| [13] | 孙光美. 大剂量难溶性药物非诺贝特渗透泵控释制剂的研究 [D]. 沈阳: 沈阳药科大学, 2009. |
| [14] | 杨星钢. 复方中药精制冠心渗透泵控释制剂的设计评价 [D]. 沈阳: 沈阳药科大学, 2006. |
 2014, Vol. 45
2014, Vol. 45


