2. 复旦大学药学院, 上海 201203;
3. 云南中医学院中药学院, 云南 昆明 650500
2. College of Pharmacy, Fudan University, Shanghai 201203, China;
3. College of Chinese Materia Medica, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China
金铁锁Psammosilene tunicoides W. C. Wu et C. Y. Wu是石竹科单种属金铁锁属植物,分布于云南、贵州、四川和西藏等省,主产于云南西北部、中部和东北部。金铁锁被列为国家二级保护植物,是“云南白药”的主要组成药材之一,主要以根入药,具有散瘀定痛、止血、消痈排脓的功效,用于跌打损伤、风湿痛、胃痛、创伤出血等的治疗[1]。长期以来,金铁锁完全靠野外采挖,加之自然生长缓慢,因而野生资源迅速减少,自然产量大幅降低。金铁锁资源已经不能满足“云南白药”等中成药的需求。但金铁锁皂苷结构复杂,人工合成困难,天然资源来源限制,欲从分子生物方面着手对此类化合物的主要合成途径进行研究。金铁锁的主要有效成分为金铁锁皂苷(主要为三萜皂苷元),具有抗炎和镇痛等重要药理活性[2]。三萜皂苷(triterpenoid saponins)是一类重要的植物次生代谢产物,广泛分布于植物界中,有抗菌和抗虫害的作用,可用作药物,具有重要的商业价值。β-香树素合酶是三萜皂苷合成中关键酶,2,3-氧化鲨烯经过2,3-氧化鲨烯环化酶(OSC)的环化作用得到三萜类骨架,然后在β-香树素合酶作用下得到β-香树素,再经过一系列酶的催化,包括细胞色素P450、酰基转移酶以及糖苷转移酶等生物转化最后得到极具药用价值的五环三萜皂苷[3]。本课题组将对β-香树素合酶的cDNA进行相关研究,阐明其在三萜皂苷合成途径中的关键步骤中的作用。为次生代谢产物工程技术在金铁锁上的应用奠定基础,对三萜皂苷的生物合成机制探究有重要意义。
1 材料与试剂 1.1 材料样品采自西藏林芝,批号为20060822,由云南中医学院钱子刚教授鉴定为石竹科金铁锁属植物金铁锁Psammosilene tunicoides W. C. Wu et C. Y. Wu的根。
1.2 试剂试剂SMARTTM RACE cDNA ampification kit(Clontech公司),LA Taq(TaKaRa公司),Plasmid mini kit II(Biomiga公司),bacterial protein extraction kit(Bio Basic公司),NucleoTrap Gel Extraction Kit(Clontech公司),pMD18-T Vector(TaKaRa公司),pMD20-T Vector(TaKaRa),pEASYTM-E1 Expression Kit(TransGen Biotech公司),Trans1-T1 Phage Resistant Chemically Competent Cell(TransGen Biotech公司),BL21(DE3)plysS Chemically Competent Cell(TransGen Biotech公司),IPTG(TransGen Biotech公司),2,3-氧化鲨烯(95%,Sigma公司)及常用分子生物学试剂,硅胶G板(青岛海洋化工有限公司)及其他生化试剂和分析纯试剂。
2 金铁锁β-香树素合酶基因的获得 2.1 总RNA的提取采用Trizol法提取金铁锁根的总RNA。
2.2 RACE-ready first-strand cDNA的合成提取的总RNA样品1 μg,按照SMARTTM RACE cDNA ampification kit说明书进行合成,产物加100 μL Tricine-EDTA 缓冲液稀释,-20 ℃保存备用。
2.3 5’-和3’-RACE以已得到的β-AS核心基因片段为模板,Primer5.0设计5’-和3’-RACE反应引物,PBSS5:5’-CTTCAACC-CAACAAGCCAACATACAC-3’和PBSS3:5’-GGAAG-AGGTTCGTTGGTCCGATTAC-3’,按照SMARTTM RACE cDNA ampification kit说明书,PCR条件为94 ℃、30 s,72 ℃、3 min,5个循环;94 ℃、30 s,70 ℃、30 s,72 ℃、3 min,5个循环;94 ℃、30 s,68 s,72 ℃、3 min,305个循环;4 ℃终止。PCR产物经1%的琼脂糖凝胶电泳分离,并切胶回收后插入pMD18-T Vector,转入Trans1-T1感受态中,菌株在含80 μg/mL氨苄青霉素的LB平板上筛选,PCR验证为阳性克隆的菌落测序。最后菌株-80 ℃保种。
2.4 全长β-AS cDNA的获得用BioEdit软件拼接出全长序列,用Primer 5.0设计扩增全长β-AS cDNA的PCR引物,B1-1:5’-ATTAGTATTAGTTGTAGCAC-3’和B1-2:5’-AC-TTTCATTATTTTGGACGT-3,用5’-RACE-ready first-strand cDNA为模板,进行PCR扩增。PCR条件为94 ℃,3 min;94 ℃,30 s;38 ℃,30 s;72 ℃,3 min,30个循环;72 ℃,10 min;4 ℃终止。PCR产物经1%的琼脂糖凝胶电泳分离,并切胶回收后插入pMD20-T Vector,转入Trans1-T1 Phage Resistant Chemically Competent Cell中,菌株在含80 μg/mL氨苄青霉素的LB平板上筛选,PCR验证为阳性单克隆的菌落测序并-80 ℃保种。
2.5 表达载体的构建将全长β-AS基因切胶产物插入pEASYTM-E1 Expression Vector,获得pβ-AS-vector,转入Trans1-T1感受态中,菌株在含有50 μg/mL氨苄青霉素的LB平板上筛选,PCR验证为阳性单克隆的菌落测序并-80 ℃保种。阳性单克隆菌株抽取质粒,-20 ℃保存备用。
2.6 异丙基-β-D-硫代半乳糖苷(IPTG)诱导原核表达和粗蛋白的提取将pEASYTM-E1 Expression Vector(空载体)和pβ-AS-vector分别转入表达菌株BL21(DE3)plysS中,挑取经PCR验证的阳性单克隆菌株转入50 mL含有50 μg/mL氨苄青霉素的LB液体培养基中,37 ℃振荡培养至A600=0.3~0.5,加入100 mmol/L的IPTG至终浓度为0.4 mmol/L,32 ℃继续培养3.5 h,离心收集表达菌体,-80 ℃保存。粗蛋白的提取按照Bacterial Protein Extraction Kit说明书操作。提取的粗蛋白经SDS-PAGE 电泳分析,将含有目的蛋白的提取液过Sephadex G-25小柱,采用Brandford法测定蛋白量。
2.7 表达产物的功能鉴定参照金铁锁鲨烯合酶体外酶促反应体系[4,5],取经Ni2+琼脂糖柱纯化的重组鲨烯合酶蛋白10 μg,以2,3-氧化鲨烯为底物,进行体外酶促反应,反应体系为3 mmol/L NADPHNa4,100 mmol/L Tris-HCl(pH 7.5),10 mmol/L MgCl2,1 mmol/L DTT,2% glycerin;500 μg/L酶液;40 μg/L FPP,上覆1倍体积正己烷,32 ℃ 10 h,10 000×g离心,取上层有机相,分别进行TLC及HPLC。TLC分析条件:环己烷-醋酸乙酯 4∶1;HPLC分析条件:色谱柱为ODS柱(250 mm×4.6 mm,5 μm);柱温30 ℃;流动相为甲醇-水(75∶25);体积流量1 mL/min;检测波长210 nm;进样量10 μL。
3 结果与分析 3.1 总RNA的质量琼脂糖凝胶电泳检测总RNA,结果见图 1,18 S与28 S的比约为1∶2,点样孔周围无污染。
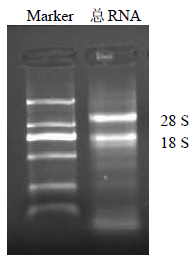 | 图 1 金铁锁总RNA电泳检测 Fig. 1 Electrophoresis of total RNA in P. tunicoides |
5’-RACE片段约为1 600 bp,3’-RACE片段约为1 700 bp(图 2)。
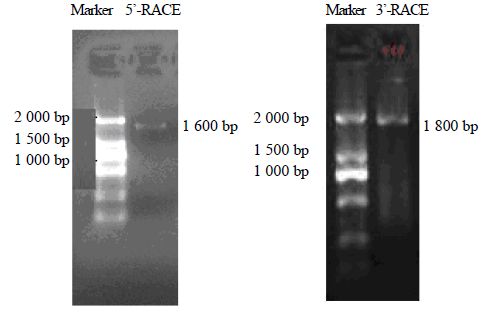 | 图 2 5’-RACE和3’-RACE电泳检测 Fig. 2 Electrophoresis of 5’-RACE and 3’-RACE |
将5’-RACE和3’-RACE片段进行拼接后设计引物扩增后得到约为2 700 bp的全长β-AS cDNA片段(Figure 3">图 3)。测序后并对序列进行分析得到,β-AS cDNA全长2 882 bp,ORF长2 284 bp,编码760个氨基酸。经EditSeq软件分析得到蛋白质相对分子质量为87 454.75,等电点为6.178。β-AS cDNA全长与王不留行Vaccaria hispanica (Neck.) Garcke同源性为87%;与天南星Gypsophila paniculata Blume同源性为88%;与光果甘草Glycyrrhiza glabra L. 同源性为75%,与人参Panax ginseng C. A. Mey. 同源性为70%,与三七Panax notoginseng Wall. var.notoginseng (Burkill) Hoo et Tseng同源性为70%。
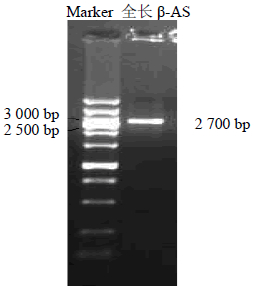 | 图 3 全长β-AS cDNA PCR电泳检测 Fig. 3 Electrophoresis of full-length β-AS cDNA PCR |
首先将已得到的全长cDNA与pEASYTM-E1 Vector进行连接,得到有目的DNA片段、具有Amp抗性、带T7启动子、His标签的pEASYTM-E1 Vector融合表达载体质粒pβ-AS-vector,然后转入Trans1-T1感受态细胞,经过Amp筛选的单克隆进行PCR验证为阳性克隆(图 4)。将阳性克隆的重组质粒pβ-AS-vector抽提后(图 5)成功转入表达菌株BL21(DE3)plysS(图 6)中,经Amp筛选的阳性克隆经引物T7 promotor primer和目的基因反向引物B1-2进行PCR验证出正确表达方向的阳性重组子,用该阳性重组子进行蛋白表达。
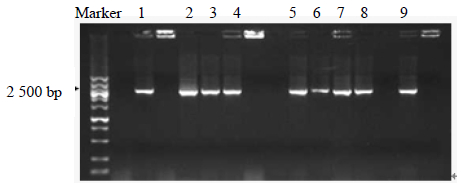 | 1~9-扩增产物 1—9-amplification products图 4 pβ-AS-vector转Trans1-T1阳性单克隆PCR鉴定 Fig. 4 PCR of positive clone by transferring |
 | 1~4-扩增产物 1—4-amplification products图 5 pβ-AS-vector质粒抽提 Fig. 5 Extraction of pβ-AS-vectorplasmid |
 | 1~4-扩增产物 1—4-amplification products图 6 pβ-AS-vector转入表达菌株BL21 (DE3) plysS阳性克隆PCR鉴定 Fig. 6 PCR of positive clone by transferring pβ-AS-vector into BL21 (DE3) plysS |
用pEASY-E1Vector空载体,转入B21(DE3)作为对照,装有pβ-AS-vector并具有正确表达方向的阳性重组菌株记作β-1,含有pEASY-E1 Vector空载体的B21(DE3)不表达蛋白,含有pβ-AS-vector的阳性重组菌株在IPTG的诱导下表达出相应的蛋白,大小为87 000左右。因此,β-香树素 synthase在大肠杆菌中成功表达。经提取纯化的粗蛋白经SDS-PAGE电泳分析(图 7),大小为87 000左右,与预测结果一致。
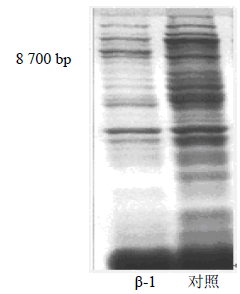 | 图 7 表达蛋白的SDS-PAGE结果 Fig. 7 SDS-PAGE of protein expression |
经环己烷-醋酸乙酯(4∶1)展开,10%的硫酸乙醇显色,分析结果表明,样品和对照品在同一位置显相同斑点且样品和对照品斑点重合,表明样品中含有β-amyrin(图 8)。
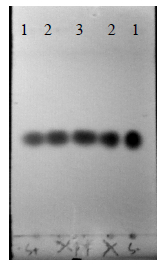 | 1-β-香树素合成酶催化产物样品 2-样品与β-amyrin对照品混合物 3-β-amyrin 1-catalytic products of β-amyrin synthase 2-mixture of samples and β-amyrin reference substance 3-β-amyrin图 8 β-香树素合成酶催化产物的TLC分析 Fig. 8 TLC analysis of catalytic products of β-amyrin synthase |
以甲醇-水(75∶25)为流动相,检测波长210 nm,进样量10 μL。结果分析表明,在210 nm,保留时间为3.5 min处催化产物样品色谱图出现与β-香树素相应的特征峰,所以该样品含有β-香树素。因此,所得的全长cDNA可表达出催化2,3-氧化鲨烯生成β-香树素的蛋白酶。
4 讨论本研究中,本课题组选择用金铁锁根提取总RNA,是因为金铁锁的药用部位是根部,且有效成分在根部质量分数较高,这样能更好地保证得到所要研究的基因片段。对金铁锁β-香树素合成酶基因序列进行分析显示,该序列与本项目组前期所得金铁锁β-香树素合成酶基因核心片段序列的同源性为99%(GenBank:EF533703.1),证明其为金铁锁β-香树素合成酶基因。
在β-香树素合成酶基因的原核表达中,本课题组选用根据融合表达载体改进的pEASY Expression Vector,并且高表达的BL(DE3)plysS菌株对其进行表达,因为在对BL(DE3)和BL(DE3)plysS两种菌株进行筛选时发现,pEASY Expression Vector对BL(DE3)plysS转化率高,得到了可溶并完整的β-香树素合成酶蛋白,通过β-香树素合成酶催化产物的TLC、HPLC分析,表达产物具有催化2,3-氧化鲨烯得到β-香树素的活性。并且BL21(DE3)plys的T7 RNA聚合酶基因能防止表达的融合蛋白质分解[10]。
| [1] | 王学勇, 邱德文, 蒋朝晖. 苗族药物金铁锁研究进展 [J]. 中国中医基础医学杂志, 2002, 8(11): 77-82. |
| [2] | 金 虹, 谭克勤. 西南民族药金铁锁的研究现状及展望 [J]. 中医药导报, 2005, 11(12): 66-67. |
| [3] | 刘 强, 丛丽娜, 张宗申. 植物甾醇与三萜类皂苷生物合成基因调控的研究进展 [J]. 安徽农业科学, 2006, 34 (19): 4844-4846. |
| [4] | 戴住波, 钱子刚, 胡运乾, 等. 金铁锁鲨烯合酶cDNA的克隆和功能鉴定 [J]. 药学学报, 2008, 43(12): 1245-1250. |
| [5] | Nakashim A T, Inoue T. Cloning, expression, and characterization of cDNA encoding A. thaliana squalene synthase [J]. PNAS, 1995, 92: 2328-2332. |
| [6] | Tetsuo K, Masaaki S, Yutaka E. β-Amyrin synthase cloning of oxidosqualene cyclase that catalyzes the formation of the most popular triterpene among higher plants [J]. Eur J Biochem, 1998, 256: 238-244. |
| [7] | 周 超, 孙 伟, 宋 刚. 人参北芪片主要成分的鉴别 [J]. 中国药业, 2008, 10(17): 34. |
| [8] | 郭 杰, 徐 嵬, 杨秀伟. 娑罗子中三萜皂苷成分的HPLC定量分析 [J]. 中草药, 2007, 38(5): 767-770. |
| [9] | 秦学玲, 杨崇仁, 杨庆雄, 等. 金铁锁中3-O-6′-甲基-β-D葡萄糖醛酸丝石竹苷的含量测定 [J]. 中国药科大学学报, 2006, 37(6): 516-518. |
| [10] | Jennifer G, John J D. ompT encodes the Escherichia coli outer membrane protease that cleaves T7 RNA polymerase during purification [J]. J Bacteriol, 1988, 170: 1245-1253. |
 2014, Vol. 45
2014, Vol. 45


