2. 天津药物研究院新药评价有限公司, 天津 300193
2. Tianjin Institute of Pharmaceutical Research New Drug Assessment Co. Ltd., Tianjin 300301, China
随着现代生活方式、环境等因素的改变,脑血管病发病率日渐提高,目前对偏瘫、瘫痪患者的治疗多停留在原发性疾病如脑卒中、颅脑损伤的治疗和预防上。在朴素解剖学和临床实践的基础上,藏医创造了与现代神经系统极其相近的白脉学说,并且根据藏医药的独特理论体系为“白脉病”提出了完备的预防和治疗手段。白脉软膏是甘肃奇正药业有限责任公司生产的产品,由姜黄、肉豆蔻、甘松和阳起石等药味组成,其功能主治为舒筋活络,用于“白脉病”、瘫痪、偏瘫、外伤引起的经络及筋键断伤、手足挛急、跛行及筋键强直等。本实验拟对白脉软膏预防和治疗脑卒中的药效进行评价,并对该药物可能的活血化瘀中医治疗机制进行初步探究,为阐明该药物的作用机制奠定基础。
1 材料 1.1 实验动物清洁级Wistar雄性大鼠,体质量180~250 g,由天津药物研究院动物室提供,实验动物生产许可证号SYXK(津)2011-0005。饲养在有中央空调的观察室中,饲料为专用全价营养块料(天津市华荣实验动物科技有限公司生产),饮自来水。
1.2 药物和主要试剂白脉软膏(每1克软膏相当0.2 g生药,批号20050609)、白脉软膏基质(批号20050501),均由甘肃奇正药业生产;灯盏花素片(昆明制药集团股份有限公司生产,批号20040669);三氯化铁(天津市化学试剂三厂生产,批号950103);水合氯醛(天津市福晨化学试剂厂生产,批号20051212);红四氮唑、乌拉坦(中国医药集团上海化学试剂公司生产,批号分别为H20030508、C20040308);生理盐水(中国大冢制药生产,批号4H90C;四川科伦药业股份有限公司生产,批号A050718);肝素纳(郑州市畜产综合加工厂生产,批号70804)。
1.3 主要仪器G & G电子天平(精度0.5 g,最大量程2000 g,美国双杰兄弟集团有限公司);RM6280多道生理信号采集系统(中国成都仪器厂);HSS-1(B)型恒温水域槽(成都仪器厂);PB-203型电子天平(上海梅特勒托利多仪器有限公司);LG-R-80C血液黏度仪(北京中勤世帝科学仪器有限公司);BT87-3型实验性体内血栓形成仪(包头医学院心血管研究室)。
2 方法 2.1 对脑卒中模型大鼠的预防作用[1]实验选用SD大鼠50只,雄性,以体质量随机分成5组:赋型剂组,灯盏花素(阳性药,0.040 g/kg)组,白脉软膏高、中、低剂量(以生药计0.300、0.150、0.075 g/kg,分别相当于2、1、0.5倍临床等效剂量)组,每组10只。于实验前将大鼠颈部去毛,皮肤涂抹给药,每天1次,连续给药7 d,灯盏花素组ig给予相应药液,赋型剂组外涂给予同体积敷料。
于末次给药后1 h,10%水合氯醛350 mg/kg麻醉大鼠,侧卧固定。自眼眦和外耳道中线处剪一小口,用咬骨钳咬去颧弓,暴露鳞状骨大部分。在颧弓和鳞状骨前联合的前下方约2 mm处钻孔,开约2 mm直径小颅窗,暴露大鼠大脑中动脉。将吸有50%三氯化铁溶液的小滤纸片敷在该段大脑中动脉处,30 min后去掉滤纸,生理盐水冲洗局部组织,然后逐层缝合后回笼饲养,制作大鼠大脑中动脉血栓性局部脑缺血模型。
24 h后断头处死大鼠,取脑切片,用2%红四氮唑(TTC)染色,10%甲醛固定48 h,称取脑组织及梗死区质量,计算梗死率。
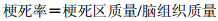
|
选用雄性SD大鼠50只,制作大鼠大脑中动脉血栓性局部脑缺血模型,方法同“2.1”项,于造模后48 h观察动物行为状态并评分。以评分值分层随机分成5组,分组及给药方法同“2.1”项,连续给药30 d。于给药第15、30天进行行为学评分。
行为指标评分[1]:①提鼠尾观察前肢屈曲情况,如双前肢对称伸向地面,计为0分,如手术的对侧前肢出现腕屈、肘弯曲、肩内旋或既有腕肘屈曲又有肩内旋者,分别计为1、2、3、4分;②将动物置于平面上,分别推双肩向对侧移动,检查阻力,如双侧阻力对等且有力,计为0分,如向手术的对侧推动时阻力下降者,根据下降程度不同分为轻、中、重度,分别计为1、2、3分;③将动物双前肢置一金属网上,观察双前肢的肌张力,双前肢肌张力对等且有力者计为0分,同样根据手术对侧肢张力下降程度不同计为1、2、3分;④动物有不停向一侧转圈者,计为1分。根据标准评分,满分为11分,分数越高,动物行为障碍越严重。
2.3 对大鼠自身血肿吸收的影响[2]40只大鼠随机分成4组:赋型剂组,白脉软膏高、中、低剂量(以生药计0.300、0.150、0.075 g/kg)组,每组10只,雌雄各半。实验前1 d,将每只大鼠右后腿部用8%硫化钠脱毛。白脉软膏各组每日外涂给药于脱毛处;赋型剂组外涂给予同体积赋型剂,每日1次,连续给药7 d。于第3次给药后由大鼠眼眶静脉丛取血0.1 mL,sc到脱毛处,各组于末次给药后24 h用透明硫酸纸描记血肿形态,并剪下称质量,以硫酸纸的质量(mg)来表示血肿面积。
2.4 对急性血瘀模型大鼠血液流变学的影响[3]选用50只Wistar大鼠,随机分为5组:对照组、模型组及白脉软膏高、中、低(0.300、0.150、0.075 g/kg)剂量组,每组10只,雌雄各半。每只动物背部剃毛,每日于剃毛处外涂给药1次,连续给药7 d,对照组和模型组外涂同体积的赋型剂。末次给药前动物禁食16 h,末次给药后30 min,除对照组外,其余各组大鼠尾iv 10%高分子右旋糖苷溶液0.4 mL/100 g。30 min后,戊巴比妥钠麻醉动物,腹主动脉取血,放入含有肝素钠的离心管中,摇匀,取0.8 mL全血,置入LG-R-80C型血液黏度仪中,测定切速为200/S、5/S时的黏度。剩余血2 000 r/min离心10 min,分离血浆,测定血浆的黏度。
2.5 对大鼠体内颈动脉血栓形成时间的影响[4]选用40只Wistar大鼠,体质量300~350 g,按体质量随机分为4组:赋形剂及白脉软膏高、中、低(0.300、0.150、0.075 g/kg)剂量组,每组10只,雌雄各半。每只动物背部剃毛,每日于剃毛处外涂给药1次,连续给药7 d,赋型剂组外涂同体积的赋型剂。于末次给药后1 h,ip 45 mg/kg戊巴比妥钠麻醉动物,大鼠仰卧位固定,分离右侧颈总动脉。将BT87-3型实验性体内血栓形成仪的刺激电极置于颈总动脉近心端,温度探头置于远心端,刺激电流强度为2 mA。刺激5 min后,关闭刺激电极,3 min后,调节温控表至零位,记录从刺激开始至动脉温度骤降所需的时间,亦即动脉血栓形成时间。
2.6 统计学方法数据均以x±s表示,采用SPSS 10.0统计软件单因素方差分析(One-Way ANOVA,LSD)进行统计学t检验。
3 结果 3.1 对脑卒中模型大鼠的预防作用与赋型剂组比较,灯盏花素组及白脉软膏高、中、低剂量组梗死率无显著性差异。结果表明,在大鼠大脑中动脉血栓性局部脑缺血模型上,白脉软膏无显著预防作用。见表 1。
| 表 1 白脉软膏对脑卒中模型大鼠的预防作用(x±s, n=10) Table 1 Preventive effect of Baimai Ointment on focal cerebral ischemic model rats (x±s, n=10) |
3.2 对脑卒中模型大鼠的治疗作用
给药第15和30天,与赋型剂组比较,灯盏花素组和白脉软膏高剂量组大鼠行为学评分均显著下降(P<0.05),表明白脉软膏可改善脑卒中模型大鼠行为协调性,对脑卒中有显著的治疗作用。结果见表 2。
| 表 2 白脉软膏对脑卒中模型大鼠的治疗作用(x±s, n=10) Table 2 Therapeutic effect of Baimai Ointment on focal cerebral ischemic model rats (x±s, n=10) |
3.3 对大鼠自身血肿吸收的影响
与赋型剂组比较,白脉软膏高、中、低剂量组血肿面积均明显缩小,差异显著(P<0.001),表明该药物对小鼠自身血肿吸收有显著的促进作用,加快受伤组织的修复。见表 3。
| 表 3 白脉软膏对大鼠自身血肿吸收的影响(x±s, n=10) Table 3 Effect of Baimai Ointment on hematoma absorption in rats (x±s, n=10) |
3.4 对急性血瘀模型大鼠血液流变学的影响
与对照组比较,模型组大鼠尾iv高分子右旋糖苷后,全血黏度及血浆黏度均显著升高;与模型组比较,白脉软膏高剂量组的全血黏度、血浆黏度显著降低(P<0.001),白脉软膏中、低剂量组的血浆黏度显著降低(P<0.001),表明白脉软膏显著降低血瘀模型大鼠的血液黏度,具有显著的活血化瘀作用。见表 4。
| 表 4 白脉软膏对急性血瘀模型大鼠血液流变学的影响(x±s, n=10) Table 4 Effect of Baimai Ointment on blood viscosity in acute blood stasis model rats (x±s, n=10) |
3.5 对大鼠体内颈动脉血栓形成时间的影响
与赋型剂组比较,白脉软膏高、中、低剂量组均能显著延长大鼠动脉血栓形成时间(P<0.05、0.0、0.001)。表明该药能够对抗动脉血栓的形成,有较好的活血化瘀作用。见表 5。
| 表 5 白脉软膏对大鼠实验性体内血栓形成时间的影响(x±s, n=10) Table 5 Effect of Baimai Ointment on thrombus formation time in rats (x±s, n=10) |
4 讨论
脑卒中是各种血管性病因引起的脑部局灶性损害的综合征,是危害人类健康的三大疾病之一,具有发病率高、死亡率高和致残率高的特点,可分为出血性和缺血性两大类,包括脑梗死、脑出血和蛛网膜下腔出血等。该病属于中医学“卒中病”范畴,主要临床表现为突然昏仆、半身不遂、口舌斜、言语謇涩或不语、偏身麻木等症状[5]。本实验采用大鼠大脑中动脉血栓性局部脑缺血模型,评价白脉软膏对脑卒中的预防作用和治疗作用,结果显示,该药物能够显著改善脑卒中模型大鼠行为协调性。
血瘀证与活血化瘀药物的研究是血液流变学应用于中医药的主要领域[5]。血瘀证是重要的中医病理症候,其中医治疗原则为活血化瘀,相应的中药为活血化瘀药。血栓病在中医临床属血瘀证,常因瘀血阻滞部位不同,表现为不同的病症。瘀阻脑络,可导致卒中,半身不遂。根据中医的论述,血瘀证主要是由于血液的流动性和黏度变化所致。血液流变学异常是许多疾病形成的病理基础,血液流变学的理论和实验方法可以用来研究血瘀和活血化瘀[6-7]。本实验采用大鼠自身血肿吸收实验初步评价白脉软膏的活血化瘀作用,采用大鼠急性血瘀模型评价药物对血液黏度的影响,并评价白脉软膏对大鼠实验性体内血栓形成的影响,结果显示,该药物显著促进大鼠自身血肿的吸收,加快局部损伤的修复,明显降低血瘀模型大鼠全血黏度及血浆黏度,且能够非常显著的延长大鼠颈动脉血栓形成时间。
本实验表明,该药物能够显著改善脑卒中模型大鼠行为协调性,对脑卒中模型大鼠具有显著的治疗作用,但并无显著预防作用,初步探明其可能的中医治疗原则为活血化瘀,为进一步阐明该药物的作用机制奠定基础。
| [1] | 徐淑云. 药理实验方法学[M].第三版. 北京: 人民卫生出版社, 2002 . |
| [2] | 王志华. 消肿止痛液促进小鼠自身血肿消散作用的探讨[J]. 福建中医药, 1999,30(5):39–40. |
| [3] | 王伟平, 李俊杰, 张利民. 夏至草提取物对血瘀大鼠器官血流量和血液流变学指标的影响[J]. 四川中医, 2006,24(9):17–18. |
| [4] | Chen J S. Thrombolysis effect with FIIa from Agkistrodon acutus venom in different thrombosis model[J]. Acta Pharmacol Sin, 2001, 22(5):420–422. |
| [5] | 陈奇.中药药效研究思路与方法[M].人民卫生出版社, 2005. |
| [6] | 周卫, 宿树兰, 刘培. 蒲黄-五灵脂药对不同提取物活血化瘀效应的比较研究[J]. 南京中医药大学学报, 2010,26(3):211–213. |
| [7] | 李仪奎.中药药理实验方法学[M].第2版.上海科学技术出版社, 2006. |
 2017, Vol. 40
2017, Vol. 40


