感冒是一种常见病,包括普通感冒、流行性感冒等,其发病率较高,一年四季均可发病,且多发于冬、春季节[1],其主要症状表现为头晕、头痛、发热、咳嗽、鼻塞等[2]。临床上多采用抗感冒药物进行对症治疗,市场上抗感冒药种类繁多,有中成药、中西结合药和西药,绝大部分的抗感冒药为非处方类药物。为了减轻痛苦,在日常生活中大多数感冒患者都是自主选择服用抗感冒药[1],自主选择时就会存在一定的盲目性。因此,本研究选取临床常用的抗感冒西药对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片以及抗感冒中成药柴芩清宁胶囊,采用脂多糖(LPS)及干酵母复制大鼠发热模型,对比研究几种抗感冒药物的解热作用及作用特点,为临床合理用药提供依据。
1 材料 1.1 实验动物SPF级SD大鼠,雌雄各半,体质量(200±20)g,由浙江省实验动物中心提供,动物生产许可证号SCXK(浙)2014-0001。给予标准的光照周期(12 h光照、12 h黑暗),室内温度(22±2)℃,湿度(50±10)%,实验全程予以标准饲料。
1.2 药品及主要试剂对乙酰氨基酚片(购自中美天津史克制药有限公司,商品名为必理通片,批号15030184);复方氨酚烷胺片(吉林省吴太感康药业有限公司,商品名为感康,批号1412047,主要成分为:对乙酰氨基酚、盐酸金刚烷胺、人工牛黄、咖啡因、马来酸氯苯那敏比例为250:100:10:15:2);美扑伪麻片(中美天津史克制药有限公司,商品名为新康泰克,批号15010490,主要成分对乙酰氨基酚、氢溴酸右美沙芬、盐酸伪麻黄碱、马来酸氯苯那敏比例为500:15:30:2);柴芩清宁胶囊(扬子江药业集团有限公司,批号15020741);上述药物均在临用前用40 ℃蒸馏水配制成相应浓度混悬液。
LPS,Escherichia coliendotoxin 055B5,货号L2880,Sigma公司生产,临用前0.9%氯化钠注射液配制成100 μg/mL的无菌注射液;干酵母为湖北安琪酵母有限公司产品,临用前用(0~4)℃蒸馏水配制成20%均匀的混悬液;0.9%氯化钠注射液为辰欣药业股份有限公司产品;甘油由扬子江药业集团有限公司提供。
1.3 仪器MC-347型电子体温计,欧姆龙(大连)有限公司生产。
2 方法 2.1 剂量设置根据药理实验方法学中药效学剂量设计原则[3]及预实验结果,对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片及柴芩清宁胶囊均以正常成人日剂量的大鼠等效剂量(equivalent dose,ED)为低剂量,2倍递增设计中、高剂量。对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片高、中、低剂量分别为205.67、102.83、51.42 mg/kg,以对乙酰氨基酚剂量计。柴芩清宁胶囊高、中、低剂量分别为1 110.60、555.30、277.65 mg/kg,以胶囊内容物质量表示。
2.2 动物分组适应性饲养4 d后,每日早晚2次对大鼠施行适应性测量肛温操作,测定肛温前让动物排空粪便。每次测温前电子体温计探头上用甘油润滑,轻轻插入大鼠肛门2 cm,连续3 d使适应环境和测温刺激。
正式实验前,大鼠禁食不禁水6 h,每0.5小时测体温1次,连续3次,选体温变化不超过0.5 ℃及体温不超过38 ℃的动物留用,平均体温作为正常体温。取留用大鼠280只,按LPS模型与干酵母模型,分别随机分为对照组、模型组、对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片、柴芩清宁胶囊的高、中、低剂量组,每组10只,雌雄各半。
2.3 给药与指标检测 2.3.1 LPS模型各组按1 mL/100 g体积ig给药,对照组和模型组给予等体积蒸馏水,柴芩清宁胶囊高、中、低剂量组分别连续给药3 d,对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片高、中、低剂量组分别1次性给药。末次给药后除对照组外,其余组大鼠均ip 100 μg/kg LPS。造模后每0.5小时监测1次体温,连续监测8 h,按前述方法测定肛门温度,计算最大体温上升高度△T(△T=发热时体温-基础体温),8 h体温反应指数(TRI 8,按梯形法计算,具体方法参照文献[4]),绘制各组平均升温曲线。
2.3.2 干酵母模型各组大鼠背部sc 20%酵母悬液10 mL/kg,造模后6 h,选取体温升高0.8 ℃以上的大鼠作为模型动物。各给药组按体积1 mL/100 g ig给药,对照组和模型组ig等体积蒸馏水,柴芩清宁胶囊高、中、低剂量组分别连续给药3 d,对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片高、中、低剂量组分别1次性给药。末次给药后0.5、1、2、4、6、8、10 h,按前述方法测定肛门温度,计算各时间点最大体温上升高度△T(△T=发热时体温-基础体温),10 h体温反应指数(TRI 10,按梯形面积法计算),绘制各组平均升温曲线。
2.4 统计学处理应用SPSS 22.0统计软件进行数据处理和分析。计量数据以x±s表示,△T、TRI8及TRI10数据比较采用方差分析,组间两两比较时,若方差齐性,采用LSD检验;若方差不齐,采用Games-Howell检验。
3 结果 3.1 对大鼠LPS发热模型升温曲线的影响如图 1所示,与对照组比较,模型组大鼠体温在造模后0.5、2.5~8.0 h显著升高(P<0.05、0.01);造模后1、1.5、2 h,与对照组比较无显著差异。
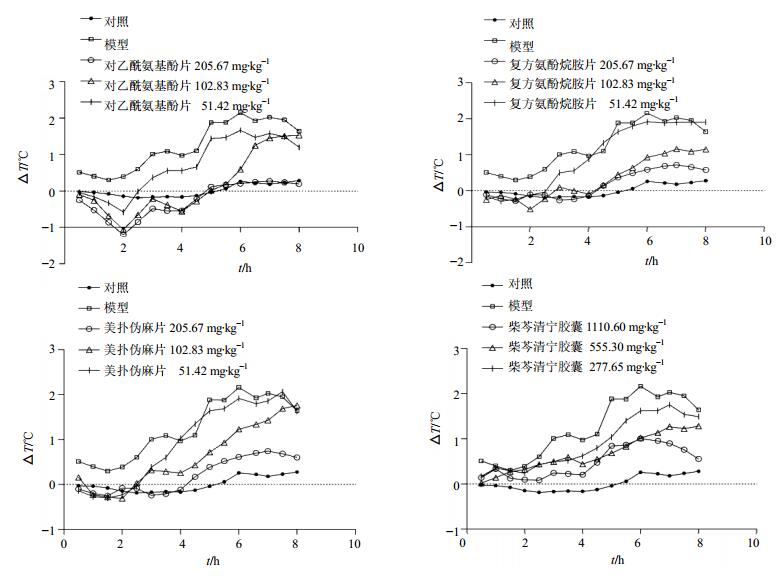
|
图 1 对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片及柴芩清宁胶囊对LPS发热模型大鼠升温曲线的影响 Fig. 1 Effects of Paracetamol Tablets, Compound Paracetamol and Amantadine Hydrochloride Tablets, Compound Dextromethorphan Hydrobromide Tablets, and Chaiqin Qingning Capsules on temperature average rise of rats with LPS induced fever |
对乙酰氨基酚片高、中、低剂量组大鼠在给药后0.5 h开始,体温与模型组比较均显著下降(P<0.01、0.001),高剂量组降温作用可持续至给药后8 h,中剂量组可持续至给药后6.5 h,低剂量组可持续至给药后3.5 h。
复方氨酚烷胺片高、中、低剂量组大鼠在给药后0.5 h开始,体温与模型组比较均显著下降(P<0.01、0.001),高、中剂量组降温作用可持续至给药后8 h,低剂量组降温作用可持续至给药后3.5 h。
美扑伪麻片高、中、低剂量组在给药后0.5 h开始,体温与模型组比较均显著下降(P<0.01、0.001),高剂量组降温作用可持续至给药后8 h,中剂量组可持续至给药后7.5 h,低剂量组可持续至给药后3.5 h。
柴芩清宁胶囊高剂量组大鼠在给药后3 h开始,体温与模型组比较显著下降(P<0.05),降温作用可持续至给药后8 h;中剂量组大鼠在给药后5 h开始,体温与模型组比较显著下降(P<0.05),解热作用可持续至给药后7.5 h;低剂量组大鼠给药后5、5.5 h出现体温显著下降(P<0.05)。
3.2 对大鼠LPS发热模型TRI 8的影响与模型组比较,对乙酰氨基酚片高、中剂量组大鼠TRI 8显著降低(P<0.01),低剂量组无显著差异;与模型组比较,复方氨酚烷胺片高、中剂量组大鼠TRI 8显著降低(P<0.01),低剂量组无显著差异;与模型组比较,美扑伪麻片高、中剂量组大鼠TRI 8显著降低(P<0.01),低剂量组无显著差异;与模型组比较,柴芩清宁胶囊高、中剂量组大鼠TRI 8显著降低(P<0.05),低剂量组无显著差异。结果见表 1。
| 表 1 对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片、柴芩清宁胶囊对LPS发热模型大鼠TRI 8的影响(x±s, n=10) Table 1 Effect of Paracetamol Tablets, Compound Paracetamol and Amantadine Hydrochloride Tablets, Compound Dextromethorphan Hydrobromide Tablets, and Chaiqin Qingning Capsules on TRI 8 of rats with LPS induced fever (x±s, n=10) |
3.3 对大鼠干酵母发热模型升温曲线的影响
如图 2所示,模型组大鼠体温在造模后6 h,与对照组比较显著升高(P<0.01),说明造模成功。给药后0.5、1、2、4、6、8、10 h,模型组与对照组比较体温均显著升高(P<0.01)。
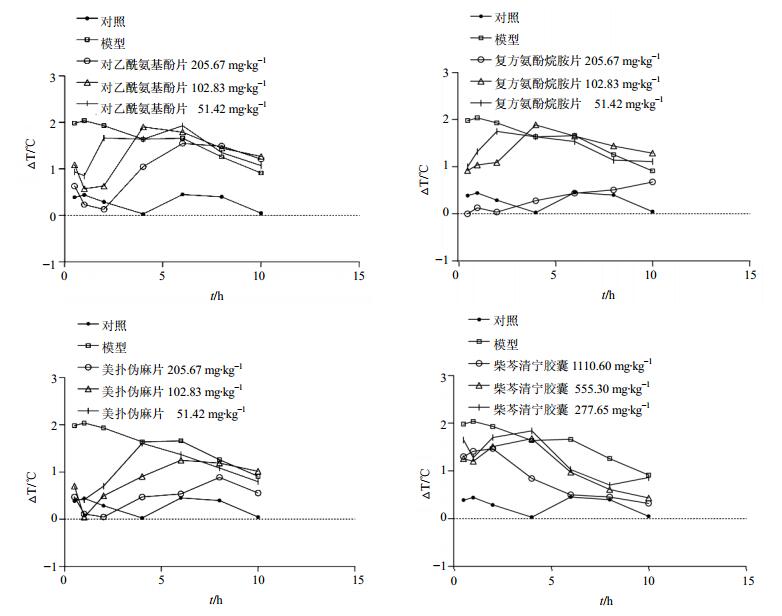
|
图 2 对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片及柴芩清宁胶囊对干酵母发热模型大鼠升温曲线的影响 Fig. 2 Effect of Paracetamol Tablets, Compound Paracetamol and Amantadine Hydrochloride Tablets, Compound Dextromethorphan Hydrobromide Tablets, and Chaiqin Qingning Capsules on temperature average rise of rats with dry yeast induced fever |
与模型组比较,对乙酰氨基酚片高、中、低剂量组大鼠在给药后0.5 h,体温均显著下降(P<0.05);高剂量组降温作用可持续至给药后4 h,中剂量组可持续至给药后2 h,低剂量组在给药后0.5、1 h出现体温显著下降(P<0.05)。
与模型组比较,复方氨酚烷胺片高、中、低剂量组大鼠在给药后0.5 h,体温均出现显著下降(P<0.05);高剂量组降温作用可持续至给药后8 h,中剂量组降温作用可持续至给药后4 h;低剂量组在给药后0.5、1、2 h出现体温显著下降(P<0.05)。
与模型组比较,美扑伪麻片高、中、低剂量组大鼠在给药后0.5 h,体温均出现显著下降(P<0.05);高剂量组降温作用可持续至给药后6 h,中剂量组降温作用可持续至给药后4 h,低剂量组在给药后0.5、1及2 h体温显著下降(P<0.05)。
与模型组比较,柴芩清宁胶囊高剂量组大鼠在给药后4 h开始,体温显著下降(P<0.05),降温作用可持续至给药后10 h;中、低剂量组大鼠在给药后6、8 h,体温显著下降(P<0.05)。
3.4 对大鼠LPS发热模型TRI 10的影响与模型组比较,对乙酰氨基酚片高、中剂量组TRI 10显著降低(P<0.05),低剂量组无显著差异;与模型组比较,复方氨酚烷胺片高、中、低剂量组大鼠TRI 10显著降低(P<0.001);与模型组比较,美扑伪麻片高、中、低剂量组大鼠TRI 10显著降低(P<0.01);与模型组比较,柴芩清宁胶囊高、中剂量组TRI 10均显著降低(P<0.05);低剂量组无显著差异。结果见表 2。
| 表 2 对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片、柴芩清宁胶囊对LPS发热模型大鼠TRI 10的影响(x±s, n=10) Table 2 Effect of Paracetamol Tablets, Compound Paracetamol and Amantadine Hydrochloride Tablets, Compound Dextromethorphan Hydrobromide Tablets, and Chaiqin Qingning Capsules on TRI 10 of rats with dry yeast induced fever (x±s, n=10) |
4 讨论
感冒是最为常见的疾病之一,虽然许多病原体均可导致感冒,但90%的感冒是由普通病毒感染引起[5]。干酵母所致的发热是由于注射部位的局部溃烂引发的剧烈炎症反应,是最常用的大鼠发热模型[6]。LPS是革兰阴性菌内毒素(ET)的活性成分,因此细菌内毒素和LPS的致热原理是一致的,即作为致热原激活单核巨噬细胞产生内生致热原导致机体发热[7]。因此,选择这两个感染性发热模型进行感冒药物解热作用研究,为临床针对不同发热特点选择适宜解热药物提供一定的实验依据。
上述结果部分表明,西药对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片及中成药柴芩清宁胶囊对LPS及干酵母大鼠发热模型均有解热作用,且存在一定剂量-效应关系。中成药柴芩清宁胶囊解热作用平稳,但起效较慢,西药对乙酰氨基酚片、复方氨酚烷胺片、美扑伪麻片解热作用起效快,但作用维持时间短。
内热原进入大脑后,作用于体温调节中枢,引起前列腺素E、下丘脑环磷酸腺苷(cAMP)等发热正调节介质的释放,从而使调定点上移而致发热。对乙酰氨基酚属于非那西丁体内代谢物,虽然不属于非甾体抗炎药物类,但一般认为通过抑制脑内环氧合酶活性,减少PGE2产生而发挥解热作用。其半衰期一般为1~4 h,所以其解热作用发生较快且维持时间短,同时复方氨酚烷胺片中的人工牛黄有清热解毒的功效,因此其解热作用相对优于其他2个西药。
柴芩清宁胶囊由黄芩苷、柴胡、人工牛黄组成,柴胡的解热药效是确定的,但解热的物质基础和解热机制还存在着诸多分歧。薛燕等[8]认为柴胡的主要解热物质基础是挥发油、皂苷和皂苷元成分。张云波等[9]认为柴胡的主要解热物质基础尚不明确,或者是所有成分多种途径和药理作用综合作用的结果。有研究认为黄芩苷和黄芩素能够通过干扰花生四烯酸的代谢通路、抑制细胞因子的活性[10-12]等产生解热抗炎作用。同时柴胡-黄芩也是小柴胡汤中的重要功能药对,能“外解半表之邪、内清半里之热”,体现着小柴胡汤和解少阳作用的主要方面[13]。王晖[14]进行了以镇痛效应为指标研究柴胡的药动学,得到其效应达峰时间的药动学参数为4.76 h,而且中成药不像化药一样是单体物质,口服中药在体内代谢较慢[15],因此柴芩清宁胶囊起效较缓,作用时间较长。
综上,3种西药的解热作用起效快但是作用时间短,因此临床上为了达到快速降温的目的,在服用西药时为了维持疗效会存在重复用药的现象,同时国内外关于APAP过量导致临床肝损伤病例报道时有发生[16-17],而柴芩清宁胶囊表现为起效慢但是作用时间长。因此,临床上要按照实际情况合理选择药物。当需要快速降温时可以选择含APAP的西药类抗感冒药物,但同时要注意避免肝毒性的发生,肝功能异常者慎用;当反复发热或不需要快速降温时可以在一段时间内选用安全性较好的中成药如柴芩清宁胶囊等。
| [1] | 肖德维. 分析抗感冒药物成分的药理及临床用药[J]. 临床医药文献电子杂志, 2015,2(3):409–410. |
| [2] | 郭昌辉. 抗感冒药物成分的药理特征及其临床用药研究[J]. 中国现代药物应用, 2012,6(14):14–15. |
| [3] | 魏伟, 吴希美, 李元建. 药理实验方法学[M].第四版. 北京: 人民卫生出版社, 2010 : 383 -386. |
| [4] | 巴图德力根, 韩志强, 娜日苏, 等. 达如奇颗粒对感染性发热增盛热证的解热作用研究[J]. 中药药理与临床, 2013(5):98–102. |
| [5] | 冯卓. 感冒患者对感冒认识及使用抗生素的情况调查[J]. 世界最新医学信息文摘:电子版, 2013,13(31):133, 137. |
| [6] | 徐叔云, 卞如濂, 陈修. 药理学实验方法[M]. 北京: 人民卫生出版社, 2002 : 993 . |
| [7] | 左泽平, 王志斌, 郭玉东, 等. 常用大鼠发热模型研究[J]. 中国比较医学杂志, 2012,22(2):52–57. |
| [8] | 薛燕, 白金叶. 柴胡解热成分的比较研究[J]. 中药药理与临床, 2003,19(1):11–12. |
| [9] | 张云波, 梁园, 夏爱军. 柴胡解热作用的药理研究进展[J]. 中国药业, 2011,20(3):79–80. |
| [10] | 李倩楠, 葛晓群. 黄芩苷的解热作用及对细胞因子的影响[J]. 中国中药杂志, 2010,35(8):1068–1072. |
| [11] | Tsai C C, Lin M T, Wang J J, et al. The antipyretic effects of baicalin in lipopolysaecharide-evoked fever in rabbits[J]. Neuropharmacology, 2006, 51(4):709–717. doi:10.1016/j.neuropharm.2006.05.010 |
| [12] | Woo K J, Lim J H, Suh S I, et al. Differential inhibitory effects of baicalein and baicalin on LPS-induced cyclooxygenase-2 expression through inhibition of C/EBP β, DNA-binding activity[J]. Immunobiology, 2005, 211(5):359–368. |
| [13] | 高琳, 谢鸣, 孙明瑜. 柴芩合煎液与分煎液对LPS诱导的大鼠发热模型的影响[J]. 中国实验方剂学杂志, 2003,9(6):22–25. |
| [14] | 王晖, 许卫铭, 王宗锐. 以镇痛效应为指标研究柴胡的药动学[J]. 广东医学院学报, 1996(3):229–230. |
| [15] | 郑磊.基于1H-NMR技术的黄连上清丸解热作用代谢组学研究[D].南昌:南昌大学, 2014. |
| [16] | 曹家驹, 沈素芳. 复方氨酚烷胺片与扑尔敏致胆汁淤积性肝损害的分析[J]. 中国现代药物应用, 2015,9(24):192–193. |
| [17] | 哈娜, 哈力, 胡宝荣. 复方氨酚烷胺片致急性肝损害1例[J]. 中国药师, 2005,8(7):589. |
 2017, Vol. 40
2017, Vol. 40


