2. 甘肃省中医药大学, 甘肃 兰州 730000
2. Gansu University of Chinese Medicine, Lanzhou 730000, China
异烟肼(Isoniazid),化学名4-吡啶甲酰肼,是结核病联合治疗中的首选药。本品相对分子质量为137.14,口服后几乎完全吸收,生物利用度达90%[1]。属BCSⅢ类药物[2]或BCSⅠ类[3],片剂的溶出行为直接影响药物的生物利用度。建立一个简单、专属性强,且具有较好区分力的溶出度试验方法是非常重要和必要的。《中国药典》2015年版溶出方法采用篮法100 r/min,溶出量测定为UV法,由于片剂通用的方法为桨法,且UV法专属性不强,所以测定方法的科学性有待进一步提高。为了对异烟肼片上市后的质量进行再评价,本文建立了异烟肼片体外溶出度评价方法,并对数家企业溶出曲线进行了比较分析。
1 仪器与试药 1.1 仪器Waters e2695高效液相色谱仪;Waters 1525-2487高效液相色谱仪;戴安Ultimate3000高效液相色谱仪;Mettler AE163电子天平;天大天发RCZ-8M溶出度仪;富科思FAVD-25真空脱气机;METTLER FiveEasy Plus酸度计。
1.2 试药异烟肼对照品(批号100578-201502,中国食品药品检定研究院);异烟肼原料(批号T2014100,天津汉德威药业有限公司);异烟肼片(美国山德士公司,规格100 mg,批号ME130036);国内16家生产企业分别为A、B、C、D、E、F、G、H、I、J、K、L、M、N、O、P。甲醇为色谱纯,水为超纯水,盐酸为优级纯,磷酸二氢钾、氢氧化钠、醋酸钠、冰醋酸、磷酸氢二钠均为分析纯。
2 方法与结果 2.1 API溶解度的测定称取过量异烟肼原料药置于25 mL具塞试管中,加入不同pH值的水溶液(pH1.0、pH2.0、pH3.0、pH4.0、pH5.0、pH6.0、pH7.0、pH8.0)各10 mL。在37℃水浴中振摇放置8 h。精密吸取上清溶液0.5 mL置500 mL量瓶内,加水稀释至刻度,摇匀。取上述各溶液按2.3.1的色谱条件测定。按《中国药典》2015年版HPLC外标法以峰面积计算各溶液中异烟肼的溶解度。异烟肼pH-溶解度结果见表 1。
| 表 1 pH值-溶解度 Table 1 pH-Solubility |
2.2 溶出度方法的确立 2.2.1 参比制剂的选择
本品原研制剂为美国诺华制药的异烟肼片,现已停产。本文以FDA规定的参比制剂,美国诺华的分公司山德士公司的异烟肼片作为参比制剂[4]。
2.2.2 溶出装置的选择篮法与桨法是各国药典收载的最普及的溶出方法。结合异烟肼的高溶解特性,本文选用浆法,50 r/min,可以较好地反映出慢速胃蠕动下的制剂溶出行为[5]。
2.2.3 溶出介质的确定由表 1可见,异烟肼溶解性没有明显的pH相关性。同时结合日本橙皮书及FDA的建议,选择以下4种溶出介质:水、pH1.2盐酸缓冲液(取盐酸7.65 mL,加水稀释至1 000 mL)、pH4.5醋酸盐缓冲液(取醋酸钠18 g,加冰醋酸9.8 mL,再加水稀释至1 000 mL)、pH6.8磷酸盐缓冲液(取0.2 mol/L磷酸二氢钾溶液250 mL与0.2 mol/L氢氧化钠溶液112 mL混匀后,再加水稀释至1 000 mL)。介质体积采用900 mL。
2.2.4 溶出曲线的绘制溶出取样时间点为5、10、15、20、30、45、60 min,当连续两点溶出率均达85%,且差值小于5%时,可作为采样截止点[6]。
2.3 溶出量测定方法的建立 2.3.1 色谱条件C18色谱柱(250 mm×4.6 mm,5 μm),以0.02 mol/L的磷酸氢二钠溶液(用磷酸调节pH值至6.0±0.05)-甲醇(85׃15)为流动相,检测波长为262 nm,柱温为30℃,体积流量为1.0 mL/min[5]。
2.3.2 溶液的配制精密称取异烟肼对照品约10 mg置100 mL量瓶中,加水溶解并稀释至刻度,摇匀,作为对照品溶液。取异烟肼片1片,按上述溶出方法测定溶出度,取续滤液直接作为供试品溶液,在以pH1.2为介质时,色谱峰存在溶剂效应,取样品1 mL用水稀释至5 mL后进样。异烟肼典型HPLC色谱图见图 1。

|
A-对照品溶液;B-供试品溶液;C-空白辅料;1-异烟肼 A-reference solution; B-sample solution; C-excipients; 1-isoniazid 图 1 异烟肼HPLC色谱图 Fig. 1 Typical HPLC of isoniazid |
2.3.3 专属性
精密称取淀粉约20 mg、硬脂酸镁约10 mg、预胶化淀粉约10 mg置100 mL量瓶中,加水振摇溶解并稀释至刻度,作为空白辅料溶液,进样测定。结果表明空白辅料在262 nm处无吸收,在主峰处无干扰(图 1)。表明该方法专属性良好。
2.3.4 线性考察精密称取异烟肼对照品适量,加水制成0.5 mg/mL的对照品储备溶液。分别精密量取对照品储备液0、1、2、3、4、5、6 mL至25 mL量瓶中,加水稀释制成不同浓度线性溶液。以质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,求得回归方程分别为:Y=1.72×104X−1.25×104,r=0.999 3;结果表明,本方法中异烟肼在0.198 1~0.990 4 μg线性良好。
2.3.5 精密度取质量浓度为0.1 mg/mL的异烟肼对照品溶液,重复进样6次,测得其RSD为0.1%,表明该方法精密度良好。
2.3.6 重复性取4种溶出介质溶出度项下供试品溶液,各重复进样6次,测得其RSD均小于0.5%,表明该方法重复性良好。
2.3.7 稳定性取4种溶出介质溶出度项下供试品溶液,分别于0、2、4、6、8 h进样,测得其在4种介质中的RSD分别为0.4%、0.2%、0.3%、0.3%,表明异烟肼在8 h内稳定。
2.3.8 回收率称取异烟肼片适量,加水溶解稀释制成质量浓度约为0.5 mg/mL的供试品溶液,平行9份,平均分为3组,分别精密量取5 mL至50 mL量瓶中;各加入0.5 mg/mL的异烟肼对照品溶液各4、5、6 mL,分别相当于样品浓度的80%、100%和120%,平均回收率为100.2%。RSD%为0.5%(n=9)。
2.3.9 耐用性采用不同色谱柱:资生堂CAPCELL PAK C18 MG(250 mm×4.6 mm,5 μm);资生堂CAPCELL PAK C18 MGⅡ(250 mm×4.6 mm,5 μm);赛默飞Thermo AcclaimTM 120(250 mm×4.6 mm,5 μm)。不同色谱仪:戴安Ultimate3000;Waters 1525-2487;Waters e2695。不同人员进行试验,色谱行为均良好。表明该方法耐用性良好。
2.4 溶出曲线评价 2.4.1 参比制剂溶出曲线测定按上述溶出度试验方法测定了参比制剂山德士异烟肼片在4种溶出介质中的溶出曲线,见图 2。结果参比制剂在4种溶出介质中15 min时溶出量均达到85%以上,且在不同溶出介质中的溶出曲线基本重合。
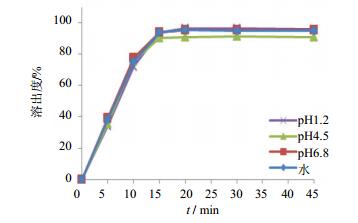
|
图 2 参比制剂在四种溶出介质中的溶出曲线(n=6) Fig. 2 Dissolution curves of reference preparation in different media (n=6) |
2.4.2 溶出曲线比较
初步测定了国内5家生产企业在4种溶出介质中的溶出曲线,见图 3。结果企业B、C、D在4种溶出介质中15 min溶出量均达到85%以上。企业A、E在以水为介质进行比较时,15 min溶出量均低于85%,而在其他3种介质中15 min溶出量达到85%。在介质水中各厂家溶出差异较大,因此选择水作为后续溶出度试验介质[7]。

|
A-pH 1. 2盐酸溶液;B-pH 4.5醋酸盐缓冲液;C-pH 6.8磷酸盐缓冲液;D-水 A-pH1.2 hydrochloric acid solution; B-pH4.5 acetate buffer solution; C-pH 6.8 phosphate buffer solution; D-water 图 3 不同企业样品在同种溶出介质中的溶出曲线(n=12) Fig. 3 Dissolution profiles of isoniazid tablets in different media (n=12) |
2.4.3 溶出曲线相似性分析
本次试验共测定了国内16家生产企业在水中的溶出曲线。以山德士异烟肼片作为参比制剂,国内生产企业作为受试制剂,采用单点法或f2因子法[8]进行了相似性分析。当参比制剂与仿制制剂在15 min时溶出量均达到85%,直接判定两者溶出曲线相似;当参比制剂与受试制剂两者之一15 min溶出量未达到或均未达到85%时,进行f2因子法相似性分析,选取时间点为5、10、15、20 min。
相似性分析结果见表 2。生产企业A、B、C、D、H、I、K、L、M、N、O、P与参比制剂相似;生产企业E、F、G、J与参比制剂不相似。
| 表 2 不同生产企业水中溶出曲线相似性评价结果(n=12) Table 2 Evaluation results of dissolution profile similarity of different manufactures in water (n=12) |
3 讨论
在进行异烟肼片溶出度方法研究过程中,作者采用光纤实时溶出仪,按照《中国药典》2015年版的溶出度方法进行了预实验,在以pH1.2为溶出介质时,用UV法测得的溶出量均高达120%,可见该方法并不能反映异烟肼片的真实溶出量。同时由于UV法测定溶出量时不能有效排除有关物质、辅料等的干扰,因此本文建立了专属性更强、准确度更高的HPLC法,并进行了方法验证。在以pH1.2为溶出介质进样时,色谱峰存在溶剂效应,所以将样品用水稀释5倍后进样。同步配制相同浓度的对照品溶液,并进行方法验证,精密度,重复性,线性,回收率均良好。该溶出度测定方法具有较强的区分力,可用于异烟肼片溶出曲线的测定。
国内异烟肼片处方较为简单,辅料主要为淀粉、硬脂酸镁及预胶化淀粉。作为一个高溶解性药物,处方组成、生产工艺可能是造成溶出行为差异的主要因素,在今后的研究中对各生产企业的异烟肼片,应进行多条溶出曲线的比较分析,以便全面了解国内各企业异烟肼片体外溶出状况。
| [1] | Becker C, Dressman J B, Amidon G L, et al. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms:Isoniazid[J]. J Pharmaceut Sci, 2007, 96(3):522–531. doi:10.1002/jps.20765 |
| [2] | Lindenberg M, Kopp S, Dressman J B. Classication of orally administered drugs on the World Health Organization Model list of essential medicines according to the biopharmaceutics classication system[J]. Eur J Pharm Biopharm, 2004, 58:265–278. doi:10.1016/j.ejpb.2004.03.001 |
| [3] | Wu C Y, Benet L Z. Predicting drug disposition via application of BCS:Transport/absorption/elimination interplay and development of a biopharmaceutics drug disposition classification system[J]. Pharm Res, 2005, 22:11–23. doi:10.1007/s11095-004-9004-4 |
| [4] | 陈泊颖, 韩颜, 徐为人, 等. 一致性评价产品目录在美国、日本和WHO的参比制剂概况[J]. 药物评价研究, 2016,39(5):693–710. |
| [5] | Costa P. An alternative method to the evaluation of similarity factor in dissolution testing[J]. J Int J Pharm, 2001, 220(1-2):77. doi:10.1016/S0378-5173(01)00651-2 |
| [6] | 中国药典[S].二部, 2015:295 |
| [7] | 张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009,40(12):946. |
| [8] | 连赟芳, 陈丹, 蔡韦炜, 等. 基于特征图谱表征的玳玳黄酮滴丸组分群同步释药特性评价[J]. 中草药, 2015,46(3):353–358. |
 2017, Vol. 40
2017, Vol. 40


