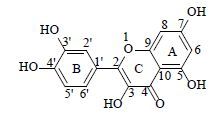
槲皮素(quercetin)是一种黄酮类化合物,具有扩张血管、保护内皮功能、抑制心肌肥厚、祛痰、镇咳、抗癌等药理作用[1]。结构式见图 1。由于无明显的毒副作用,成为近年来研究的热点[2-3]。目前,槲皮素含量测定主要采用高效液相色谱法[3],尚未见核磁定量法(qNMR)测定其含量的报道。
|
图 1 槲皮素结构式 Fig. 1 The structure of quercetin |
核磁共振(nuclear magnetic resonance, NMR)技术最初主要用于化合物的结构确定,随着高强度磁场和傅里叶变换技术的应用,使得仪器的各项性能得到显著性的改善,从而为该技术应用于定量分析奠定了基础[4-6]。qNMR法测定含量的基础是质子吸收峰面积与所包含的质子成正比,通常以已知含量的内标为参比,就可测得化合物的绝对含量。该法测定样品含量时不需对照品,无需引入校正因子,不受样品中水分、残留溶剂等干扰,且定性检定和定量分析同步完成,与HPLC法相比具有较大的优势[5]。《中国药典》2010年版二部附录Ⅸ首次收载了qNMR法,其在含量测定方面的应用逐渐得到重视。本研究采用内标法对槲皮素含量测定方法进行了系统的方法学验证,并与质量平衡法进行比较,为槲皮素原料药质量控制提供新方法。
1 仪器与试药Bruker-400型核磁共振仪(瑞士布鲁克公司);Agilent 1260高效液相色谱仪(安捷伦公司);915KFTi-touch卡氏水分仪(瑞士万通);分析天平(德国sartorius公司);氘代DMSO(DMSO-d6,Sigma公司);槲皮素原料药(批号20131206,南京景竹生物科技有限公司);马来酸对照品(批号190015-201302,中国食品药品检定研究院);槲皮素对照品(批号100081-201209,中国食品药品检定研究院)。
2 方法与结果 2.1 供试品溶液的配制精密称取马来酸56.78 mg溶于25 mL DMSO-d6中,作为内标溶液。另精密称取槲皮素原料药4.19 mg,溶于1.0 mL内标溶液,转移0.5 mL至核磁管中待测。
2.2 实验条件采用zg30脉冲序列在恒温(295 K)下获取1H-NMR。实验参数设置为:谱宽(SWH)8012 Hz,中心频率(O1)2 757 Hz,采样时间(AQ)4.0 s,弛豫延迟时间(D1)15 s,脉冲宽度(P1)9.54 μs,采样次数(NS)64次。
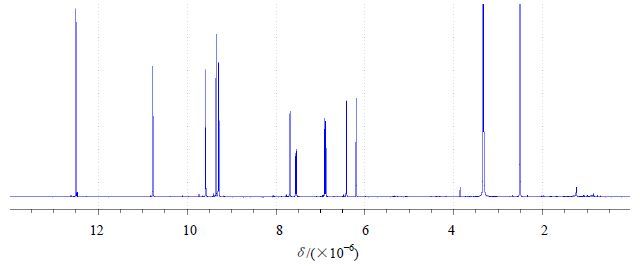
2.3 1H-NMR内标法测定槲皮素方法的建立 2.3.1 氘代溶剂的选择及槲皮素1H-NMR谱图的归属合适的氘代溶剂对内标及槲皮素溶解性较好,且内标谱峰不与样品峰谱峰发生重叠。氘代CDCl3易挥发,测试过程中可能会导致样品浓度发生变化,因而选用DMSO-d6作为溶剂。DMSO-d6空白实验的1H-NMR谱图,溶剂峰归属为δ2.50(quintet,DMSO-d6峰),δ3.32(s,H2O)。槲皮素1H-NMR谱图及峰归属分别见图 2、表 1。与文献报道基本一致[6]。
|
图 2 槲皮素的1H-NMR谱图 Fig. 2 Determination of quercetin with 1H-NMR spectral |
| 表 1 槲皮素1H-NMR谱解析 Table 1 1H-NMR spectral date for quercetin. |
2.3.2 内标和定量峰的选择
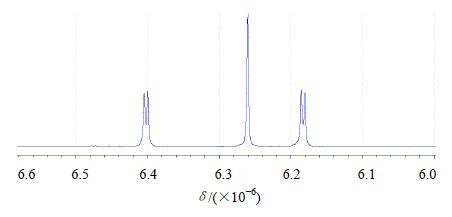
本实验选用DMSO-d6作为溶剂,马来酸作为内标,与槲皮素混合物1H-NMR谱图见图 3(图谱中仅显示δ6.0~6.6)。由图谱可知,马来酸溶剂峰归属为δ6.26(s,DMSO-d6),与槲皮素附近的谱峰分离度较好,并选取槲皮素δ7.50~7.58(dd,6’-H)处作为槲皮素的定量峰。
2.3.3 线性关系考察精密称取槲皮素0.64、1.93、3.08、4.83、6.19 mg分别加入1 mL马来酸对照液,混匀后置于5 mm核磁管中。以槲皮素与马来酸定量峰面积比(As/Ar)对槲皮素与马来酸质量比(ms/mr)作线性回归,得出回归方程为y=2.963 x+0.134 1(r=0.999 3)。结果表明,以马来酸作为内标,用qNMR内标法测定样品中槲皮素含量,在0.64~6.19 mg/mL线性关系良好。
|
图 3 马来酸与槲皮素的1H-NMR谱图 Fig. 3 Determination of maleic acid and quercetin with 1H-NMR spectral |
2.3.4 仪器精密度
取供试品溶液,按“2.2”项下条件连续测定5次,获取1H-NMR,调整相位并积分。计算定量峰与内标峰面积的比值。结果显示,其RSD=0.84%。
2.3.5 重复性取供试品溶液,按照“2.2”项下条件进行测定,获取1H-NMR,调整相位并积分。计算定量峰与内标峰面积的比值,结果RSD=1.39%。
2.3.6 样品稳定性取供试品溶液分别于0、2、4、8、12 h按照“2.2”项下条件进行测定,获取1H-NMR、积分。计算定量峰与内标峰面积的比值。计算RSD为1.56%,表明样品溶液在12 h内稳定。
2.3.7 加样回收率试验取6份已测定含量的槲皮素样品,分别加入槲皮素对照品,并加入内标溶液配制样品溶液,按照“2.2”项下的测定条件获取1H-NMR,计算回收率。结果见表 2。
| 表 2 加样回收率实验(n=6) Table 2 Experiment of average recovery rate (n=6) |
2.3.8 方法耐用性
取供试品,分别在耐用条件为温度(295±5)K,弛豫时间(15±1)s,脉冲宽度(9.54±0.5)μs,扫描次数(64±5)次进行耐用性实验。在上述耐用条件下,计算得到的RSD值最大为0.72%。因此采用的测试条件耐用性良好,满足分析要求。
2.3.9 定量结果平行配制3份样品,按照如下公式计算槲皮素的量,经计算3份槲皮素质量分数分别为85.20%、84.93%和85.27%,平均质量分数为85.13%,RSD为0.21%。
槲皮素%=[(As/ns)×Ms×mr]/ [(Ar/nr)×Mr×ms]×Wr
其中,As为槲皮素定量峰的积分面积;ns为槲皮素定量峰代表的氢个数;Ms为槲皮素相对分子质量;Ar为马来酸定量峰的积分面积;nr为马来酸定量峰代表的氢个数;Mr为马来酸相对分子质量;mr为马来酸质量;Wr为马来酸质量分数;ms为槲皮素质量。
2.4 质量平衡法测定结果HPLC面积归一化法结果为99.36%,卡氏水分测定结果为13.94%,炽灼残渣为0.11%,残留溶剂为0.0009%。质量平衡法计算结果为:(100%-水分%-炽灼残渣%-残留溶剂%)×HPLC面积归一化法测定结果%=85.39%。可见,qNMR测定结果基本与质量平衡法结果一致。
3 讨论D1要足够长,以使原子核完全弛豫,从而使被积分的信号强度与原子核数目成正比。本实验分别考察了D1为1、5、10、15、20、30 s时对槲皮素定量峰的影响。结果表明,当D1>15 s时,As/Ar的比值趋于稳定,因此选择D1为15 s。考察了扫描次数(NS)对定量峰积分面积的影响。在D1设置为15 s前提下,分别对NS为16、32、64、96、128进行了考察。结果表明,当NS>64时,As/Ar的比值趋于稳定。因此NS设定为64。O1的位置对定量分析的结果也会产生一定的影响,为使定量峰和内标峰在近似的射频场内测定,从而保证积分结果的准确性,O1应位于内标峰和样品定量峰的中间处,因此,O1设定为2 757 Hz,对应的O1P值为6.89。
槲皮素原料药中可能存在分子结构相近的山柰酚、异鼠李素等有关物质,δ6.0~7.0的质子峰会有关物质质子峰干扰。因此最终选取了槲皮素δ7.50~7.58(dd,6’-H)处作为定量峰。定量峰一般首先考虑峰型简单的质子峰[7],当峰型简单的质子不适合作为定量峰时,也可选择多重峰[8]。但对定量峰积分时应将该峰放大,仔细调整相位,选取峰型轮廓线与基线重合处为其起、止点,多次积分后取其平均值。
质量平衡法测定结果与qNMR测定结果基本一致。但采用qNMR技术测定槲皮素含量,无需对照品,测试过程简单,快速准确,且结果可靠。为槲皮素原料药、相关制剂及标准品的质量控制提供有价值的参考。
| [1] | 孙涓, 余世春. 槲皮素的研究进展[J]. 现代中药研究与实践, 2011,25(3):85–88. |
| [2] | Hao H J, Jia Y Z, Zhang H Q, et al. Preparation of monolithic osmotic tablet of quercetin loaded by solid dispersion[J]. J Chin Pharm Sci, 2015, 24(6):383–392. |
| [3] | 邓向涛, 郝海军, 贾幼智, 等. 槲皮素固体分散体亲水性骨架缓释片的研制及体外释放[J]. 中药材, 2015,38(11):2408–2410. |
| [4] | Holzgrabe U. Quantitative NMR spectroscopy in pharmaceutical applications[J]. Prog Nucl Magn Reson Spectrosc, 2010, 57(2):229–240. doi:10.1016/j.pnmrs.2010.05.001 |
| [5] | 刘阳, 周颖, 张才煜, 等. 核磁共振定量法测定脒基吡唑含量[J]. 药物分析杂志, 2014,34(6):1087–1089. |
| [6] | 刘阳, 张才煜, 程奇蕾, 等. 核磁共振法测定13-顺阿维A[J]. 现代药物与临床, 2014,29(3):251–254. |
| [7] | 翟广玉, 朱玮, 渠文涛, 等. 槲皮素的光谱分析[J]. 光谱实验室, 2012,29(4):2443–2449. |
| [8] | 易进海, 刘云华, 陈燕, 等. 核磁共振波谱法测定藁本内酯对照品的含量[J]. 药物分析杂志, 2010,30(4):680–682. |
 2017, Vol. 40
2017, Vol. 40


