2. 中山大学药学院, 广东 广州 510006;
3. 天津药物研究院新药评价有限公司, 天津 300301;
4. 深圳翰宇药业股份有限公司, 广东 深圳 518035
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China ;
3. Tianjin Institute of Pharmaceutical Research New Drug Evaluation Co. Ltd., Tianjin 300301, China ;
4. Hybio Pharmaceutical, Shenzhen 518035, China
鞘内给药是将不易通过血脑屏障的药物直接注入腰椎蛛网膜下腔的特殊给药方式。临床常用鞘内注射药物多数采用置管给药方法,但置管模型制备时较易发生感染、导管固定困难、易脱落并容易引起机械性刺激损伤,可能干扰对局部给药刺激性的评价。对于该类给药途径的安全性评价是研究关注的重点,王海学等[1]提出若活性成分尚未批准用于鞘内注射给药,应当用两个种属的动物,对拟用的临床制剂处方进行毒性试验。本研究采用新西兰兔腰椎反复穿刺鞘内注射的给药方法来考察常用鞘内镇痛药醋酸齐考诺肽的局部刺激性,为鞘内注射制剂的局部刺激性评价提供参考。
1 材料 1.1 实验动物新西兰兔,普通级,16只,雌雄各半,体质量2.0~2.5 kg,购于广东省广州市花都区花东信华实验动物养殖场,实验动物生产许可证号为SCXK(粤)2014-0023。饲养于中山大学药学院药物安全性评价中心普通环境动物房兔饲养室,实验动物使用许可证号为SYXK(粤)2011-011。温度16~26 ℃,湿度40%~70%,换气次数大于10次/h,光照时间为7:00~19:00。动物自由摄取饲料并经引水管配备按压喷水装置自由饮水。
1.2 药品醋酸齐考诺肽鞘内输注液(批号101213F,规格1 mL/支,prialf,爱尔兰Elan公司),无色澄明液体,2~8 ℃避光贮存。
1.3 主要仪器0.25 mL鸽牌全玻璃注射器,使用前高压灭菌;一次性注射器针头,使用前用磨刀石打磨至针孔斜面内径小于1 mm,并用75%酒精浸泡消毒,均购自中国上海双鸽实业有限公司;SB32000电子天平(瑞士mettler toledo公司);TP1020脱水机、EG1160石蜡包埋机、RM2155切片机、DM5000B生物荧光显微镜(德国Leica公司)。
2 方法 2.1 试验设计16只新西兰兔随机分为2组,设计对照组(生理盐水)和醋酸齐考诺肽组,每组8只,雌雄各半。为考察受试物临床使用量是否产生局部刺激,本研究中新西兰兔的给药浓度为100 μg/mL,等同临床给药浓度,由于新西兰兔椎管内容积有限,给药量不可过多,一般不超过兔脑脊液总量的10%,本研究中给药体积为50 μL。
2.2 给药方法以1 mL/kg剂量iv 3%戊巴比妥钠,待动物麻醉状态稳定后,将腰椎给药部位去毛消毒,摸清两侧骼棘,其连线中点为L6棘突,压紧髋部皮肤,暴露好脊椎间隙,从L5-6用微量注射器穿刺。因新西兰兔硬脊膜位置位于棘突下方根部位置,穿刺时注射器向尾侧倾斜,以50~70°于正中线穿入。如新西兰兔甩尾或者后肢抽动提示刺破硬脊膜,此时新西兰兔反应较剧烈,小心针不要脱出。考虑椎管内容积有限,进样器易弯曲不易通过新西兰兔的肌肉层,本研究中使用磨刀石打磨至针孔斜面内径小于1 mm的一次性注射器针头。每天给药1次,连续给药7 d。
本研究中穿刺成功的判定是给药成功的关键,在穿刺时注射针头接触硬脊膜时有较大阻碍感,稍用力刺穿硬脊膜时新西兰兔有明显的后肢弹跳反射和甩尾反射,表明针头已进入蛛网膜下腔,此时注射药物。在操作练习时穿刺进入蛛网膜下腔后可回抽脑脊液,但兔脑脊液含量少,经椎间隙穿刺抽取脑脊液很困难,而且并非每只动物都可回抽到脑脊液,因此建议以观察到甩尾或后肢弹跳反射为刺破硬脊膜的判定标准,在解剖前可通过枕骨大孔穿刺吸取脑脊液观察脑脊液有无异常变化。
2.3 一般症状和注射部位观察从给药开始至实验结束,每天观察一次动物症状(外观体征、行为活动、腺体分泌、呼吸、粪便性状、摄食情况等)。每次给药前以及停药后,每天将动物从笼中取出观察,主要观察给药部位状况。给药第1、4天,末次给药后2、7、14 d,测定每只动物的体质量。
2.4 组织病理学检查末次给药后2 d,每组随机选取4只动物麻醉处死后解剖取注射部位(进针部位棘突位置)及前段(距离进针部位1~2个棘突位置)和后段(距离进针部位1~2个棘突位置)处腰椎和脊髓。肉眼观察记录皮肤、皮下组织、肌肉组织和脊髓的反应;固定在10%中性甲醛溶液中,对腰椎和脊髓进行病理制片。常规石蜡制片,厚度2~3 μm,HE染色,然后进行组织病理学检查。剩余动物恢复2周再进行剖检取材,进行恢复期注射部位组织病理学检查。
2.5 刺激性评价刺激性组织病理学改变主要以注射部位前段和后段的病理学改变为依据,注射点的病理学检查仅为考察连续多次腰椎穿刺后的机械性损伤程度,所以注射部位前后两段和注射点的刺激性评价是分别进行的。
按组织病理学检查结果对鞘内的刺激反应进行评分,每只动物前后两段脊髓及鞘膜评分的平均值,为该只动物的髓鞘内刺激指数。对注射点进行机械刺激评分,为该动物的注射点刺激指数。刺激性评分标准见表 1。根据刺激指数进行刺激评价,刺激指数≤0.5,无刺激性;0.5<刺激指数≤2.5,轻微刺激;2.5<刺激指数≤4.5,中度刺激;4.5<刺激指数≤6.0,重度刺激。
| 表 1 鞘内刺激性光镜检查评分 Table 1 Microscopic examination score of intrathecal irritation |
3 结果 3.1 一般症状和注射部位观察
给药第3天,对照组1只动物于麻醉后呈惊厥样症状并死亡,其余动物试验期间未见明显异常。各组动物鞘内注射部位表面皮肤可见出血点或皮下淤血,组间无差异,均使用酒精表面消毒,未见感染。给药期间和停药期间,动物体质量增长正常。
3.2 组织病理学检查末次给药后2 d,对照组3只动物注射点脊髓可见出血灶、炎细胞浸润及部分神经纤维脱髓鞘等改变。醋酸齐考诺肽组4只动物注射点脊髓均可见不同程度的出血灶,细胞坏死,炎细胞浸润和神经纤维脱髓鞘等改变。末次给药后14 d,醋酸齐考诺肽组1只动物注射点脊膜外可见灶状出血。其余动物注射点部位和前后段髓鞘及周围组织均未见异常改变。结果见图 1。
3.3 刺激性评价对照组、醋酸齐考诺肽组评分结果见表 2。在末次给药后2和14 d,两组动物注射点前后段均无鞘内刺激性;末次给药后2 d,穿刺注射点可见轻微刺激性,为连续多次腰椎穿刺后的机械性损伤,末次给药后14 d,穿刺注射点无刺激性。
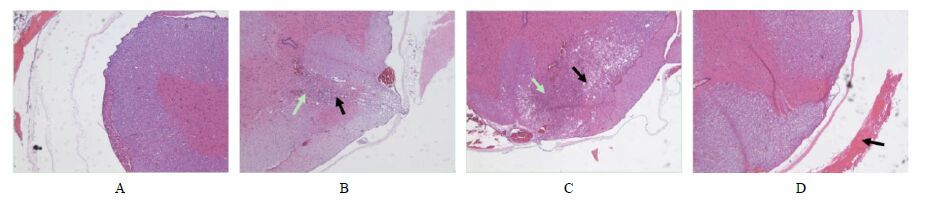
|
A 末次给药后2 d醋酸齐考诺肽组注射点后段脊髓未见异常;B 末次给药后2 d对照组注射点脊髓一侧后角可见灶状淋巴细胞浸润(白色箭头),部分神经纤维脱髓鞘(黑色箭头);C 末次给药后2 d醋酸齐考诺肽组注射点脊髓一侧后角可见细胞坏死灶,坏死灶周边可见少量淋巴细胞浸润(白色箭头),少量神经细胞脱髓鞘(黑色箭头);D 末次给药后14 d醋酸齐考诺肽组注射点局部脊膜外结缔组织内可见灶状出血(黑色箭头)。 A no abnormal change of the back end of spinal cord in Ziconotide group 2 d after the last dose; B focal lymphocytic infiltrates of unilateral spinal cord (the white arrow) at injection site and part of the nerve fibers demyelination (the black arrow) were found in control group 2 d after the last dose; C necrosis foci at unilateral spinal cord,a few lymphocytic infiltrates and a few demyelinating nerve cells were found in Ziconotide group 2 d after the last dose; D multifocal bleeding of epidural connective tissue (the black arrow) at injection site were found in Ziconotide group 14 d after the last dose. 图 1 鞘内刺激性的病理组织学检查结果 Fig. 1 Histopathological findings of intrathecal irritation |
| 表 2 鞘内刺激性光镜检查评分及结果判定 Table 2 Microscopic examination score and judgment of intrathecal irritation |
4 讨论
齐考诺肽临床多用于难治性疼痛患者长期用药,需要使用一个植入式的程控微量泵或体外微量泵连接导管进行鞘内注射,临床使用留置管的时间较长,并且可见留置管处感染发炎等刺激性报道。临床鞘内镇痛的一线药物吗啡的主要并发症也是导管顶端炎性团块的形成、感染、肉芽肿瘤并且常见脑脊液外漏[2]。药效学研究中,留置管途径给药较为常见[3],但也有研究表明留置管会影响药物的作用,降低动物的敏感性,可能与炎症反应有关[4]。唐甩恩等[5]通过死亡率、致残率和合格率考察比较了枕骨大孔埋管、腰骶部埋管和直接注射法3种鞘内给药手术方法对大鼠的影响,结果表明,直接注射法的死亡率和致残率为0,合格率为100%,优于另外两种方法。靳洪涛等[6]曾使用Beagle犬进行了鞘内给药制剂的刺激性试验,采用置管手术后留置的方法进行重复给药,组织病理学检查可见脊髓血管周围神经炎细胞浸润、脊髓内钙盐沉积和肉芽组织形成,留置管对给药部位存在一定刺激性。张素才等[7]在长期毒性试验中推荐使用腰椎穿刺植管的给药方法,借助皮下埋植渗透泵或体外携带程控泵实现连续给药,在这类型试验中,植管的给药方法可减少连续给药过程中反复麻醉、操作繁琐、穿刺风险等,植管给药可更好的考察连续定量给予药物的整体、长期的药物效果或毒性反应。本研究采用新西兰兔腰椎反复穿刺鞘内注射给药的方法来考察醋酸齐考诺肽鞘内注射的局部刺激性。
腰穿及鞘内注射药物有很大的潜在风险,临床也多次报道鞘内注射药物后发生的意外,因该类药物的给药途径较为特殊,直接腰椎穿刺鞘内注射药物对操作者的技术和经验要求较高,对动物的依从性要求较高。鞘内注射刺入过深,直接刺伤脊髓或马尾神经,脊髓受损后立即在损伤平面以下出现肢体迟缓性截瘫[8]。有报道表明,多次鞘内注射是导致截瘫发生的原因[9],表现为可逆或不可逆截瘫。因此鞘内注射时要提高和掌握穿刺术要领和方法,减少脊髓血管或马尾神经受损。本研究中操作期间及恢复期间新西兰兔均未出现截瘫症状。
在鞘内注射时,因需要对动物进行麻醉,麻醉药的选择可能对动物有一定的影响,本研究中使用的麻醉药为3%戊巴比妥钠1 mL/kg,对照组1只动物于给药第3天麻醉后出现惊厥样症状并立即死亡,可能与麻醉药给药速度较快有关,在试验中未观察到麻醉药对动物的其他影响。本研究重在考查鞘内注射部位的局部刺激性,麻醉药的干扰较小,但进行血液血清生化指标分析或器官毒性研究时需要考查麻醉药对动物的影响,并排除麻醉药物对受试物毒性的干扰。因此,试验时是否需要全身麻醉、麻醉药的选择尚需要进一步的研究,或许可以尝试诱导麻醉或短效麻醉药以减少对动物的影响。
注射点出现的病理学改变与反复穿刺的机械性刺激有关,而注射点前后段髓鞘及周围组织可以更好地体现鞘内注射的药物有无局部刺激性反应。在鞘内刺激性组织病理学评分及结果判定中,本研究以前段和后段的病理学改变为依据,对照组和醋酸齐考诺肽组动物前后段均未见鞘内刺激性,注射点均有轻微刺激且受试物组和对照组无较大差异,末次给药14 d后各组均未见明显的机械性刺激,表明末次给药后2 d注射点的机械性损伤可逆。本研究采用新西兰兔模型对醋酸齐考诺肽鞘内注射给药的局部刺激性进行了研究,也为鞘内注射制剂的局部刺激性评价提供一些参考信息。
| [1] | 王海学, 郑杰民, 尹丽莉, 等. 国家食品药品监管局药品审评中心充分评价毒性信息重视特殊给药途径[N]. 中国医药报, 2011. |
| [2] | Atli A, Theodore B R, Turk D C, et al. Intrathecal opioid therapy for chronic nonmalignant pain:a retrospective cohort study with 3-year follow-up[J]. Pain Med, 2010, 11(7):1010–1016. doi:10.1111/j.1526-4637.2010.00876.x |
| [3] | 陈鹤翔, 杨辉, 逄坤芳, 等. 鞘内注射δ阿片受体特异性拮抗剂对慢性痛大鼠吗啡耐受的影响[J]. 中国疼痛医学杂志, 2012(11):688–692. |
| [4] | DeLeo J A, Tanga F Y, Tawfik V L. Neuroimmune activation and neuroinflammation in chronic pain and opioid tolerance/hyperalgesia[J]. Neuroscientist, 2004, 10(1):40–52. doi:10.1177/1073858403259950 |
| [5] | 唐甩恩, 周文华, 顾钧, 等. 脊髓鞘内给药改良法-腰骶部埋管及直接注射[J]. 上海实验动物科学, 2003(01):53–54. |
| [6] | 靳洪涛, 李超, 李万芳, 等. Beagle犬单次和反复鞘内注射巴氯芬给药局部刺激性试验[A]. 中国环境诱变剂学会第14届学术交流会议. 中国环境诱变剂学会第14届学术交流会议论文集[C]. 哈尔滨:2009. |
| [7] | 张素才, 李晶丽, 李士强, et al. 鞘内给药在毒性试验中的应用[A]. 首届中国药物毒理学年会暨国际药物非临床安全性评价研究论坛. 首届中国药物毒理学年会暨国际药物非临床安全性评价研究论坛论文集[C]. 中国上海:2011. |
| [8] | 黄之训, 祝德秋. 氨甲蝶呤、阿糖胞苷鞘内注射致严重脊椎神经损害分析[J]. 中国医院药学杂志, 2008(16):1427–1429. |
| [9] | Teh H S, Fadilah S A, Leong C F. Transverse myelopathy following intrathecal administration of chemotherapy[J]. Singapore Med J, 2007, 48(2):46–49. |
 2017, Vol. 40
2017, Vol. 40


