肝癌是世界上最常见的第五大恶性肿瘤,第三大常见的癌症致死原因,在我国已上升为恶性肿瘤的第2位,每年13万人死于肝癌,占全球肝癌死亡总数的42%[1]。由于大部分病例发现时已是晚期,失去手术时机,目前采用放化疗法治疗的疗效欠佳,且毒副反应较大,中医药一直是肝癌综合防治的重 要研究方向,近些年进展较快。地五养肝胶囊(鄂药制字Z20113160)是基于“补肾生髓成肝”肝癌三级预防方案的主要中药制剂[2],前期研究表明,地五养肝胶囊对神经-内分泌-免疫-肝再生调控网络具有多组分、多途径、多环节和多靶点的整合调节作用,其疗效机制涉及下丘脑-垂体-肝轴、神经-内分泌-免疫网络、骨髓干细胞转化为肝脏细胞、肝内微环境等多个途径与环节,可能通过影响与肝再生微环境、肝癌发生发展密切相关的Wnt、MAPK、TGF-β、Jak-STATA、Toll样受体等多个的信号通路基因表达发挥作用[3-6]。姜黄素及甘草次酸是地五养肝胶囊的主要有效成分,本研究采用细胞药理学实验方法观察姜黄素与甘草次酸联用抑制肝癌细胞HepG-2的增殖、诱导其凋亡的作用,探讨姜黄与甘草配伍的合理性和科学性。
1 材料 1.1 药品及试剂姜黄素(杭州天草科技有限公司,批号20130625,质量分数>98%);甘草次酸(湖北远大药业,批号20130217,质量分数>98%);1640培养基、青霉素-链霉素双抗(北京海克隆生物化学制品有限公司);四季青无支原体胎牛血清(浙江天杭生物科技股份有限公司);胰酶(美国Gibco公司,批号25200-056);CCK-8试剂盒(日本同仁化学研究所,批号CK04);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(上海贝博生物科技有限公司,批号BB-4101-1);细胞周期与细胞凋亡检测试剂盒(碧云天生物技术公司,批号C1052)。
1.2 主要仪器HF90细胞培养箱(力康生物医疗科技控股有限公司);5424离心机(艾本德中国有限公司);Cytoflex流式细胞仪(中国贝克曼库尔特商贸有限公司);F50酶标仪(上海帝肯贸易有限公司)。
1.3 细胞株人肝癌细胞株HepG-2,购自于武汉大学典藏中心,冻存保种。
2 方法 2.1 CCK-8检测细胞增殖抑制取对数期生长的HepG-2细胞,胰酶消化后调整为5×104/mL,96孔板每孔加入100 μL细胞悬液(5 000个细胞,含血清),培养过夜。用1640培养基(不含血清)将药物倍比稀释至一系列浓度:姜黄素为10.00、5.00、2.50、1.25 μg/mL;甘草次酸为20.0、10.0、5.0、2.5 μg/mL;姜黄素+甘草次酸为(10.00+20.0)、(5.00+10.0)、(2.50+5.0)、(1.25+2.5) μg/mL,对照组为不加药处理的正常细胞。吸弃96孔板中的细胞培养基,迅速加入100 μL含有药物的培养基;每个药物浓度设置5个复孔。加药处理8、16、24 h后,吸弃培养基;加入含有10% CCK-8的1640培养基,37 ℃孵育30 min后,检测450 nm吸光度(A)值,计算肿瘤细胞的增殖抑制率。
增殖抑制率=1-A实验/A对照
采用金氏公式计算药物联用效果[7]:q=Ea+b/(Ea+Eb-Ea×Eb)(q:增效指数;Ea+b:实测合并效应;Ea、Eb分别为A、B单用之效应),0.85< q<1.15为相加(+);1.15<q<20为增强(++);0.55<q<0.85为拮抗。
2.2 Annexin V/PI双染法检测细胞凋亡取对数期生长的HepG-2细胞,胰酶消化后调整为5×105/mL,6孔板每孔加入2 mL细胞悬液(1×106个细胞,含血清),培养过夜;用1640培养基(不含血清)将药物稀释至一定的浓度:姜黄素5 μg/mL;甘草次酸10 μg/mL,姜黄素+甘草次酸为(5+10)μg/mL,对照组为不加药处理的正常细胞。吸弃培养基,加入新鲜配制的含有相应药物的培养基;培养24 h后,吸取各组细胞的培养上清至1.5 mL离心管中,3 000 r/min离心5 min收集上清中的细胞;各孔吸弃上清后,加入0.5 mL胰酶,消化为单细胞后加入0.5 mL完全培养基终止消化;吹打分散细胞后,转移细胞悬液至含上清细胞的1.5 mL离心管中,3 000 r/min离心5 min收集细胞。吸弃上清液,加入1 mL预冷的磷酸缓冲液(PBS)重悬细胞,3 000 r/min离心5 min,去上清;重复1次;用400 μL Annexin V结合液悬浮细胞,加入5 μL Annexin V-FITC染色液,混匀后4 ℃避光孵育15 min;加入10 μL PI染色液,混匀后4 ℃避光孵育5 min;流式细胞仪检测细胞凋亡情况。
2.3 流式细胞仪测定细胞周期细胞培养、种板、分组给药、收集、PBS清洗操作均同“2.2”项。PBS清洗2次后,离心得到细胞沉淀,加入250 μL预冷的PBS重悬,然后缓慢加入750 μL预冷的无水乙醇,4 ℃固定2 h; 3 000 r/min离心5 min,去上清液,然后加入1 mL预冷的PBS重悬细胞,之后3 000 r/min离心5 min收集细胞;吸弃PBS,加入500 μL碘化丙啶染色液,37 ℃避光孵育30 min;流式细胞仪检测细胞周期。
2.4 统计学处理采用SPSS 17.0软件进行统计分析,实验数据以x ± s表示,组间比较采用单因素方差分析。
3 结果 3.1 CCK-8检测细胞增殖抑制结果姜黄素、甘草次酸及其联合应用相应浓度组对HepG-2细胞的增殖抑制作用结果如表 1、2所示。随姜黄素、甘草次酸及联合用药浓度的增加,细胞增殖抑制作用增强,呈剂量相关性;随时间的延长,姜黄素、甘草次酸及其联合用药相应浓度组对HepG-2细胞的增殖抑制作用增强,呈时间相关性。由q值结果可知,联合用药组较相应浓度的姜黄素或甘草次酸组对HepG-2细胞的增殖抑制作用均呈现相加或增强作用。
| 表 1 姜黄素、甘草次酸及姜黄素+甘草次酸不同培养时间对HepG-2细胞增殖抑制率(x±s,n = 5) Table 1 Growth inhibition rate of Curcumin,Glycyrrhetinic acid and Curcumin combining with Glycyrrhetinic acid on hepatoma HepG-2 cell in different culture time (x±s,n = 5) |
| 表 2 姜黄素+甘草次酸不同培养时间的q值 Table 2 q value of Curcumin combining with Glycyrrhetinic acid in different culture time |
3.2 细胞凋亡作用结果
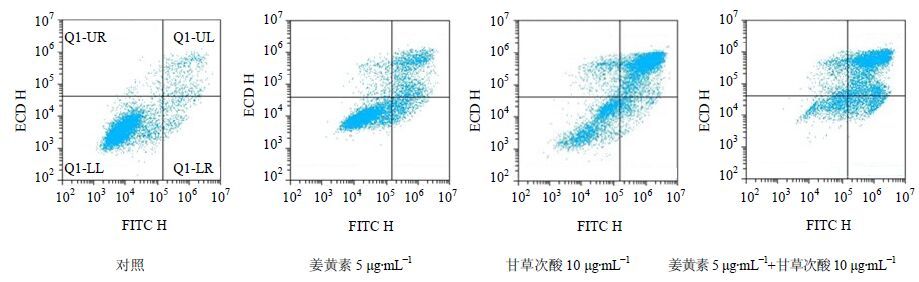
姜黄素、甘草次酸、姜黄素与甘草次酸联合用药对HepG-2细胞的凋亡作用见图 1、表 3。图 1中,左下角Q1-LL象限表示正常细胞,右下角Q1-LR象限表示早期凋亡细胞,右上角Q1-UR象限表示晚期凋亡细胞,左上角Q1-UL表示死亡细胞。姜黄素、甘草次酸、姜黄素+甘草次酸组与对照组比较,早期、晚期及总凋亡率均明显增强(P<0.01)。姜黄素与甘草次酸联合用药组较单药组早期、晚期及总凋亡率均明显增强(P<0.01)。
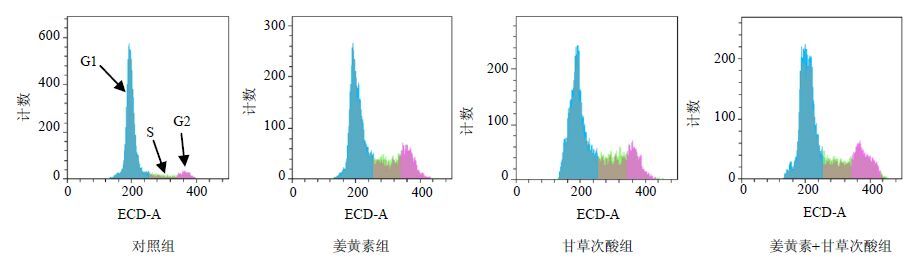
3.3 药物对HepG-2细胞周期的影响细胞周期包括间期和分裂期(M期)两个阶段。间期又分为DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)。姜黄素、甘草次酸、姜黄素与甘草次酸联合用药作用HepG-2细胞24 h后,对HepG-2细胞周期的作用见图 2、表 4。与对照组比较,姜黄素、甘草次酸、姜黄素+甘草次酸组对HepG-2细胞G1期占比明显下降(P<0.01),G2期占比明显升高(P<0.01)。与单药组比较,联合用药组G1期占比没有差异,G2期占比明显升高(P<0.05)。说明姜黄素、甘草次酸、姜黄素与甘草次酸联合用药均具有G2期阻滞作用,此外,3组药物作用细胞后,G1期峰形也均出现了明显的变化,变宽和钝。
|
图 1 姜黄素、甘草次酸、姜黄素与甘草次酸联合用药对HepG-2细胞凋亡的作用 Fig. 1 Cell apoptosis of Curcumin,Glycyrrhetinic acid and Curcumin combining with Glycyrrhetinic acid on hepatoma HepG-2 cell |
| 表 3 姜黄素、甘草次酸及姜黄素+甘草次酸组对HepG-2细胞凋亡作用(x±s,n = 3) Table 3 Cell apoptosis of Curcumin,Glycyrrhetinic acid,and Curcumin combining with Glycyrrhetinic acid on hepatoma HepG-2 cell (x±s,n = 3) |
|
图 2 姜黄素、甘草次酸、姜黄素与甘草次酸联合用药对HepG-2细胞周期的影响 Fig. 2 Influence of cell cycle of Curcumin,Glycyrrhetinic acid and Curcumin combining with Glycyrrhetinic acid on hepatoma HepG-2 cell |
4 讨论
姜黄、甘草均是常用药食同源中药,生物学效应广泛,毒副反应较低,且均具有一定的抗肿瘤作用,研究姜黄配伍甘草的合理性及科学性具有重要的临床价值。
姜黄素是姜黄的主要活性成分。姜黄素类化合物具有良好的抗氧化、抗肿瘤、抗艾滋病毒、抗炎、抗氧化、降血脂、抗动脉粥样硬化等多种生物活性[8],且毒性很低,被广泛应用于食品添加剂、食品色素和医药领域中。姜黄素对多种肿瘤细胞的产生、增殖、转移均具有抑制作用,如肝癌、结肠癌、乳腺癌等。因大量试验证明姜黄素具有明确的抗肿瘤活性,且抗癌谱较广,毒副作用小,美国国立肿瘤所已将其列为第三代癌化学预防药[9]。
| 表 4 姜黄素、甘草次酸及姜黄素+甘草次酸组对HepG-2细胞周期的作用(x±s,n = 3) Table 4 Effect on cell cycle of Curcumin,Glycyrrhetinic acid and Curcumin combining with Glycyrrhetinic acid on hepatoma HepG-2 cell (x±s,n = 3) |
甘草次酸是甘草的主要有效成分之一,是一种齐墩果烷型五环三萜化合物。近年来研究发现,甘草次酸对于肝癌、肺癌、宫颈癌、胃癌、结肠癌及白血病等具有广泛的抑制作用,并且对于正常体细胞的毒性较小[10]。研究还发现其具有较高的肝组织分布特征和肝细胞靶向性,使其不仅可作为药物载体,也可与药物产生协同作用。
姜黄与甘草配伍的合理性及科学性一直缺乏深入地研究,本研究采用细胞药理学方法,运用姜黄的主要有效成分(姜黄素)与甘草的主要有效成分(甘草次酸)对比观察二者合用增强抑制肝癌细胞HepG-2的增殖和诱导其凋亡的作用。
细胞培养初期采用含血清培养基,加药培养时用不含血清的培养基,因为在进行实验时发现甘草次酸采用含血清培养基稀释后没有观察到细胞增殖抑制作用,分析其原因可能是甘草次酸与血清蛋白结合而不能发挥细胞增殖抑制作用。研究表明甘草次酸的人血浆蛋白结合率为98.4%,其结合率不受药物浓度的影响,因血浆蛋白浓度变化而改变[11]。因而,在用甘草次酸进行细胞实验时,宜采用不含血清的培养基。
周京辉等[12]采用MTT法,研究姜黄素、甘草次酸以及姜黄素和甘草次酸联合用药分别与人肝癌细胞株HepG-2、人乳腺癌细胞株MCF-7、人肺癌细胞株A549细胞作用24 h,结果表明姜黄素和甘草次酸联合用药在3种癌细胞的增殖抑制方面表现出协同作用。在本研究条件下,姜黄素、甘草次酸及联合用药对HepG-2细胞增殖抑制作用呈剂量相关性和时间相关性,剂量越大,抑制作用越强;相同浓度,药物作用时间越长,抑制作用越强。姜黄素联合甘草次酸对HepG-2细胞的增殖抑制作用呈现相加或增强的作用,说明姜黄素与甘草次酸联合应用可增强抗肝癌HepG-2细胞的作用。
恶性肿瘤细胞具有快速、无限增殖能力,抑制肿瘤细胞的增殖、促进凋亡已成为目前抗肿瘤治疗的热点之一。细胞凋亡是在基因调控下细胞的自我消亡过程。研究[13]表明,肿瘤的发生不仅与细胞增殖有关,而且与细胞的抗凋亡密切相关。对HepG-2细胞的凋亡诱导作用表明,姜黄素、甘草次酸、姜黄素+甘草次酸组与对照组比较,早期、晚期及总凋亡率均明显增强,且联合用药组较单药组早期、晚期及总凋亡率也均明显增强。对HepG-2细胞周期的影响表明,姜黄素、甘草次酸、姜黄素与甘草次酸联合用药组均具有G2期阻滞作用。文献[14-15]也报道了姜黄素对HepG-2细胞G2期阻滞作用,但甘草次酸对HepG-2细胞G2期阻滞作用尚未见报道。
临床化疗药物使用表明,单一抗肿瘤药物应用往往达不到好的效果,为此临床常采用多药联合治疗。合理的多药联用往往可以达到增强疗效,减轻毒副作用的。本实验研究结果显示,姜黄素与甘草次酸均为中药活性成分,毒副作用小,均具有良好的抗HepG-2肿瘤细胞株的作用,而且,两者联合用药增强了对人肝癌HepG-2细胞的增殖抑制和诱导凋亡的作用,这一研究结果为两者临床联合应用提供了依据,同时也间接验证了姜黄与甘草配伍的合理性及科学性。
| [1] | Chen J G, Zhang S W. Liver cancer epidemic in China:past, present and future[J]. Semin Cancer Biol, 2011, 21(1):59–69. doi:10.1016/j.semcancer.2010.11.002 |
| [2] | 李瀚旻. 基于"补肾生髓成肝"的肝癌三级预防方案的构建与应用[J]. 中西医结合肝病杂志, 2015,25(6):369–372. |
| [3] | Shen X, Cheng S, Peng Y, et al. Attenuation of early liver fibrosis by herbal compound "Diwu Yanggan" through modulating the balance between epithelial-to-mesenchymal transition and mesenchymal-to-epithelial transition[J]. BMC Complement Altern Med, 2014, 14:418. doi:10.1186/1472-6882-14-418 |
| [4] | Zhao B B, Li H M, Gao X, et al. The herbal compound "diwu yanggan" modulates liver regeneration by affecting the hepatic stem cell microenvironment in 2-acetylaminofluorene/partial hepatectomy rats[J]. Evid Based Complement Alternat Med, doi:10.1155/2015/468303. Epub 2015 Jan 5. |
| [5] | 李瀚旻, 赵宾宾, 高翔, 等. "补肾生髓成肝"改善肝再生微环境防治肝癌的作用及机制[J]. 湖北中医药大学学报, 2015,17(1):5–8. |
| [6] | Li H M. Microcirculation of liver cancer, microenvironment of liver regeneration, and the strategy of chinese medicine[J]. Chin J Integr Med, 2016, 22(3):163–167. doi:10.1007/s11655-016-2460-y |
| [7] | 金正均. 合并用药中的相加[J]. 中国药理学报, 1980,1(2):70–76. |
| [8] | 张峰, 陈敬清, 岑娟, 等. 具有高水解稳定性的姜黄素类似物的抗多药耐药肿瘤作用研究[J]. 中草药, 2014,45(12):1736–1742. |
| [9] | 韦星船, 刘自力, 何雄, 等. 姜黄素类化合物抗肿瘤活性研究进展[J]. 广州化工, 2010,38(12):48–51. |
| [10] | 高振北, 康潇, 许传莲, 等. 甘草次酸抗肿瘤作用机制研究进展[J]. 中国中药杂志, 2011,36(22):3213–3216. |
| [11] | 吴锡铭. 甘利欣一种新型抗肝炎剂的研究[J]. 现代应用药学, 1995,12(4):52–53. |
| [12] | 周京辉, 魏晓翠, 曾志涛. 姜黄素与甘草次酸联合用药的体外抗肿瘤作用[J]. 北方药学, 2011,8(4):7–9. |
| [13] | 曾繁余, 刘菁, 袁桂峰, 等. 姜黄素对HepG-2细胞增殖与凋亡的影响[J]. 中国普通外科杂志, 2013,22(4):474–478. |
| [14] | 王牡, 阮余霞, 彭元, 等. 姜黄素对人肝癌HepG2细胞毒性的分析[J]. 分析测试学报, 2011,30(2):121–127. |
| [15] | 方丽, 周进. 姜黄素对人肝癌细胞株HepG2凋亡和细胞周期的影响[J]. 四川医学, 2009,30(4):458–459. |
 2017, Vol. 40
2017, Vol. 40


