2. 陕西省人民医院妇科, 陕西 西安 710068;
3. 西安医学院生物化学与分子生物学教研室, 陕西 西安 710021
2. Department of Gynecology, Shaanxi Provincial of people'Hospital Xi'an 710068, Cina ;
3. Department of Biochemistry and molecular biology, Xi'an Medical University, Xi'an 710021, China
银屑病是皮肤慢性炎症性自身免疫疾病,其特征为皮肤红斑伴有鳞屑、表皮增厚、免疫损伤浸润表皮和真皮之间导致皮肤损害,严重影响患者的生活质量[1]。银屑病的发病机制目前仍不清楚[2-3],但已经明确的是,皮肤损伤由免疫细胞和角蛋白细胞相互作用失调导致。角蛋白17(Keratin 17,K17)是一种细胞支架蛋白,在银屑病皮肤损伤表皮过度表达,但在健康表皮未发现,因此,K17被视为银屑病标志性分子[4]。更为重要的是,在银屑病组织K17表达与Th1细胞过度活跃之间存在相互联系[5]。另也有报道,K17是唯一异位表达在银屑病皮损表皮的角蛋白,抑制K17改善银屑病生物学功能,表明K17可以作为治疗银屑病的新靶点[6]。
白藜芦醇(Resveratrol,Rsv)是一类小分子多酚化合物,近十年来被广泛研究。Rsv有多种天然植物来源,尤其是桑椹、花生和葡萄,主要作为天然药物及饮食补充引起广泛关注。近些年发现,Rsv对代谢性、心血管性以及年龄相关的综合征如神经退行性病变和肿瘤具有很强的保护作用,对各种组织和细胞具有很强的抗炎作用[7-9]。
银屑病包括多种治疗方法,例如激素或维生素D类似物局部治疗、紫外线等日光疗法、甲氨蝶呤和环孢菌素等全身治疗以及抗TNF-α和抗IL-12/23抗体生物治疗。但这些治疗方法副作用严重,因此,研究开发有效且安全的药物是银屑病治疗发展的趋势。文献报道,Rsv发挥很强的抗炎作用的同时也是AMPK激动剂[8],而AMPK与K17的表达有密切联系[10]。本课题应用咪喹莫特(IMQ)诱导小鼠银屑病样皮肤损伤,观察Rsv通过影响K17表达改善小鼠银屑病样皮肤损伤的作用。
1 材料 1.1 实验动物SPF级BALB/c鼠,购自第四军医大学实验动物中心,实验动物生产许可证号为SCXK(陕)2015-003,饲养于第四军医大学实验动物中心,室温23 ℃,湿度60%,小鼠均可自由饮水进食。本动物实验获得第四军医大学实验动物中心伦理委员会批准。
1.2 药物及主要试剂5% IMQ乳膏,英国3M医药用品上海公司,批号H20100157;Rsv乳膏,由第四军医大学唐都医院药剂科配制,批号为QA-001-2015,质量分数为2.35%;SYBR Green Real time PCR Master mix试剂盒,购自Toyobo公司;所有引物均由上海生工生物有限公司合成。
1.3 主要仪器Nanodrop浓度检测仪(美国Thermo公司);光学显微镜及照相系统(Olympus公司);稳压电泳仪(北京六一仪器厂);Odyssey红外成像系统(LI-COR公司);CFX96 Real-Time PCR仪(Bio-Rad公司);游标卡尺(日本Mitutoyo型号530)。
2 方法 2.1 银屑病样皮肤模型的建立及分组给药BALB/c小鼠随机分为4组:对照组、Rsv组、模型(IMQ)组、Rsv治疗(IMQ+Rsv)组,每组6只。其中,模型组和Rsv治疗组每天涂抹剂量为62.5 mg的5% IMQ乳膏于小鼠耳部皮肤,每天1次,连续用药8 d,以小鼠耳部皮肤出现鳞屑及红斑为造模成功。对照组每天给予同等剂量凡士林,Rsv组和Rsv治疗组的Rsv给药剂量均为每天20 mg,剂量依据参考文献设置[11]。每天1次,造模与治疗同步进行,小鼠外耳均匀涂抹给药,连续给药8 d。
2.2 银屑病面积与严重程度评分小鼠耳部皮肤按红斑、表皮鳞屑和皮肤浸润增厚程度等特征进行评分。根据皮损处鳞屑、红斑的程度分为:无,0分;轻度,1分;中度,2分;重度,3分;极重度,4分。
耳部厚度用游标卡尺精确测量,以0~4分评价:0分,0.30~0.40 mm;1分,0.40~0.50 mm;2分,0.50~0.60 mm;3分,0.60~0.70 mm;4分,0.70~0.80 mm。以红斑、鳞屑及皮肤增厚程度得分累加得到总分,并拍照记录。
2.3 样本采集实验第8天,颈椎脱臼处死小鼠,取耳,准确称取其质量、测量其厚度,部分用于蛋白提取;部分4%多聚甲醛固定,HE染色;部分Trizol裂解,-80 ℃冰箱保存。
2.4 实时荧光定量PCR(qRT-PCR)检测Trizol法提取各组耳RNA,反转录后定量备用,取10 μL体系进行qRT-PCR,反应体系为:上下游引物各0.4 μL,cDNA 1 μL,PCR Mix 5 μL,ddH2O 3.2 μL。扩增条件为:94 ℃预变性30 s,94 ℃变性12 s,56 ℃ 45 s,72 ℃ 45 s,78.5 ℃读板1 s,45个循环,Primer 5.0设计引物,引物序列见表 1。
| 表 1 基因及其特异引物 Table 1 Genes and specific primers |
2.5 Western blotting检测各组耳K17蛋白水平
取每组小鼠新鲜耳部组织,提取蛋白后定量;SDS-PAGE凝胶电泳,湿转法将蛋白质转移至PVDF膜;5%牛奶封闭2 h,K17及β-actin一抗4 ℃孵育过夜;TBST洗膜3次,每次5 min,HRP标记的二抗37 ℃孵育1 h;TBST洗膜3次,ECL发光,曝光后扫描,以K17和内参β-actin的条带灰度比值表示K17蛋白水平,用Image J软件对条带灰度值进行分析。
2.6 统计学分析数据采用x ± s表示,采用GraphPad Prism 7.0进行单因素方差分析。
3 结果 3.1 鼠耳厚度及评分如图 1所示,随着时间的推移,模型组鼠耳厚度较对照组和Rsv组显著增加(P<0.05),第6天达到最高;Rsv治疗组小鼠耳缘厚度与模型组比较降低,第6天差异显著(P<0.05)。耳厚度评分与耳厚度测量结果一致。

|
与对照组比较:*P<0.05;与模型组比较:#P<0.05,下同 *P < 0.05 vs control group #P < 0.05 vs model group,same as below 图 1 鼠耳厚度及评分(x±s,n = 6) Fig. 1 Ear thickness and score (x±s,n = 6) |
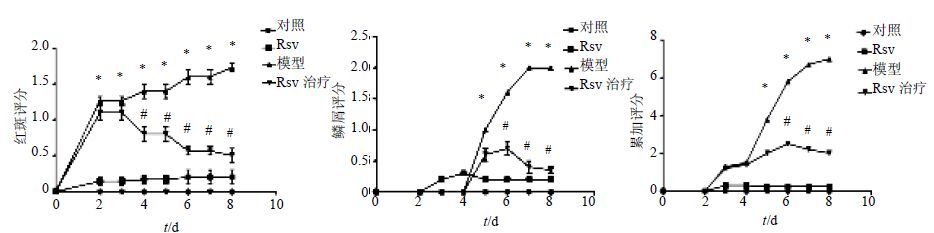
3.2 鼠耳红斑及银屑的评分
如图 2所示,与对照组比较,Rsv组在耳缘厚度以及红斑和表皮鳞屑中无显著差异,模型组红斑及银屑面积逐渐增加(P<0.05)。与模型组比较,Rsv治疗组红斑面积明显减少,第4~8天差异显著(P<0.05);表皮鳞屑减少,第6~8天差异显著(P<0.05)。在耳肥厚程度、红斑及银屑总评分中,与模型组比较,第6~8天,Rsv治疗组评分显著降低(P<0.05)。
3.3 对IMQ诱导耳部组织结构的影响如图 3所示,与对照组和Rsv组比较,IMQ组耳缘组织的上下表皮增厚,炎细胞浸润;Rsv治疗组耳缘组织表皮厚度明显减轻,炎细胞浸润减少。
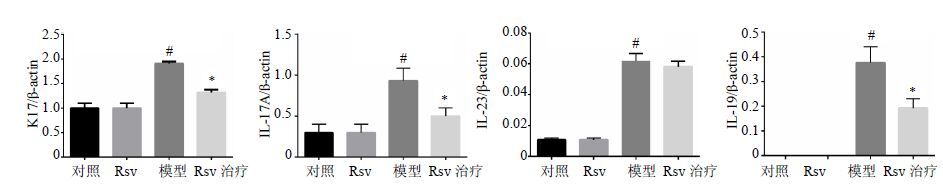
3.4 对各组鼠耳K17、IL-17A、IL-19及IL-23 mRNA表达的影响如图 4所示,与对照组比较,模型组K17、IL-17A、IL-19及IL-23 mRNA表达明显升高(P<0.05);Rsv治疗后K17、IL-17A、IL-19 mRNA表达显著降低(P<0.05),而IL-23表达变化不明显。
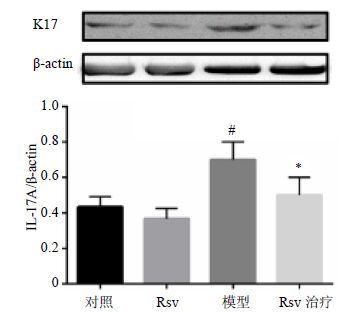
3.5 对小鼠耳部组织K17蛋白表达的影响如图 5所示,与对照组和Rsv组比较,模型组K17蛋白水平显著升高(P<0.05);Rsv治疗后,K17蛋白表达较模型组显著下降(P<0.05)。
|
图 2 鼠耳红斑及银屑的评分评价Rsv对IMQ诱导的皮肤损伤改善作用(x±s,n = 6) Fig. 2 Evaluation of promotion of Rsv on psoriasis like skin damage with mouse ear erythema and psoriasis score (x±s,n = 6) |

|
图 3 HE染色观察组织结构 Fig. 3 HE stained of mouse ear |
|
图 4 Rsv对各组耳组织K17、IL-17A、IL-19及IL-23 mRNA表达的影响(x±s,n = 3) Fig. 4 Effect of Rsv on expression of K17,IL-17A,IL-19,and IL-23 mRNA (x±s,n = 3) |
|
与对照组比较:*P<0.05;与模型组比较:#P<0.05 *P < 0.05 vs control group #P < 0.05 vs model group 图 5 Rsv对各组耳组织K17蛋白表达的影响(x±s,n = 3) Fig. 5 Western blotting were used to detected K17 protein expression in tissues (x±s,n = 3) |
4 讨论
银屑病属于皮肤慢性复发性自身免疫性疾病,影响2%~3%的人群,其特征为异常的角质细胞增殖,表现为皮肤鳞屑样及红斑样损伤[12]。这些损害显示过多的角质细胞增殖,异常的角质细胞分化,以及出现炎症细胞,包括T淋巴细胞、B淋巴细胞和树突状细胞。
IMQ诱导的小鼠模型被广泛用于研究皮肤的银屑病样损伤。IMQ是Toll受体TLR7和TLR8的配体,当其局部应用就会导致小鼠银屑病样皮肤损伤,具有人类银屑病的一些特点。因此,IMQ诱导的小鼠皮肤损伤模型是被公认的小鼠银屑病模型[6]。
银屑病病变组织中免疫细胞浸润皮肤,释放促炎症细胞因子,其中K17在银屑病中发挥重要的作用[13]。在活动的银屑病皮肤损害中,角蛋白(K17)是唯一的异位表达在银屑病皮损表皮角蛋白,最近成为银屑病发病的关键成分[14]。直接抑制K17和相关炎症介质被证明是有效改善银屑病综合征[6]。
文献报道,来源于TH17、TH22细胞的IFN-γ、IL-17A及IL-22在角质形成细胞以剂量相关性方式上调K17 mRNA水平及蛋白水平,这些效应被STAT-1和STAT-3特异抑制剂小干扰RNA部分阻断[15-16]。在该报道中还提出存在K17/T细胞/细胞因子免疫环,其中异位表达K17通过激活自身反应性T细胞影响银屑病[6]。应用反义寡核苷酸和RNAi抑制在体K17 mRNA和蛋白在银屑病皮肤的表达,在临床和组织学上均发挥对银屑病的改善作用[6]。Rsv是近些年来发现的对代谢性、心血管性以及年龄相关性疾病,包括神经退行性病变及癌症等,有非常强的保护作用。Rsv为AMPK激动剂[8],可能通过激活AMPK抑制K17蛋白表达[10],从而改善银屑病。
最近研究表明,新确认的T细胞的亚型Th17细胞在银屑病形成中发挥关键作用[17]。IL-23活化Th17细胞,并且产生细胞因子IL-17A。此外,Th17细胞与其他的Th细胞亚型共同产生细胞因子IL-22和IFN-γ。IL-17A和IL-22通过多种途径共同影响角蛋白细胞[18],Th17细胞产生IL-17和IL-22作用于K17的表达[17]。同时,本课题组发现来源于Th17和Th22细胞的IL-22有类似调节K17表达的作用。根据本实验结果推测,Rsv可能通过抑制IL-19和IL-17A表达减少K17 mRNA水平,引起K17蛋白水平表达减少,还有待于实验进一步证实。
总之,Rsv对于IMQ诱导的银屑病样皮肤损伤具有一定的改善作用。本研究表明,Rsv能有效抑制组织K17分子表达,其机制可能与作用于AMPK和抑制IL-17A、IL-19表达相关,但具体的分子机制还有待于进一步研究。
| [1] | Boehncke W H, Schon M P. Psoriasis[J]. Lancet, 2015, 11(386):983–994. |
| [2] | Zaba L C, Fuentes-Duculan J, Eungdamrong N J, et al. Psoriasis is characterized by accumulation of immune-stimulatory and Th1/Th17 cell-polarizing myeloid dendritic cells[J]. J Invest Dermatol, 2009, 129(1):79–88. doi:10.1038/jid.2008.194 |
| [3] | Quaglino P, Bergallo M, Ponti R, et al. Th1, Th2, Th17 and regulatory T cell pattern in psoriatic patients:modulation of cytokines and gene targets induced by etanercept treatment and correlation with clinical response[J]. Dermatology, 2011, 223(1):57–67. doi:10.1159/000330330 |
| [4] | de Jong E M, van Vlijmen I M, van Erp P E, et al. Keratin 17:a useful marker in anti-psoriatic therapies,[J]. Arch Dermatol Res, 1991, 283(7):480–482. doi:10.1007/BF00371788 |
| [5] | Nickoloff B J. Cracking the cytokine code in psoriasis[J]. Nat Med, 2007, 13(3):242–244. doi:10.1038/nm0307-242 |
| [6] | Fu M, Wang G. Keratin 17 as a therapeutic target for the treatment of psoriasis[J]. J Dermatol Sci, 2012, 12(67):161–165. |
| [7] | 李先宽, 李赫宇, 李帅, 等. 白藜芦醇研究进展[J]. 中草药, 2016,47(14):2568–2578. |
| [8] | Kulkarni S S, Cantó C. The molecular targets of resveratrol[J]. Biochim Biophys Acta, 2015, 1852(6):1114–1123. doi:10.1016/j.bbadis.2014.10.005 |
| [9] | 刘顺, 李赫宇, 赵玲. 白藜芦醇降血尿酸、抗炎作用研究进展[J]. 药物评价研究, 2016,39(2):304–307. |
| [10] | Garcin G, Guiraud I, Lacroix M, et al. AMPK/HuR-Driven IL-20 post-transcriptional regulation in psoriatic skin[J]. J Invest Dermatol, 2015, 135(11):2732–2741. doi:10.1038/jid.2015.282 |
| [11] | Cullberg K B, Olholm J, Paulsen S K, et al. Resveratrol has inhibitory effects on the hypoxia-induced inflammation and angiogenesis in human adipose tissue in vitro[J]. Eur J Pharm Sci, 2013, 49(2):251–257. doi:10.1016/j.ejps.2013.02.014 |
| [12] | Flutter B, Nestle F O. TLRs to cytokines:mechanistic insights from the imiquimod mouse model of psoriasis[J]. Eur J Immunol, 2013, 43(4):3138–3146. |
| [13] | Sun Y, Zhang J, Huo R, et al. Paeoniflorin inhibits skin lesions in imiquimod-induced psoriasis-like mice by down-regulating inflammation,[J]. Int Immuno-pharmacol, 2015, 24(6):392–399. |
| [14] | Byamba D, Kim D Y, Kim D S, et al. Skin-penetrating methotrexate alleviates imiquimod-induced psoriasis form dermatitis via decreasing IL-17-producing gamma delta T cells[J]. Exp Dermatol, 2014, 23(7):492–496. doi:10.1111/exd.2014.23.issue-7 |
| [15] | Zhang W, Dang E, Shi X, et al. The pro-inflammatory cytokine IL-22 up-regulates keratin 17 expression in keratinocytes via STAT3 and ERK1/2[J]. PLoS One, 2012, 7(6):e40797. |
| [16] | Shi X, Jin L, Dang E, et al. IL-17A up-regulates keratin 17 expression in keratinocytes through STAT1-and STAT3-dependent mechanisms[J]. J Invest Dermatol, 2011, 131(7):2401–2408. |
| [17] | Rathore J S, Wang Y. Protective role of Th17 cells in pulmonary infection[J]. Vaccine, 2016, 34(13):1504–1514. doi:10.1016/j.vaccine.2016.02.021 |
| [18] | Loschke F, Seltmann K, Bouameur J E, et al. Regulation of keratin network organization[J]. Curr Opin Cell Biol, 2015, 2(32):56–64. |
 2017, Vol. 40
2017, Vol. 40

