鬼臼毒素(popdophyllotoxin,POD)亦名足叶草毒素、鬼臼脂素,属于木脂体类,是一类具有2,3-丁内酯-4-芳基四氢萘化学结构的天然活性物质,主要存在于小檗科多年生草本类群鬼臼亚科八角莲属、桃儿七属、山荷叶属及足叶草属植物中[1]。研究发现,鬼臼毒素对小细胞肺癌、睾丸癌、白细胞癌、淋巴肉瘤、神经胶质瘤、霍奇金淋巴瘤等多种肿瘤有特殊疗效[2]。损伤正常细胞、引起胃肠不适、耐药性强等毒副作用,限制了鬼臼毒素临床应用[3],科研工作者对鬼臼类化合物的结构进行了大量的改造,获得了抗肿瘤活性好且毒副作用小的鬼臼类衍生物,如4′-去甲基表鬼臼毒素等。陆艳玲课题组设计并合成了一系列鬼臼毒素衍生物,并对其进行了初步体外抗肿瘤测试,结果显示,鬼臼毒素衍生物对人宫颈癌HeLa细胞、鳞状上皮癌细胞KBV 200等具有不同程度的抑制作用[4-6]。马保玉等在药物作用HeLa细胞48 h后检测细胞活性,4′-去甲基-4′-氧-环丁甲酰基-去氧鬼臼毒素和鬼臼苦素对于HeLa细胞有显著的抑制作用,且在一定浓度范围内具有明显的剂量依赖性[7]。
随着医学和药物制剂技术的不断发展,脂质体纳米粒、沸石介孔纳米材料、SiO2囊状纳米球、聚合物胶束等作为新型药物载体,以其良好的组织相容性和靶向缓释特性,成为目前肿瘤靶向治疗的研究热点[7]。种树彬等的研究发现,鬼臼毒素纳米脂质载体(POD-NLC)对永生化人宫颈上皮细胞(H8细胞)具有良好的增殖抑制和诱导凋亡作用,表明POD-NLC不仅在尖锐湿疣(CA)和人类乳头瘤病毒(HPV)的潜伏感染治疗中具有较好的应用前景,而且在宫颈癌前病变治疗中有较大应用潜力[8]。纳米SiO2粒径在3~100 nm之间,粒径小、分散性好、化学纯度高、比表面积大,同时生物相容性好、毒性低,又因其内外表面存在大量易于修饰的硅羟基,易于表面改性为亲水或疏水,容易搭载不同粒径的药物。
本课题组尝试采用自制25 nm SiO2小球复合、包覆鬼臼毒素及其衍生物,降低鬼臼毒素及其衍生物的毒副作用,制备出一种高效低毒、结构新颖且利于与靶标结合的药物。但是,鬼臼毒素类衍生物对于抗宫颈癌作用方面的报道较少。因此,本课题对鬼臼毒素、4′-去甲基表鬼臼毒素和纳米SiO2搭载该药物进行HeLa细胞的体外增殖抑制研究,并探讨HeLa细胞的凋亡机制,为进一步研发鬼臼毒素类新药提供指导[9]。
1 材料 1.1 细胞人宫颈癌细胞系HeLa细胞,购自中国科学院上海细胞生物学研究所。
1.2 药物及主要试剂鬼臼毒素、4′-去甲基表鬼臼毒素(甘肃中医药大学药物化学实验室自制,质量分数≥98%);正硅酸乙酯(TEOS,质量分数92.9%~93.6%)、CH2CHOH(质量分数>99.0%)、NH4OH(质量分数>99.0%)分析纯(corning Inc,NY,USA);纳米SiO2载体(甘肃中医药大学纳米制备室自制,制备方法见“2.1”项);胎牛血清(加拿大Wisent公司);0.25%胰蛋白酶(美国Hyclone公司);Annexin V-FITC/PI试剂盒(杭州联科生物技术股份有限公司);DMSO(北京索莱宝公司);顺铂(齐鲁制药有限公司,批号511013CF);四甲基偶氮唑盐MTT(北京索莱宝公司);Hoechst 33342(上海碧云天生物技术研究所);抗体Bax、Bcl-2、Caspase-3、p53、p38和GAPDH(美国Santa Cruz公司)。
1.3 主要仪器96孔培养板(美国corning公司);酶联免疫检测仪、凝胶成像分析系统(美国Bio-Rad公司);DP72倒置显微镜(日本Olympus公司);全自动细胞荧光计数分析仪(美国Cellometer公司);二氧化碳培养箱(日本三洋电机公司);雷磁PHS-3E pH计(上海精密科学仪器有限公司);电热鼓风干燥箱(北京科伟永兴仪器有限公司);马弗炉(北京盈安美诚科学仪器有限公司);Max-2400 X射线衍射仪(日本Rigaku公司);JEM-2100F 200 kV透射电子显微镜(TEM,日本JEOL公司)。
2 方法 2.1 纳米SiO2小球的制备利用正硅酸乙酯水解法合成纳米SiO2小球。以1:4的比例将TEOS与CH2CHOH混合得到溶液,室温条件下,在恒温磁力搅拌器中以500 r/min的转速搅拌4 h,然后在溶液中缓慢加入蒸馏水,冷却至室温后用NH4OH调节pH值,于80 ℃烘干48 h得到固体,利用马弗炉580 ℃加热烧结4 h得到纳米SiO2小球。
样品的物像及结构采用X射线衍射仪CuK α辐射、波长1.540 56×10-4μm进行分析。将制备得到的样品超声分散于无水乙醇中,用透射电子显微镜(TEM)在200 KV下观察颗粒的大小与形态。
以无水乙醇为溶剂,温度为65 ℃,搅拌速度1 000 r/min,12.500、1.250、0.125 μg/mL纳米SiO2小球乙醇溶液分别与6.25 μg/mL 4′-去甲基表鬼臼毒素乙醇溶液混合,恒温搅拌8 h,制备出不同浓度的联合用药。
2.2 MTT法测定细胞增殖抑制率选取对数增殖期的HeLa细胞,0.25%胰蛋白酶消化,制成单细胞悬液,以每孔3×103个接种于96孔培养板,分为对照组、SiO2组、鬼臼毒素组、4′-去甲基表鬼臼毒素组、联合用药(4′-去甲基表鬼臼毒素+纳米SiO2)组。接种24 h后,SiO2组加入浓度为100.0、50.0、25.0、12.5 μg/mL的纳米SiO2;鬼臼毒素和4′-去甲基表鬼臼毒素组浓度为50.00、25.00、12.50、6.25 μg/mL;联合用药组加入12.500、1.250、0.125 μg/mL纳米SiO2小球分别搭载6.25 μg/mL 4′-去甲基表鬼臼毒素的SiO2复合物;对照组加入完全培养基。
将96孔板置于37 ℃、5% CO2、水饱和的细胞培养箱内培养,分别培养24、48、72 h后取出。每孔加入20 μL MTT溶液(5 mg/mL),置于培养箱内继续培养4 h后,取出迅速倾倒孔内液体,加入150 μL DMSO,置37 ℃恒温摇床上低速振荡10 min,酶标仪检测570 nm波长的吸光度(A)值。以上MTT实验步骤重复3次,HeLa细胞活性用A值表示,通过公式计算HeLa细胞活力、增殖抑制率。
细胞活力=A570 (实验)/A570 (对照)
增殖抑制率=1-A570 (实验)/A570 (阴性)
2.3 Hoechst 33342细胞染色观察受试药物对HeLa细胞凋亡的影响将HeLa细胞以每孔1×103个接种于96孔细胞培养板内,并将细胞分为对照组、SiO2组、鬼臼毒素组、4′-去甲基表鬼臼毒素组。待细胞贴壁后,对照组加入完全培养基;SiO2组加入浓度为100.0 μg/mL的纳米SiO2;鬼臼毒素组和4′-去甲基表鬼臼毒素组浓度为50 μg/mL;继续培养24、48、72 h。培养结束后,吸弃培养液,加入PBS缓冲液清洗3次,每次5 min;清洗结束后,每孔加入4%多聚甲醛1 mL,室温固定20 min;10 μg/mL的Hoechst 33342室温染色15 min,PBS缓冲液清洗3次,每次5 min。采用倒置显微镜观察药物作用后细胞形态的变化。
2.4 细胞形态观察将HeLa细胞以每孔1×103个接种于96孔细胞培养板内,并将细胞分为对照组、SiO2和4′-去甲基表鬼臼毒素联合用药组。待细胞贴壁后,对照组加入完全培养基;联合用药组加入12.5、1.25、0.125 μg/mL纳米SiO2小球分别搭载6.25 μg/mL 4′-去甲基表鬼臼毒素的SiO2复合物,继续培养24、48、72 h。培养结束后,倒置显微镜观察细胞形态,并拍照。
2.5 Western blotting法检测Bax、Bcl-2、Caspase-3、p53和p38蛋白表达选取细胞密度在70%~80%的HeLa细胞7瓶,分为对照组、SiO2(6.25 μg/mL纳米SiO2)组、顺铂(10 μg/mL,阳性药)组、4′-去甲基表鬼臼毒素(6.25 μg/mL)组、联合用药组,对照组只加入完全培养基,联合用药组加入12.500、1.250、0.125 μg/mL纳米SiO2小球分别搭载6.25 μg/mL 4′-去甲基表鬼臼毒素的SiO2复合物。
药物作用24 h后,收集各组细胞,用预冷PBS洗涤3次后,将细胞重悬于裂解液中,冰浴30 min,使细胞充分裂解。4 ℃、12 000 r/min离心10 min,收集上清液,进行蛋白质定量。各组取等量蛋白质,经5%、12% SDS-PAGE分离后,转膜至PVDF膜上,封闭后,与一抗结合,4 ℃摇床过夜;TBST洗涤后与二抗结合反应,同上洗涤。用ECL发光显色后,在凝胶成像系统上曝光检测,采用Quantity One 4.6.2软件对图像进行光密度分析,以GAPDH作为内参,结果将目的蛋白质条带与内参GAPDH条带的比值作为参照,实验重复3次。
2.6 统计学分析数据用x ± s表示,采用SPSS 17.0统计软件处理分析数据,采用单因素方差分析(One-way ANOVA)。
3 结果 3.1 纳米SiO2小球的表征从图 1-A中可以看出,正硅酸乙酯水解法制得的纳米SiO2样品均为单相,在2θ=25°左右时出现最强峰。且实验中发现,随着pH的升高,衍射峰不断宽化。从图 1-B中可以看出,纳米SiO2样品的粒径约为25 nm,样品分散性良好,粒径较小且形貌较好。这是因为实验中改进工艺,降低了反应体系浓度,调节pH并进行了超声波分散,使小球形貌和粒径在形成时产生了变化。
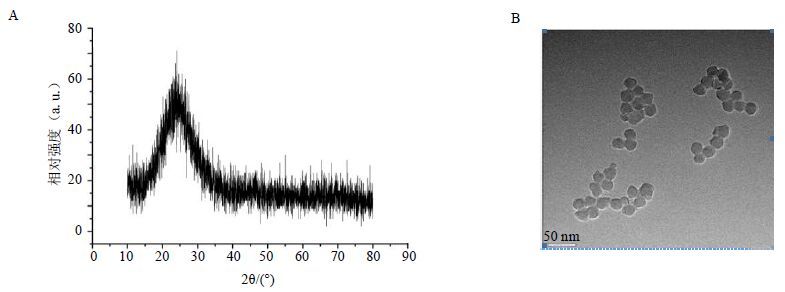
|
图 1 SiO2小球的X射线衍射图谱(A)和TEM图(B) Fig. 1 XRD photo (A) and TEM photo (B) of 25 nm nano silica sample |
3.2 MTT实验 3.2.1 纳米SiO2对HeLa细胞增殖的抑制作用
纳米SiO2浓度梯度由100 μg/mL起始,用量倍减,通过对各浓度梯度柱状图进行对比可知,各时段各浓度SiO2均对HeLa细胞的增殖产生一定影响(P<0.01)。其中低浓度影响微弱,高浓度影响较强,100 μg/mL SiO2在48、72 h时段对细胞的抑制率达30%。SiO2各浓度组内24、48、72 h各时段间比较均差异显著(P<0.01),说明SiO2对 HeLa细胞增殖抑制作用具有时间相关性。考虑载药研究时SiO2浓度与药物的搭配浓度比例,选用12.5 μg/mL进行联合用药研究。结果见图 2。
3.2.2 鬼臼毒素对HeLa细胞增殖的抑制作用鬼臼毒素浓度梯度由50 μg/mL递减,通过对各浓度梯度柱状图进行对比可知,各时段各浓度鬼臼毒素均对Hela细胞的增殖发挥显著抑制作用(P<0.01)。鬼臼毒素各浓度组内24、48、72 h各时间段间比较均差异显著(P<0.01),说明鬼臼毒素对HeLa细胞增殖抑制作用具有时间依赖性。48至72 h时段细胞死亡数量多,可推断鬼臼毒素作用于细胞的主要时间段在48~72 h。随着浓度的增加,鬼臼毒素细胞增殖抑制作用逐渐增强,但变化不显著,可观察到50 μg/mL浓度时,细胞存活率仍均小于其他各浓度,推断药物对于细胞作用的剂量未达到饱和浓度。结果见图 3。
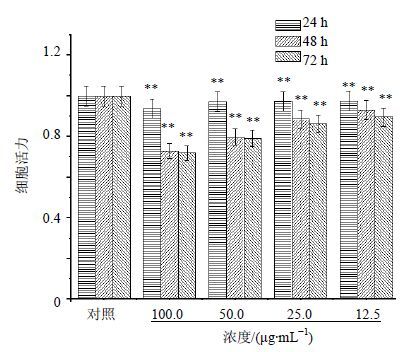
|
与对照组比较: **P<0.01,下同 **P < 0.01 vs control group,same as below 图 2 不同浓度纳米SiO2在24、48、72 h时段对HeLa细胞的增殖抑制作用(x±s,n=3) Fig. 2 Inhibition on Hela growth of nano SiO2 with different concentrations in 24,48,and 72 h (x±s,n = 3) |
3.2.3 4′-去甲基表鬼臼毒素对HeLa细胞的增殖抑制作用
4′-去甲基表鬼臼毒素是鬼臼毒素的主体衍生物,其浓度梯度由50 μg/mL递减,通过对各浓度各时间段梯度柱状图对比可知,不同浓度4′-去甲基表鬼臼毒素组内24、48和72 h各时间段间比较均差异显著(P<0.01),4′-去甲基表鬼臼毒素作用于细胞的杀伤作用时间较为均匀,各时段都有一定的细胞死亡。较鬼臼毒素而言,4′-去甲基表鬼臼毒素每增加一定浓度,其对细胞的抑制率变化更显著。在24 h时段,50 μg/mL 4′-去甲基表鬼臼毒素的抑制率高达40%,远高于鬼臼毒素20%的抑制率,且其他各时段4′-去甲基表鬼臼毒素对应浓度的杀伤作用均强于鬼臼毒素,可证明4′-去甲基表鬼臼毒素比鬼臼毒素对Hela细胞的增殖抑制作用强。结果见图 4。
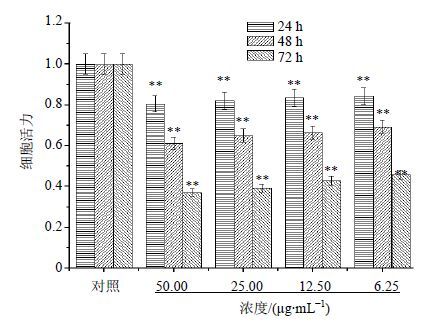
|
图 3 不同浓度鬼臼毒素在24、48、72 h时段对HeLa细胞的增殖抑制情况(x±s,n=3) Fig. 3 Inhibition on Hela growth of podophyllotoxin with different concentrations in 24,48,and 72 h (x±s,n = 3) |
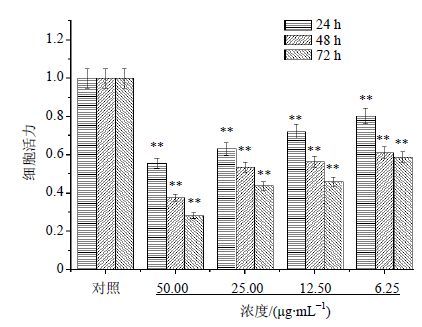
|
图 4 4′-去甲基表鬼臼毒素在24、48、72 h时段对HeLa细胞的增殖抑制作用 (x±s,n=3) Fig. 4 Inhibition on HeLa growth of 4′-demethylepi-podophy llotoxin with different concentrations in 24、48 and 72 h (x±s,n=3) |
3.2.4 联合用药对HeLa细胞的增殖抑制作用
由图 5与图 4对比可知:6.25 μg/mL 4′-去甲基表鬼臼毒素与纳米SiO2复合作用于HeLa细胞后,在24 h时段,细胞死伤率较单一4′-去甲基表鬼臼毒素高出15%,72 h时段高出26%,说明复合后的药物药效有了明显提高;而纳米SiO2为1.25和0.125 μg/mL时,24 h时段虽不明显,细胞死伤幅度虽仅有2%~5%,但48~72 h细胞死伤率高出单一4′-去甲基表鬼臼毒素15%~20%。说明纳米SiO2与4′-去甲基表鬼臼毒素联合用药后显著提高了药物对HeLa细胞的增殖抑制能力,故提高单位4′-去甲基表鬼臼毒素的用药效果,进而降低药物的毒副作用。经统计得出:同一时间不同比例的联合用药组间比较、同一比例不同时间的联合用药之间的组内比较均差异显著(P<0.01)。
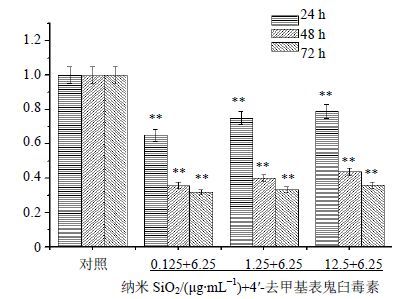
|
图 5 联合用药后在24、48、72h时段对HeLa细胞的增殖抑制作用(x±s,n=3) Fig. 5 Inhibition on HeLa cell growth of drug combination with different concentrations in 24、48 and 72h (x±s,n=3) |
3.3 细胞Hoechst染色结果 3.3.1 纳米SiO2的细胞相容性
图 6为对照组的正常HeLa细胞和100 μg/mL纳米SiO2小球作用24、48 h时后HeLa细胞的染色照片,由图可见HeLa细胞结构正常,核完整,偶见核浓缩、小而圆的凋亡小体,证明其细胞相容性良好。
3.3.2 鬼臼毒素和4′-去甲基表鬼臼毒素诱导细胞凋亡图 7A为50 μg/mL鬼臼毒素作用72 h的细胞照片,可见数量较多的凋亡小体,无正常细胞结构,核碎裂,细胞死亡;图 7B为50 μg/mL 4′-去甲基表鬼臼毒素作用72 h后的细胞照片,可见细胞微核,边集现象严重,无正常细胞结构,核碎裂,细胞死亡。

|
图 6 纳米SiO2作用前、后的细胞凋亡形态图 Fig. 6 Apoptosis morphology figure before and after action of nano SiO2 |
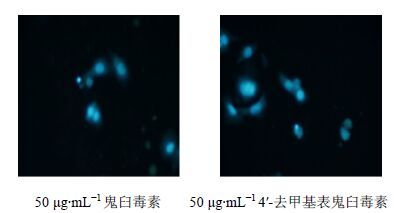
|
图 7 鬼臼毒素及4′-去甲基表鬼臼毒素作用后的细胞凋亡形态图 Fig. 7 Apoptosis morphology figure after action of podophyllotoxin and 4′-demethylepi-podophyllotoxin |
3.4 细胞形态
对照组细胞结构完整,有触角,细胞密集,细胞核色泽均一;给药组随作用时间的延长和SiO2比例的降低,细胞分散,体积缩小,细胞核固缩,核膜皱缩、崩解后胞浆弥散,72 h时细胞核裂解为碎块,产生凋亡小体。当纳米SiO2浓度为0.125 μg/mL,4′-去甲基表鬼臼毒素浓度为6.25 μg/mL时细胞凋亡最明显,即该组联合用药的药效最佳。结果见图 8。
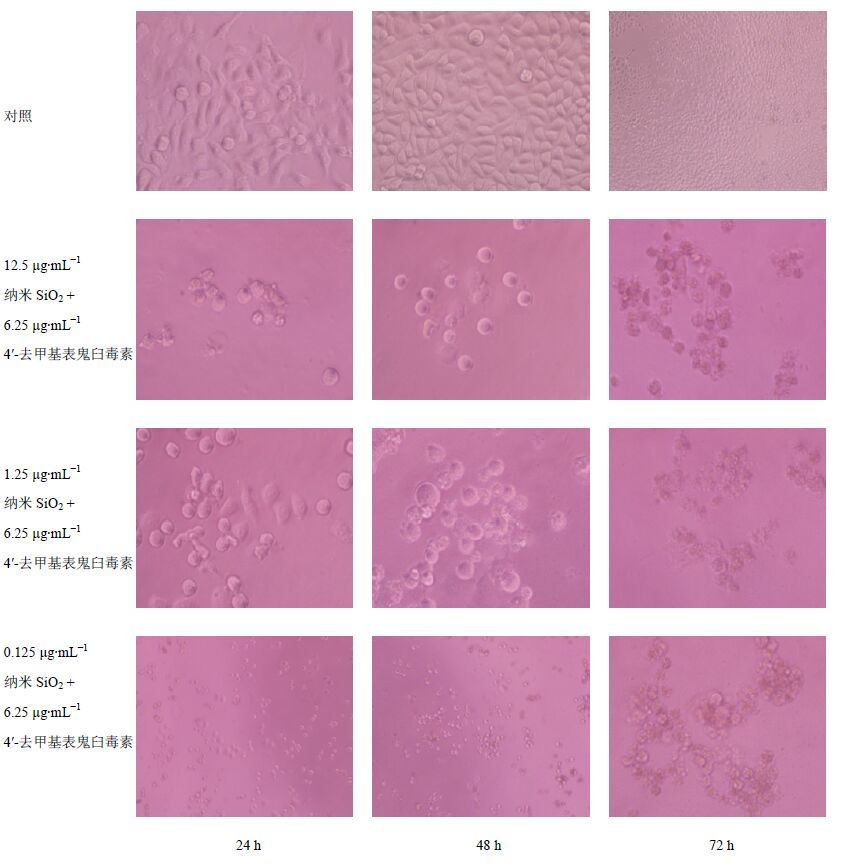
|
图 8 联合用药后的细胞凋亡形态图 Fig. 8 Apoptosis morphology figure after action of drug combination |
3.5 药物对凋亡相关蛋白表达的影响
经4′-去甲基表鬼臼毒素和联合用药作用于HeLa细胞后发现,与对照组比较,除6.25 μg/mL纳米SiO2外,给药组Bcl-2的表达降低,Bax、Caspase-3、p53、p38的表达均有所提高,且联合用药的表达量高于单一4′-去甲基表鬼臼毒素,随着联合用药中SiO2比例的降低,其表达量随之增高。联合用药的Bax/Bcl-2大于单一鬼臼毒素,且1.25 μg/mL纳米SiO2与6.25 μg/mL 4′-去甲基表鬼臼毒素联合用药时,Bax/Bcl-2的比例值最大,1.25 μg/mL纳米SiO2与6.25 μg/mL 4′-去甲基表鬼臼毒素联合用药时Caspase-3、P53、P38的表达量最高,结果见图 9。
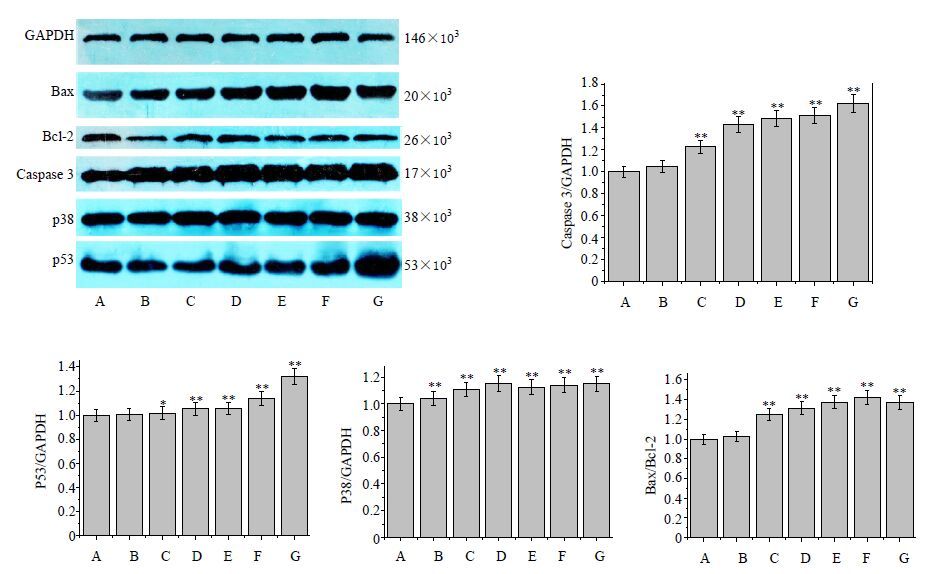
|
A:对照组;B:6.25 μg·mL-1纳米SiO2;C:10 μg·mL-1顺铂;D:6.25 μg·mL-1 4′-去甲基表鬼臼毒素;E:12.5 μg·mL-1纳米SiO2 + 6.25 μg·mL-1 4′-去甲基表鬼臼毒素;F:1.25 μg·mL-1纳米SiO2 + 6.25 μg·mL-1 4′-去甲基表鬼臼毒素;G:0.125 μg·mL-1纳米SiO2 + 6.25 μg·mL-1 4′-去甲基表鬼臼毒素 A: control group; B: 6.25 μg·mL-1 nano SiO2; C: 10 μg·mL-1 cisplatin; D: 6.25 μg·mL-1 4′-demethylepi-podophyllotoxin; E: 12.5 μg·mL-1 nano SiO2 + 6.25 μg·mL-1 4′-demethylepi-podophyllotoxin; F: 1.25 μg·mL-1 nano SiO2 + 6.25 μg·mL-1 4′-demethylepi-podophyllotoxin; G: 0.125 μg·mL-1 nano SiO2 + 6.25 μg·mL-1 4′-demethylepi-podophyllotoxin 图 9 不同药物对HeLa细胞Bax、Bcl-2、Caspase-3、P53、P38蛋白表达的影响(x±s,n=3) Fig. 9 Effect of different drugs on Bax,Bcl-2,Caspase-3,P53 and P38 protein expression in Hela cell (x±s,n=3) |
由凋亡相关蛋白的表达变化初步推测,药物诱导HeLa细胞凋亡的可能机制为:一方面,P38蛋白高表达促进P53蛋白表达,进而促进Caspase-3蛋白高表达,Caspase-3蛋白的高表达可以直接引起肿瘤细胞的凋亡发生,从而抑制肿瘤的增殖;另一方面,P53蛋白质的高表达可以促进Bax蛋白质的高表达,Bax蛋白可以经由线粒体凋亡途径诱发细胞凋亡,而Bcl-2蛋白可以拮抗Bax蛋白的功能,Bax/Bcl-2比例的增高,提示其仍可促进细胞凋亡。见图 10。
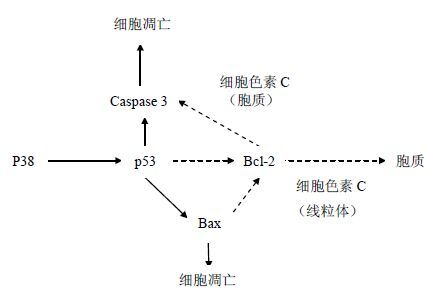
|
图 10 鬼臼毒素、4′-去甲基表鬼臼毒素和联合用药诱导HeLa细胞凋亡通路图 Fig. 10 HeLa apoptosis pathway induced by podophy- llotoxin and 4′-demethylepi-podophyllotoxin and drug combination |
4 讨论
本研究通过正硅酸乙酯水解法制备出25 nm SiO2,并将其表面改性后搭载4′-去甲基表鬼臼毒素。X射线衍射图谱和TEM结果显示,纳米SiO2小球为粒径较小且分散性良好的单相。MTT实验和Hoechst 33342染色结果表明,纳米SiO2载体具有良好的细胞相容性,鬼臼毒素及4′-去甲基表鬼臼毒素和联合用药对HeLa细胞的增殖均有明显的抑制作用,且呈现一定的剂量依赖性,相同剂量下4′-去甲基表鬼臼毒素的细胞抑制效果优于鬼臼毒素,联合用药的细胞抑制效果均优于鬼臼毒素及4′-去甲基表鬼臼毒素,纳米SiO2浓度为0.125 μg/mL,4′-去甲基表鬼臼毒素浓度为6.25 μg/mL时细胞抑制效果最佳。Hoechst 33342染色后的细胞凋亡照片表明,药物作用于HeLa细胞后,均可以使细胞分散,体积缩小,细胞核固缩,核膜皱缩、崩解后胞浆弥散,弥散程度与浓度梯度呈正相关,纳米SiO2浓度为0.125 μg/mL,4′-去甲基表鬼臼毒素浓度为6.25 μg/mL时细胞凋亡最明显。细胞凋亡相关蛋白表达变化表明,1.25 μg/mL纳米SiO2与6.25 μg/mL 4′-去甲基表鬼臼毒素联合用药时,Bax/Bcl-2的比例值最大,1.25 μg/mL纳米SiO2与6.25 μg/mL 4′-去甲基表鬼臼毒素联合用药时,Caspase-3、P53、P38的表达量最高。
鬼臼毒素类药物影响肿瘤细胞中凋亡相关蛋白的表达,从而诱导了肿瘤细胞的凋亡。目前认为,Bcl-2抗凋亡的机制主要有:拮抗促凋亡基因Bax;抑制促凋亡的蛋白质细胞色素c自线粒体释放到胞质;阻止胞质中的细胞色素c激活Caspase[9];有抗氧化及维持细胞内钙稳态等作用。Bax基因属于Bcl-2基因家族,编码的Bax蛋白可与Bcl-2形成异二聚体,Bcl-2蛋白可以拮抗Bax蛋白的功能。有文献报道,Bax与Bcl-2蛋白之间的比值大小是决定药物对细胞凋亡抑制作用强弱的关键因素[10-13]。Bax/Bcl-2比值降低时抑制细胞凋亡,比值增高时促进细胞凋亡。Caspase-3能裂解多种蛋白质,处于细胞凋亡的下游,是凋亡级联反应中最关键的酶之一,是凋亡的终结执行者之一。P53被称为最重要的抑癌基因,能防止细胞损伤和正常细胞恶化,在一半以上的人类肿瘤中发现P53失活或突变,各种刺激可造成DNA损伤,然后再激活P53。文献报道,P53与Bcl-2基因间可能存在相互作用,P53可能作为Bcl-2基因的负调控因子下调其表达[14-16]。P38信号通路是MAPK(丝裂原活化蛋白激酶)通路的一个重要分支。在炎症、细胞应激、细胞凋亡、细胞周期和增殖等多种生理和病理过程中起重要作用。P38 MAPK是介导细胞因子及应急刺激导致细胞凋亡、分化及炎症反应的重要细胞内信号转导途径[17]。
综上所述,单一4′-去甲基表鬼臼毒素的药效高于单一鬼臼毒素,联合用药的药效均优于单一4′-去甲基表鬼臼毒素,且纳米SiO2浓度为0.125 μg/mL,4′-去甲基表鬼臼毒素浓度为6.25 μg/mL时药效最佳。
鬼臼毒素存在于小檗科的八角莲属、桃儿七属和山荷叶属等少数科属中,天然生药资源生长缓慢,繁殖力低,结实少,生态区域局限,由于其具有较高的药用价值而被人们大肆采伐,致使许多种类已成濒危植物。因此,一方面可以通过引种栽培、组织培养等方法扩大和繁殖该科属植物,另一方面加强对鬼臼毒素及异构体或衍生物研究,与此同时,利用高分子生物技术,探索最佳载体和载体与药物最佳浓度比例,通过提高药物的溶解性、载药量、生物利用度和药效,降低药物的价格、耐药性和毒副作用等,以解决原料短缺、毒副作用大、药物价格昂贵的问题。
| [1] | 王琦, 韩凯, 陈平姣, 等. 鬼臼毒素及其衍生物在多种病毒性疾病中的应用[J]. 皮肤性病诊疗学杂志, 2014,21(4):348–350. |
| [2] | 许晓辉, 孙陶利, 许莉莉, 等. 鬼臼毒素类新药的研发思路[J]. 转化医学杂志, 2014,3(3):162–165. |
| [3] | 孙彦君, 李占林, 陈虹, 等. 鬼臼类植物化学成分和生物活性研究进展[J]. 中草药, 2012,43(8):1626–1634. |
| [4] | 陆艳玲, 左松, 师少宇, 等. 新型鬼臼毒素衍生物的合成及其抗肿瘤活性[J]. 中国药物化学杂志, 2010,20(2):90–95. |
| [5] | 马保玉, 耿耘, 李永超, 等. 4'-去甲基-4'-氧-环丁甲酰基-去氧鬼臼毒素及鬼臼苦素抑制肿瘤细胞增殖作用研究[J]. 中华中医药学刊, 2014,32(12):2889–2891. |
| [6] | 吕晶晶, 陈虹, 曹波, 等. 鬼臼毒素衍生物CIP-36诱导KBV 200细胞凋亡[J]. 药物评价研究, 2010,33(4):267–271. |
| [7] | 黄雄, 林敏超, 余柏村, 等. 鬼臼毒素及其衍生物新型制剂抗肿瘤作用研究进展[J]. 中国实验方剂学杂志, 2012,18(13):296–299. |
| [8] | 种树彬, 曾抗, 李国锋, 等. 鬼臼毒素纳米脂质载体诱导永生化人宫颈上皮细胞凋亡的作用及机制[J]. 山东医药, 2011,51(15):7–9. |
| [9] | 郭曼曼, 王国伟, 徐骏军, 等. 载三氧化二砷pH值响应介孔二氧化硅纳米粒的制备及体内外评价[J]. 中草药, 2015,46(7):982–989. |
| [10] | 贺艳杰, 李玉华, 卢会芳. 线粒体通路和死亡受体通路在中华眼镜蛇毒组分诱导KG1a细胞凋亡中的作用[J]. 中国药理学通报, 2013,29(3):356–360. |
| [11] | 刘郁东, 郑启新, 吴宏斌. 雷帕霉素对不同肿瘤细胞Bax/Bcl-2和活性caspase-3表达的影响[J]. 肿瘤, 2013,33(2):138–143. |
| [12] | Zhou C, Li X, Du W. Antitumor effects of ginkgolic acid inhuman cancer cell occur via cell cycle arrest and decrease the Bcl-2/Bax ratio to induce apoptosis[J]. Chemotherapy, 2010, 56(5):393–402. doi:10.1159/000317750 |
| [13] | 谷满仓, 钱亚芳, 孙悦. 薏苡仁脂调控凋亡相关蛋白Bax、Bcl-2及Survivin增强胰腺癌细胞对吉西他滨敏感性的研究[J]. 中国药理学通报, 2013,29(4):491–494. |
| [14] | 孙晓芳, 段斐, 牛建昭. 三七总皂苷对肺纤维化小鼠细胞凋亡及Bax/Bcl-2表达的影响[J]. 重庆医学, 2013,42(10):1125–1127. |
| [15] | 哈木拉提·吾甫尔, 艾斯卡尔·依米提, 伊力哈木江·沙比提. 异常黑胆质成熟剂与清除剂对人Hela细胞凋亡基因表达的影响[J]. 细胞与分子免疫学杂志, 2001,17(2):109–111. |
| [16] | Li L, Li H J, Zhi J S, et al. ZM-66, a new podophyllotoxin derivative inhibits proliferation and induces apoptosis in K562/ADM cell[J]. Chin Med Sci, 2014, 3:174–179. |
| [17] | Haupt S, Berger M, Goldberg Z, et al. Apoptosis-the p53 network[J]. Cell Sci, 2003, 116:4077–4085. doi:10.1242/jcs.00739 |
| [18] | 韩玉霞, 王震, 张倩, 等. 牛布鲁菌侵染对HPT-8细胞P38基因转录水平的影响[J]. 动物医学进展, 2015,36(4):1–6. |
 2017, Vol. 40
2017, Vol. 40


