缺血性脑卒中是脑血管病的主要类型,好发于中老年人,且具有较高的病死率,对人们的生活质量造成了严重的影响。近年来,中医药治疗缺血性脑卒中取得了较好的疗效,显示出重要作用。
牛黄是温病三宝之一安宫牛黄丸的君药,也是清开灵、牛黄解毒片等中成药的主要成分,其临床应用范围广泛,在药物研发中占有重要地位。牛黄的有效成分主要包括胆汁酸、胆红素、牛磺酸、甘氨酸及多种微量元素等。胆酸类物质,如猪去氧胆酸(hyodesoxycholicacid,HDCA)、熊去氧胆酸(ursodeoxycholicacid,UDCA)、牛磺熊去氧胆酸(aurine-conjugatedursodeoxycholicacid,TUDCA)、牛磺酸,都得到了较广泛的研究和应用,发挥了强大的脑保护作用,如清开灵注射液选用胆酸和猪去氧胆酸作为牛黄的替代品,TUDCA在近来的报道中表现出了较好的药效。但牛黄有效成分的抗脑缺血药效缺乏比较研究。
内质网应激(endoplasmic reticulum stress,ERS)介导的细胞凋亡是缺血性脑卒中的重要病理基础,且很可能是牛黄有效成分的起效机制。内质网是蛋白质翻译、合成、修饰、折叠及储存Ca2+的重要场所,并且调节细胞应激反应[1-2]。细胞损伤时,内质网应激反应启动:未折叠蛋白在内质网中蓄积,激活未折叠蛋白反应(UPR),内质网的Ca2+平衡被打破。因此,本课题拟比较牛黄中有效成分抗脑梗死的药效,并探讨其对内质网应激相关通路的影响。
1 材料 1.1 实验动物雄性SD大鼠,体质量210~230 g,由北京斯贝福生物技术有限公司提供,动物合格证号SCXK(京)2015-0005。
1.2 药物及主要试剂清开灵(神威药业集团有限公司,批号Z13020791,规格每支2 mL);TUDCA、牛磺酸,均购于上海阿拉丁生化科技股份有限公司,质量分数分别为98%、99%;UDCA、TTC,均购于上海生工生物工程股份有限公司,质量分数均为98%;PERK、EIF2α、ATF4抗体(美国Abcam公司)。
1.3 仪器LiDE120扫描仪(日本佳能);RM2135切片机(德国Lecia公司);尼龙线栓(北京沙东生物)。
2 方法 2.1 分组及给药SD大鼠随机分成以下6组:假手术组、模型组、清开灵(3 mL/kg)组、牛磺酸(25 mg/kg)组、UDCA(78 mg/kg)组、TUDCA(100 mg/kg)组,剂量设置根据以往研究结果[3],其中牛磺酸、UDCA、TUDCA给药的物质的量相同。于造模同时及造模后4、12 h ip给药,假手术组和模型组注射相同体积的生理盐水。
2.2 脑缺血再灌注模型的制备用10%水合氯醛350 mg/kg麻醉大鼠,腹面向上,颈部备皮并消毒。沿颈部正中切开,钝性分离右侧胸锁乳突肌与胸骨舌肌的肌间隙,暴露颈总动脉,并分离颈内动脉及颈外动脉,动脉夹夹住颈总动脉,结扎颈外动脉,并于颈外动脉游离端剪一小口,将制备好的线栓经该口插入,拉直与颈内动脉的夹角。将线栓顺颈内动脉与颈外动脉分叉处进入颈内动脉,缓缓推进,直到遇轻度阻力,系紧松结,维持体温37 ℃,术后1.5 h后拔出线栓,单笼饲养。大鼠造模清醒后,提尾倒悬,患侧对侧上肢向胸前屈曲视为模型成功,并进行Garcia J H评分,假手术组暴露分离颈总动脉、颈内动脉、颈外动脉,但不插入线栓。
2.3 神经功能评分造模后24 h采用盲法进行神经功能评分,采用Garcia J H评分进行评价,功能正常时得分最高(18分),功能损伤最严重者得分最低(3分)。具体评分细则见表 1。
2.4 TTC法测定脑梗死体积神经功能评分后,处死大鼠,取脑做TTC染色。从距额极3 mm处作连续的冠状切片,每片厚度约为2 mm。并将大脑切片浸泡在2%的TTC染液中,37 ℃恒温避光10 min,正常脑组织经TTC染液染为红色,梗死区域并不染色,则为白色。将脑片置于4%多聚甲醛溶液中,固定40 min后,将脑片依次排列,进行正反面扫描。利用IPP软件测量白区域面积、总面积,计算脑梗死体积、脑总体积、梗死体积占总体积的百分比,来评价脑梗死严重程度。
| 表 1 Garcia J H大鼠神经功能评分标准 Table 1 Garcia J H neurological function score |
梗死体积=(正面白区域面积+反面白区域面积)/2×2 mm
总体积=(正面总面积+反面总面积)/2×2 mm
2.5 免疫组化法检测ERS相关蛋白表达将石蜡切片常规脱蜡至水,抗原修复,滴加PERK、EIF2α、ATF4抗体,复染,滴加分色液,滴加反蓝液,观察细胞着色情况,每个脑组织选取5张切片在光学显微镜下观察,由Image Pro Plus 6.0计数阳性细胞的数量。
2.6 Western blotting检测ERS相关蛋白表达脑缺血再灌注24 h后麻醉动物,迅速断头取缺血侧海马、皮层,按组织质量:裂解液体积=1:9比例加入裂解液,BCA法测定蛋白质浓度,配置5%的浓缩胶,12%的分离胶,20 μg蛋白上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,半干法转至PVDF膜上,5%脱脂牛奶封闭,室温轻摇30 min,
加入用3%BSA-TBST稀释的一抗P-EIF2α (1:500)、P-PERK(1:1 000)、ATF4(1:2 000)室温孵育10 min,放4 ℃过夜,次日滴加山羊抗兔IgG(H+L)/HP(1:20 000),室温轻摇40 min。以Image J医学图像分析系统进行半定量分析,以目标蛋白的灰度值GAPDH灰度值的比值反应目标蛋白的表达水平。
2.7 数据处理采用SPSS 20.0软件进行统计分析,各项检测结果均以表示,采用单因素方差分析(One-Way ANOVA)方法,方差不齐用非参数检验。
3 结果 3.1 对脑缺血再灌注大鼠神经功能评分的影响假手术组无损伤行为,而缺血再灌注24 h后,多数大鼠出现左侧偏瘫,并向左侧打圈,提尾后左前肢出现曲屈、内收、紧靠胸壁。与假手术组比较,模型组神经功能评分显著降低(P<0.01);与模型组比较,清开灵组、TUDCA组、UDCA组神经功能评分显著升高(P<0.05、0.01),同时牛磺酸组同样升高了神经功能的评分,但无统计学差异。
| 表 2 脑缺血再灌注损伤大鼠神经功能评分(x±s,n = 10) Table 2 Neurological function score of rats with cerebral ischemia reperfusion injury (x±s,n = 10) |
3.2 对脑缺血再灌注损伤大鼠脑梗死体积的影响
假手术组呈现均匀的红色,而模型组则表现出严重的缺血灶,与假手术组比较,模型组大鼠梗死明显(P<0.01);与模型组比较,各给药组均能明显减少脑梗死体积(P<0.01);与TUDCA组比较,牛磺酸组、UDCA组脑梗死体积明显扩大(P<0.01)。梗死体积从大到小顺序为:模型组>UDCA组>牛磺酸组>TUDCA组>清开灵组。结果见图 1和表 3。
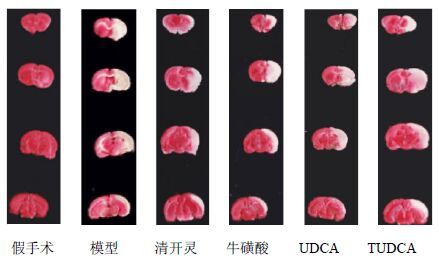
|
图 1 牛黄有效成分对脑缺血再灌注损伤大鼠脑梗死体积的影响 Fig. 1 Effect of effective components of bezoar on cerebral infarction volume in rats with cerebral ischemia reperfusion injury |
| 表 3 牛黄有效成分对脑缺血再灌注损伤大鼠梗死体积的影响(x±s,n = 10) Table 3 Effect of effective components of bezoar on cerebral infarction volume in rats with cerebral ischemia reperfusion injury (x±s,n = 10) |
3.3 免疫组化法检测内质网应激相关蛋白表达
P-PERK、P-EIF2α、ATF4蛋白表达于皮层及海马神经元胞浆及神经轴突树突。与假手术组比较,模型组大鼠P-PERK阳性细胞数显著增加(P<0.01);与模型组比较,清开灵、牛磺酸、TUDCA均能显著减少海马区P-PERK表达(P<0.05、0.01),UDCA同样减少了P-PERK表达,但差异不显著;清开灵、TUDCA显著减少皮层区P-PERK表达(P<0.05、0.01),牛磺酸、UDCA差异不显著。结果提示,清开灵、TUDCA减少P-PERK表达的作用最明显。见图 2和表 4。
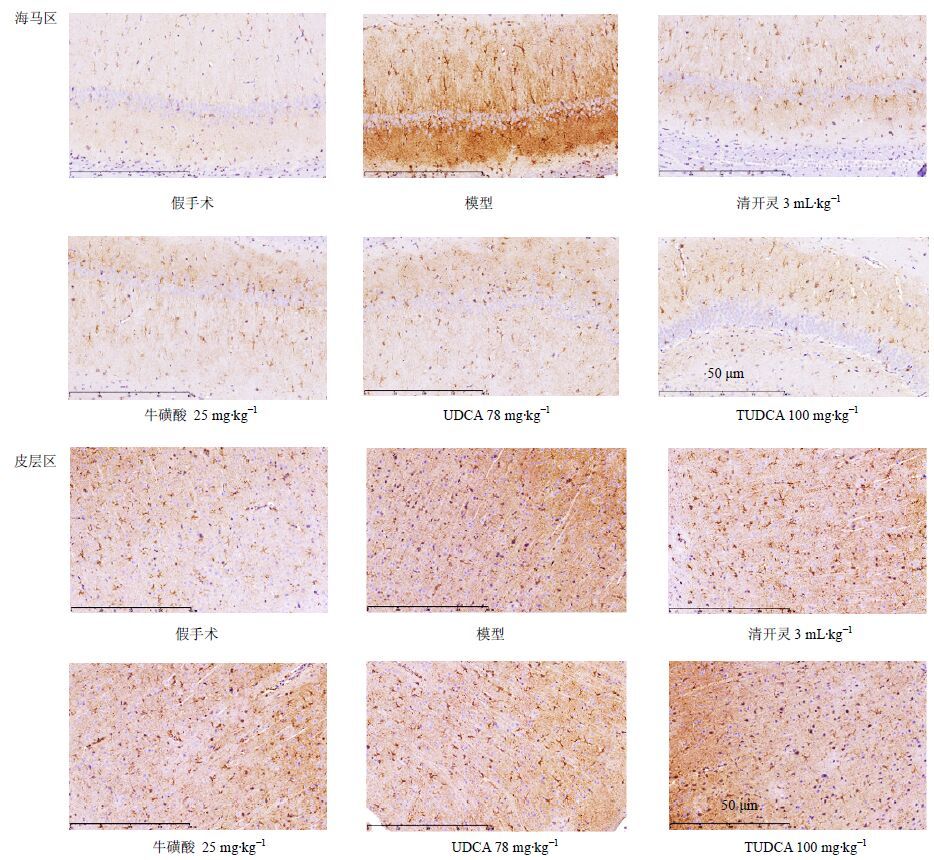
|
图 2 牛黄有效成分对脑缺血再灌注损伤大鼠缺血半暗带P-PERK表达的影响 Fig. 2 Effect of effective components of bezoar on P-PERK expression of ischemic penumbra in rats with cerebral ischemia reperfusion injury |
| 表 4 牛黄有效成分对脑缺血再灌注损伤大鼠缺血半暗带P-PERK表达的影响(x±s,n = 10) Table 4 Effect of effective components of bezoar on P-PERK expression of ischemic penumbra in rats with cerebral ischemia reperfusion injury (x±s,n = 10) |
与假手术组比较,模型组大鼠P-EIF2α阳性细胞数显著增加(P<0.01);与模型组比较,清开灵、牛磺酸、UDCA、TUDCA均能减少海马区、皮层区P-EIF2α表达,其中清开灵、TUDCA组差异显著(P<0.05、0.01),牛磺酸、UDCA组差异不显著。结果见图 3和表 5。
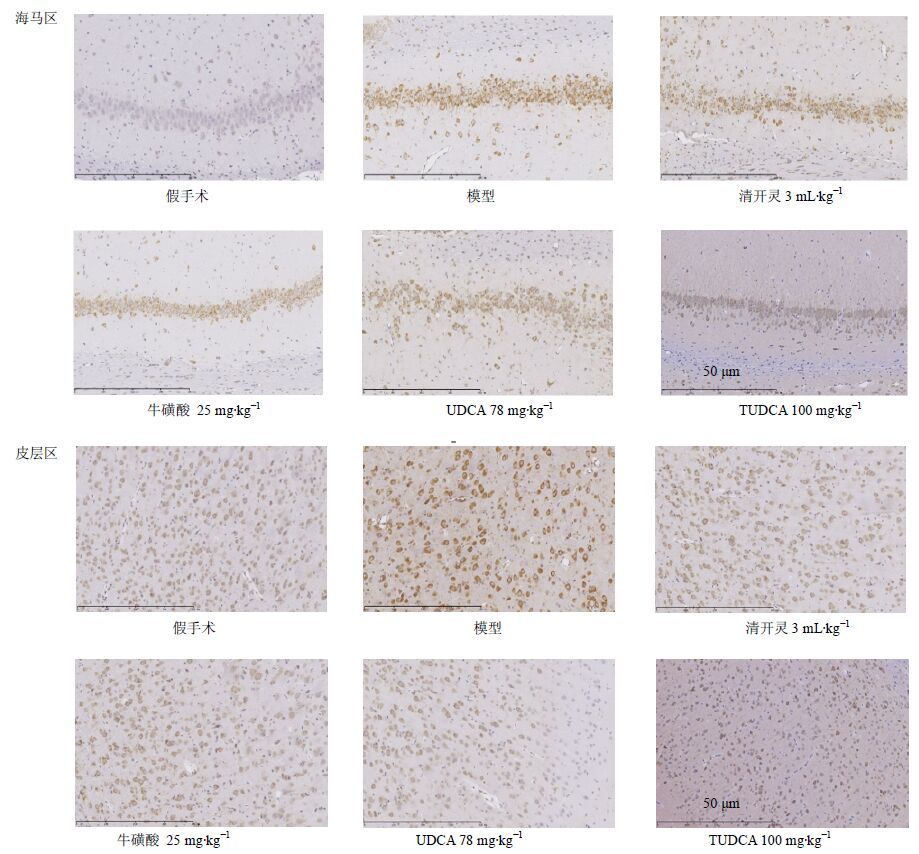
|
图 3 牛黄有效成分对脑缺血再灌注损伤大鼠缺血半暗带P-EIF-2α表达的影响 Fig. 3 Effect of effective components of bezoar on P-EIF-2α expression of ischemic penumbra in rats with cerebral ischemia reperfusion injury |
| 表 5 牛黄有效成分对脑缺血再灌注损伤大鼠缺血半暗带P-EIF-2α表达的影响(x±s,n = 10) Table 5 Effect of effective components of bezoar on P-EIF-2α expression of ischemic penumbra in rats with cerebral ischemia reperfusion injury (x±s,n = 10) |
与假手术组比较,模型组大鼠ATF4阳性细胞数显著增加(P<0.01);与模型组比较,清开灵、UDCA、TUDCA均能显著减少海马区ATF4表达(P<0.01),牛磺酸同样减少海马区ATF4表达,但差异不显著;清开灵、牛磺酸、UDCA、TUDCA均可显著减少皮层区ATF4表达(P<0.05、0.01)。与TUDCA组比较,UDCA组皮层区ATF4阳性细胞数显著增加(P<0.05)。结果见图 4和表 6。
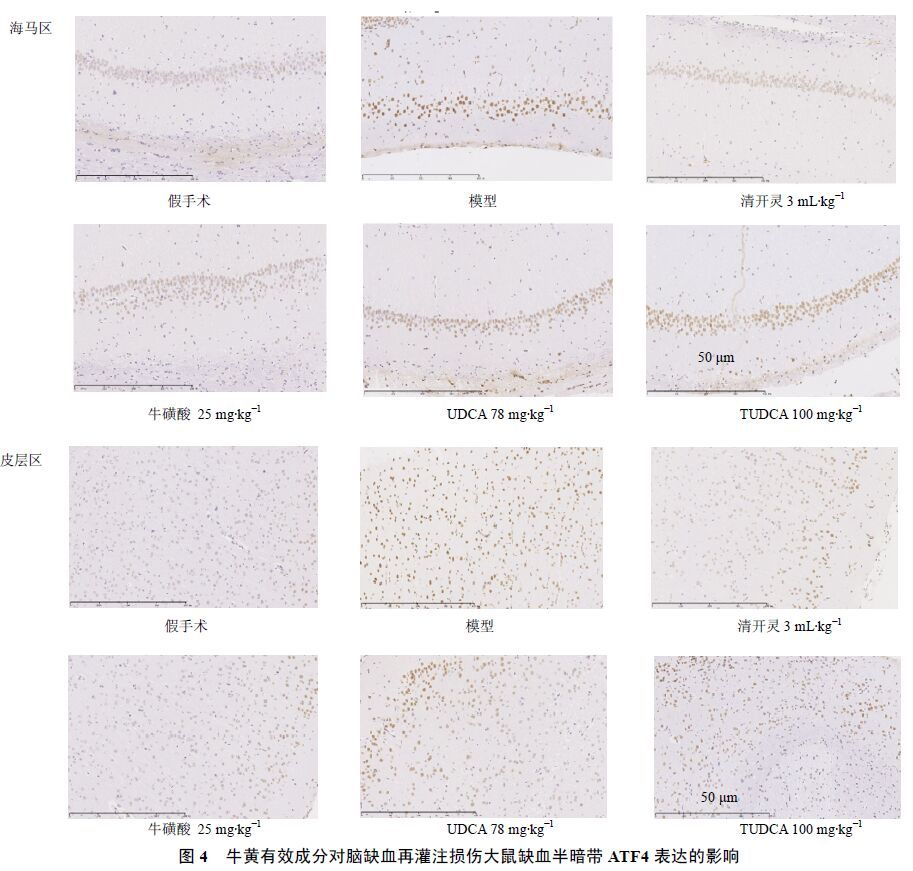
|
图 4 牛黄有效成分对脑缺血再灌注损伤大鼠缺血半暗带ATF4表达的影响 Fig. 4 Effect of effective components of bezoar on ATF4 expression of ischemic penumbra in rats with cerebral ischemia reperfusion injury |
| 表 6 牛黄有效成分对脑缺血再灌注损伤大鼠缺血半暗带ATF4表达的影响(x±s,n = 10) Table 6 Effect of effective components of bezoar on ATF4 expression of ischemic penumbra in rats with cerebral ischemia reperfusion injury (x±s,n = 10) |
3.4 Western blotting法检测内质网应激相关蛋白表达
与假手术组比较,模型组大鼠P-PERK、P-EIF2α、ATF4蛋白表达显著增加(P<0.01);与模型组比较,清开灵、牛磺酸、UDCA、TUDCA均能显著减少P-PERK、P-EIF2α、ATF4蛋白表达(P<0.01);与TUDCA组比较,牛磺酸、UDCA组P-PERK、P-EIF2α、ATF4蛋白表达显著增加(P<0.05、0.01)。结果见图 5和表 7。

|
图 5 牛黄有效成分对脑缺血再灌注损伤大鼠P-PERK、P-EIF-2α、ATF4表达的影响 Fig. 5 Effect of effective components of bezoar on P-PERK,P-EIF-2α and ATF4 expression of ischemic penumbra in rats with cerebral ischemia reperfusion injury |
| 表 7 牛黄有效成分对脑缺血再灌注损伤大鼠P-PERK、P-EIF-2α、ATF4蛋白表达的影响(x±s,n = 4) Table 7 Effect of effective components of bezoar on P-PERK,P-EIF-2α and ATF4 expression in rats with cerebral ischemia reperfusion injury (x±s,n = 4) |
4 讨论
本实验证实了TUDCA的药效好于牛磺酸、UDCA,而TUDCA是由UDCA的羧基与牛磺酸的氨基缩水而成的结合型胆汁酸。在天然牛黄中,结合型胆汁酸比例较大,并且是发挥作用的主要成分,而人工牛黄中,游离型胆汁酸比例较大。尽管人工牛黄与天然牛黄成分类似,但是药效差别比较明显,因此,本课题组推测,天然牛黄的药效好于人工牛黄的原因可能是天然牛黄中含有较多的结合型胆红素,同时在药物的研发过程中,人工牛黄较多关注了游离型胆汁酸,而忽略了氨基酸和结合型胆汁酸的含量。因此,在药物的研发过程中,胆汁酸和氨基酸的含量以及是否结合等关键问题会直接影响着药效的发挥。
内质网应激介导的细胞凋亡是缺血性脑卒中重要的病理基础[1-2]。内质网是蛋白质翻译合成、修饰、折叠及储存Ca2+的重要场所,并且调节细胞应激反应。细胞损伤时,内质网应激反应启动:未折叠蛋白在内质网中蓄积,激活UPR反应,内质网的Ca2+平衡被打破。UPR信号转导通路[4]主要包括3条:PERK(protein kinase R-like ER kinase)通路、ATF6 (activating transcription factor 6)通路、IRE1(inositol-requiringenzyme1)通路,本研究通过P-PERK、P-EIF2α、ATF4等的表达情况研究了PERK通路。PERK是I型跨膜蛋白丝/苏蛋白激酶,属于真核细胞翻译起始复合物2α(EIF2α)激酶家族成员。当内质网应激发生时,PERK与GRP78解离,发生自身磷酸化被激活。当PERK激活后,主要特异性磷酸化EIF2α,下调EIF2α活性水平,降低新生蛋白的翻译速率,下调细胞内蛋白质合成的总体水平,保护内质网的功能[5],此外,磷酸化的eIF2α能够导致转录因子ATF4上调,ATF4进入胞核后激活C/EBP同源蛋白(C/EBP homology protein,CHOP)、生长抑制DNA损害诱导基因34、ATF3及关于氨基酸转运基因编码蛋白的表达,还可抑制氧化应激[4]。Henriksson等[6]证实了U0126能够通过抑制PERK的激活而减轻神经元的损伤。胡跃强等[7]研究发现缺血再灌注后PERK基因的表达明显上调,而脑缺血预处理后其表达有明显的下降,提示缺血预处理可能是通过影响内质网应激后PERK基因的表达而保护神经细胞。陈理军等[8]发现脑缺血可诱发内质网应激反应,激活PERK/EIF2α信号通路,而缺血后适应能够下调PERK、上调GRP78的表达,从而起到脑保护作用。申向民等[9]观察缺血再灌注后ATF4 mRNA及蛋白的表达,发现缺血再灌注可诱导ATF4在缺血半暗带的表达,提示ATF4中发挥了重要作用。
本实验观察脑缺血再灌注后的大鼠海马和皮层中P-PERK、P-EIF-2α、ATF4表达情况,假手术组低表达,模型组表达显著上升,而各给药组有不同程度的下降,其中尤以阳性药清开灵组、TUDCA组下降最明显,表明牛黄中有效成分能够抑制内质网应激,同时抑制PERK介导的UPR信号通路中相关基因的表达,从而发挥神经保护作用。尤以清开灵和TUDCA的保护作用最为明显。但由于内质网应激的机制较为复杂,且本实验仅检测了UPR中PERK通路的表达情况,因此,要明确缺血后处理减轻内质网应激的具体机制,仍存在许多值得深入探讨的地方。
| [1] | Malhi H, Kaufman R J. Endoplasmic reticulum stress in liver disease[J]. J Hepatol, 2011, 54(4):795–809. doi:10.1016/j.jhep.2010.11.005 |
| [2] | Oida Y, Shimazawa M, Imaizumi K, et al. Involvement of endoplasmic reticulum stress in the neuronal death induced by transient forebrain ischemia in gerbi[J]. Neuroscience, 2008, 151(1):111–119. doi:10.1016/j.neuroscience.2007.10.047 |
| [3] | Fa F, Cheng W T, Song X G, et al. Therapeutic window of Qingkailing injection for focal cerebral ischemia/reperfusion injury[J]. Neur Regen Res, 2011, 6(21):1605–1611. |
| [4] | 武彩霞, 刘睿, 杜冠华. 内质网应激与脑缺血/再灌注损伤[J]. 中国药理学通报, 2013,29(5):601–605. |
| [5] | Marciniak S J, Garcia-Bonilla L, Hu J, et al. Activation-dependent substrate recruitment by the eukaryotic translation initiation factor 2 kinase PERK[J]. J Cell Biol, 2006, 172(2):201–209. doi:10.1083/jcb.200508099 |
| [6] | Henriksson M, Stenman E, Vikman P, et al. MEKI/a inhibition attenuatesvascular ETA and ETB receptor alterations after cerebral ischemia[J]. Exp Brain, 2007, 178(4):470–476. doi:10.1007/s00221-006-0753-7 |
| [7] | 胡跃强, 唐农, 雷龙鸣, 等. 大鼠脑缺血预处理后PERK表达的变化及清热化瘀方的干预[J]. 时针国医国药, 2012,23(6):1332–1334. |
| [8] | 陈理军, 马艳, 李霞, 等. 脑缺血及后适应对树鼩海马内质网应激信号分子PERK及GRP78的影响[J]. 中国病理生理杂志, 2015,31(6):1105–1110. |
| [9] | 申向民, 杨期东, 谭利明, 等. 大鼠局灶性脑缺血再灌注后转录因子ATF4的表达变化[J]. 中风与神经疾病杂志, 2010,27(4):330–332. |
 2017, Vol. 40
2017, Vol. 40


